小肽对大黄鱼仔鱼生长和小肠发育的影响及其在低温胁迫下的抗氧化应激效应
2021-02-07李文成赵旭民张延军赵向炯
李文成 赵旭民 张延军 宋 炜,4 曾 霖 张 惠 赵向炯
(1.浙江海洋大学国家海洋设施养殖工程技术研究中心,舟山316000;2.中国水产科学研究院东海水产研究所,上海200090; 3.浙江华太生物科技有限公司,义乌322005;4.青岛海洋科学与技术试点国家实验室,青岛266237)
大黄鱼(Larimichthyscrocea)是我国南方沿海重要海洋经济鱼类,其营养丰富、口感鲜美,备受广大消费者的青睐[1]。自从20世纪80年代大黄鱼大批量人工育苗技术获得突破以来,其养殖业在福建、广东、浙江等地得到了迅速发展[2]。然而,冬春季大黄鱼繁殖期间,其仔稚鱼死亡率高,尤其是在浙江养殖区域。低温使鱼类处于胁迫生理状态,可能导致其生长缓慢、免疫力低下、疾病频繁爆发[3-4]。当前,养殖户滥用抗生素来防治和治理环境胁迫所诱导的鱼类疾病,这容易引起鱼类机体和水环境抗生素药物残留和病原菌耐药性等问题,影响了水产品和水环境安全,并阻碍了水产养殖的绿色发展。
当鱼类遭受环境胁迫时,导致活性氧(oxygen species,ROS)大量产生[5]。若机体不能有效控制ROS含量,将会产生蛋白质羰基化、脂质过氧化、DNA合成障碍等危害,从而导致鱼类生理功能失常[6]。鱼类可以通过抗氧化系统控制ROS过量产生,从而维持机体氧化还原平衡。环境胁迫能够上调抗氧化酶如过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽还原酶(glutathione reductase,GR)和谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)等基因的表达[7]。非酶抗氧化剂谷胱甘肽(glutathione,GSH)可与抗氧化酶协同作用,共同抑制ROS过量产生[8]。另外,鱼类的非特异性免疫系统在缓解胁迫诱导的损伤方面也发挥着重要作用,且与抗氧化系统密切相关[9]。作为非特异性免疫系统的重要组成部分,溶菌酶(lysozyme,LZM)和碱性磷酸酶(alkaline phophatase,AKP)基因表达水平通常被用作评价环境胁迫、细菌感染、免疫刺激剂等作用效应的分子生物标记物[10]。
基因表达水平主要受控于核转录因子(nuclear transcription factors,NFs)。在哺乳动物中,NF-E2相关因子2(NF-E2-related factor 2,Nrf2)和核转录因子-κB(nuclear transcription factor-κB,NF-κB)均能被ROS诱导激活,激活的Nrf2和NF-κB分别结合到抗氧化酶和非特异性免疫酶相关基因的顺式作用元件,从而调控这些目的基因的表达[11-12]。因此,Nrf2和NF-κB分别在抗氧化反应和非特异性免疫反应中发挥重要作用。
小肽又称为短肽、寡肽,是一类由蛋白质水解、易消化吸收且具有多种生物功能的小分子物质[13]。它能显著提高水生动物的摄食量、饲料效率及机体蛋白质合成能力,从而促进它们的生长。小肽也能改善水生动物的抗氧化性能和非特异性免疫力,从而降低发病率和提高抗逆性。已有研究表明,饲料中添加小肽可提高鱼类的抗氧化能力和非特异性免疫力[14-15],也能改善凡纳滨对虾(Litopenaeusvannamei)的抗病力[16]。然而,有关小肽营养强化活饵料对鱼类生理影响的研究尚未见报道。
本试验用小肽营养强化轮虫和卤虫投喂于大黄鱼仔鱼,以探讨小肽对其生长和小肠发育的影响,然后将大黄鱼仔鱼低温暴露24 h,以探讨小肽对低温胁迫下大黄鱼仔鱼抗氧化能力和非特异性免疫力的影响,该研究成果可为大黄鱼仔鱼养殖中小肽最佳营养强化浓度提供基础数据,也可为小肽缓解环境胁迫对鱼类损伤的研究提供理论支撑。
1 材料与方法
1.1 试验材料
1.1.1 小肽制备
利用猪小肠生产肝素钠的下脚料肠黏膜为原料,采用碱性水解蛋白酶和胰蛋白酶裂解制备小肽。使用凝胶色谱法测定小肽分子质量组成,分子质量小于2.0 ku的占80%以上。小肽氨基酸组成采用国家标准GB/T 18246—2000中方法测定,氮、五氧化二磷、氧化钾和有机质采用农业行业标准NY 525—2012中方法测定,其主要成分见表1。

表1 小肽主要成分(湿重基础)
1.1.2 轮虫和卤虫营养强化
轮虫营养强化:将宁德霞浦育苗场水泥池培育的褶皱臂尾轮虫(Brachionusplicatilis)以100~120条/mL的密度转移到5个容量为1 000 L的钢化玻璃桶的水体(海水800 L)中,加入小肽(体积百分浓度约为86.50%),使得水体中小肽浓度分别为0、0.5、1.0、2.0和3.0 mL/m3,在水温为(24.1±3.4) ℃、盐度为26.12±0.35、光照为3 000 lx的条件下进行营养强化。7 d以后,用250目尼龙筛绢网袋过滤收集10%体积的轮虫用于大黄鱼仔鱼投喂,然后再加入相同浓度和体积的小肽溶液,每天4次。将小肽浓度为0和2.0 mL/m3养殖桶中所收集的轮虫样本(20 mL)保存于-20 ℃冰箱,取样3次,用于粗蛋白质含量和氨基酸组成测定。
卤虫营养强化:将宁德霞浦育苗场孵化的卤虫Ⅰ龄无节幼体(体内卵黄已耗尽)按45~50 条/mL的密度放入5个容量为1 000 L的钢化玻璃桶水体(海水800 L)中,加入小肽(体积百分浓度约为86.50%),使得水体中小肽浓度分别为0、0.5、1.0、2.0和3.0 mL/m3,在水温为(26.0±2.3) ℃、盐度为26.12±0.35、自然光照的条件下营养强化24 h后,用250目尼龙筛绢网袋过滤收集卤虫用于大黄鱼仔鱼投喂。将小肽浓度为0和2.0 mL/m3养殖桶中所收集的卤虫样本(20 mL)保存于-20 ℃冰箱中,取样3次,用于粗蛋白质含量和氨基酸组成测定。
1.2 试验方法
1.2.1 试验1:大黄鱼仔鱼生长试验
从宁德霞浦育苗场购买7.5万尾左右刚孵化出的大黄鱼仔鱼,放入15个容积为300 L的钢化玻璃桶中饲养,约5 000尾/桶。将15桶试验鱼随机分为5组,每组3桶(重复),采用静水充气养殖,每天换水2次(08:00和16:00),换水率为60%。水质参数如下:水温为(24.1±3.4) ℃,盐度为26.12±0.35,pH为7.67±0.31;总氨氮浓度为(0.15±0.02) mg/L~(0.20±0.03) mg/L,各组之间无显著差异(P>0.05)。将经0、0.5、1.0、2.0和3.0 mL/m3小肽营养强化好的轮虫和卤虫按图1的投喂策略投喂5组大黄鱼仔鱼,并分别命名为对照组、S0.5组、S1.0组、S2.0组和S3.0组。每天投喂4次,投喂间隔6 h。大黄鱼仔鱼摄食0.5 h之后剩余少量的轮虫和卤虫即可停止投喂。试验结束后,每桶随机取10尾鱼,用精度为0.1 mm的游标卡尺测量体长。每桶随机取4尾鱼,用4%多聚甲醛-磷酸盐缓冲液(pH 7.2)固定,用于组织切片观察。组织切片制作具体步骤[17]如下:首先,样品采用梯度乙醇使其脱水,水杨酸甲酯透明,石蜡包埋;然后,用石蜡切片机切成矢状切片(厚度为4~6 μm),并用苏木素-伊红(HE)染色;最后,用光学显微镜观察切片,用分析软件Image-pro plus 6.0(Media Cybernetics, Inc.,美国)随机选取5处测量小肠绒毛高度(mm)(图2中红色线段),计数视野内绒毛数量并测量组织面积(mm2),并求出单位面积内绒毛数量(个/mm2)(图3)。

图1 轮虫和卤虫投喂策略
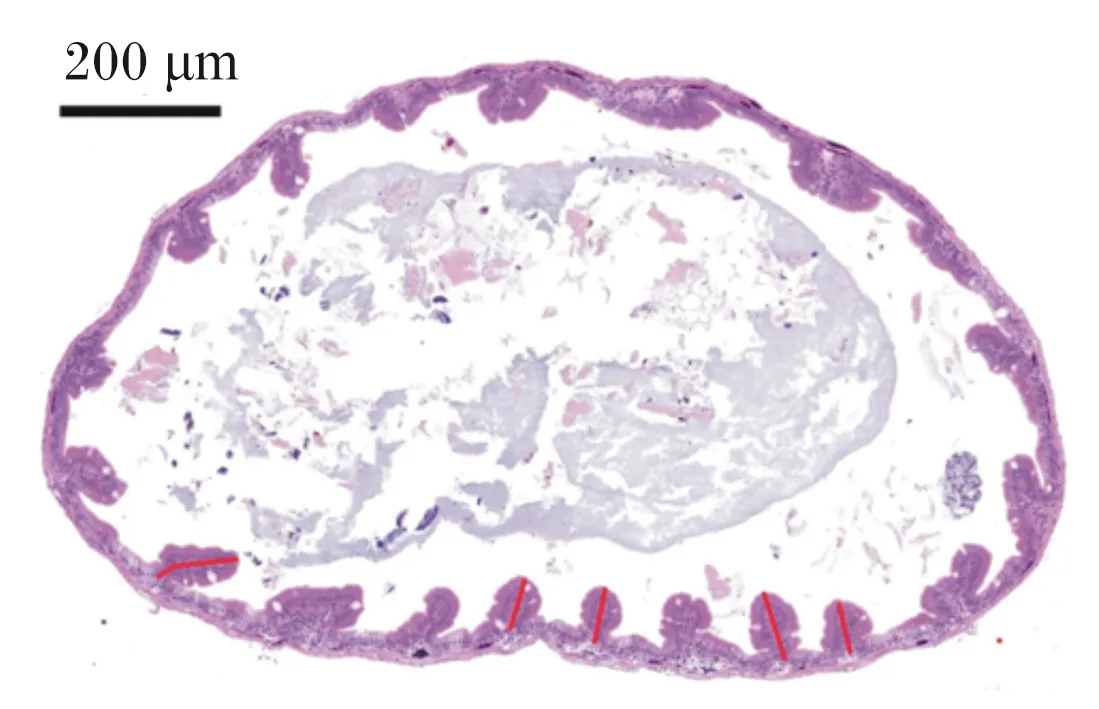
图2 大黄鱼仔鱼小肠绒毛高度示意图

图3 大黄鱼仔鱼小肠绒毛数量和组织面积示意图
1.2.2 试验2:大黄鱼仔鱼低温胁迫试验
选择21个容量为70 L的塑料桶,分为7组,每组3个桶(重复)。按图4所示,从试验1对应的钢化玻璃桶中随机取200尾鱼放入塑料桶中。2组采用常温处理,另外5组采用低温处理,分别命名为S0常温组、S1.0常温组、S0低温组、S0.5低温组、S1.0低温组、S2.0低温组和S3.0低温组。降温方式如下:将养殖桶水体温度以3 ℃/h降至12 ℃(自然海水温度),然后将12 ℃水温维持24 h。试验结束后取样,每桶取4尾试验鱼用于ROS和GSH含量测定,另取4尾试验鱼的肝脏用于基因表达测定。所有样本先放于液氮中,然后转移到-80 ℃超低温冰箱中保存。

图4 试验组示意图
1.3 指标测定
1.3.1 粗蛋白质含量和氨基酸组成
采用凯氏定氮法测定轮虫和卤虫中粗蛋白质含量。参照国家标准GB/T 18246—2000的方法进行样品处理,采用高效液相色谱仪测定其氨基酸组成。
1.3.2 ROS和GSH含量测定
全鱼均浆液制备参照Zeng等[18]的方法。向全鱼中加入9倍的4 ℃缓冲液[1 mmol/L 4-(2-氨甲基)苯磺酰氟盐酸、1 mmol/L苯甲脒、2 mmol/L二硫苏糖醇、5 mmol/L乙二胺四乙酸、80 mmol/L氨基丁三醇,pH 7.6),匀浆后制成10%匀浆液。在4 ℃下以900 r/min离心10 min,取上清,采用Bradford方法测量蛋白质含量,使用试剂盒(南京建成生物工程研究所产品)采用分光光度法测定ROS和GSH含量。
1.3.3 抗氧化和非特异性免疫相关基因的实时荧光定量PCR(RT-qPCR)检测


表2 实时荧光定量PCR引物序列

续表2基因名称Gene names引物序列Primer sequences (5'—3')基因长度Gene length/bpPCR扩增效率PCR amplification efficiency谷胱甘肽还原酶GRF:AGCCAAAACAGCCGTGATR:CGGCTAACATAAGCATCCC1260.98NF-E2相关因子2Nrf2F:CCCTCAAAATCCCTTTCACTR:GCTACCTTGTTCTTGCCGC900.96c型溶菌酶c-type LZMF:CCAGAGCCATCAACCACAACACTR:GATCGCCACGCTGACATCATC1520.97g型溶菌酶g-type LZMF:TCAGCCAAGGCACCGACATR:GCATCCACCGCTTCATAGCA1481.04碱性磷酸酶AKPF:TCAGCAGACTCCCGTCCCTCR:GTTGTCCAGTTCGCAGTTCTCATAG1750.98核转录因子-κBNF-κBF:TGCGGCTCGTGCGGATAR:GCGGCTTCAACTGGACTGC1171.05β-肌动蛋白β-actinF:TCGTCGGTCGTCCCAGGCATR:ATGGCGTGGGGCAGAGCGT1821.05
1.4 数据处理与统计分析
试验数据表示为平均值±标准误。采用SPSS 16.0统计软件进行分析,试验结果经单因素方差分析(one-way ANOVA)后,若存在显著差异,再采用Duncan氏法进行多重比较。以P<0.05为差异显著标准。
2 结果与分析
2.1 小肽对轮虫和卤虫的营养强化效果
与对照组相比,S2.0组轮虫和卤虫的粗蛋白质含量无显著变化(P>0.05)(表3)。与对照组相比,S2.0组轮虫和卤虫的必需氨基酸(EAA)和总氨基酸(TAA)含量显著增加(P<0.05),但2组之间的EAA/TAA差异不显著(P>0.05)(表4)。
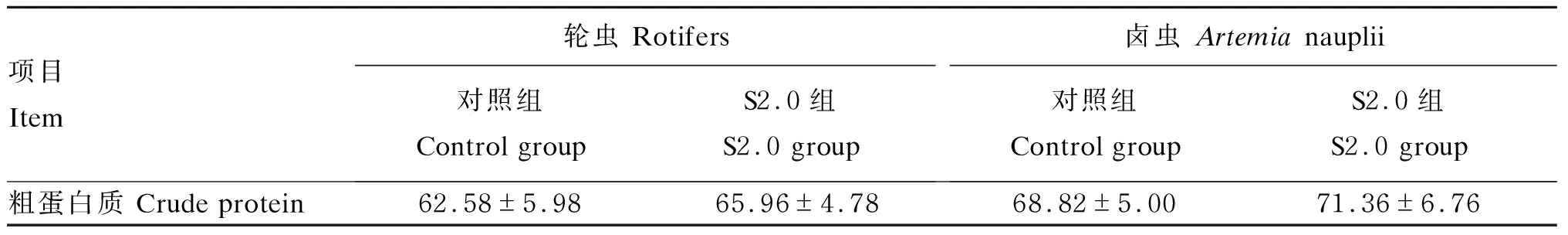
表3 小肽对轮虫和卤虫粗蛋白质含量的影响(干物质基础)

表4 小肽对轮虫和卤虫氨基酸组成的影响(占粗蛋白质的百分比)

续表4氨基酸Amino acids轮虫 Rotifers对照组Control groupS2.0组S2.0 group卤虫 Artemia nauplii对照组Control groupS2.0组S2.0 group甘氨酸 Gly4.37±0.295.14±0.22*3.37±0.293.64±0.25丙氨酸 Ala3.02±0.233.88±0.24*4.08±0.344.78±0.24*缬氨酸 Val2.96±0.143.73±0.21*3.12±0.243.62±0.21蛋氨酸 Met0.59±0.040.71±0.10*0.64±0.060.76±0.09异亮氨酸 Ile2.63±0.163.29±0.28*2.40±0.152.73±0.13*亮氨酸 Leu4.08±0.245.25±0.22*3.94±0.244.29±0.14酪氨酸 Tyr2.86±0.193.39±0.22*2.75±0.212.96±0.40苯丙氨酸 Phe2.71±0.143.46±0.19*1.66±0.151.81±0.19赖氨酸 Lys3.89±0.275.16±0.24*5.86±0.506.72±0.38组氨酸 His0.63±0.070.74±0.071.47±0.111.58±0.10精氨酸 Arg1.87±0.152.24±0.12*5.24±0.326.13±0.48脯氨酸 Pro3.08±0.293.68±0.19*3.36±0.193.73±0.26必需氨基酸 EAA19.20±1.1524.57±1.53*20.53±1.6723.38±1.91总氨基酸 TAA46.47±1.3357.59±1.66*58.33±1.8365.17±2.07*必需氨基酸/总氨基酸 EAA/TAA41.32±1.1642.65±1.1335.18±1.3235.71±1.35
2.2 小肽对大黄鱼仔鱼生长和小肠发育的影响
由图5可知,与对照组相比,投喂由4种不同浓度小肽营养强化的轮虫和卤虫均能促进大黄鱼仔鱼的生长,使其体长显著增加(P<0.05)。根据小肽浓度和大黄鱼仔鱼体长的二元回归分析,小肽最佳营养强化浓度为1.88 mL/m3(图5)。与对照组相比,4种不同浓度小肽组的小肠绒毛高度均显著增加(P<0.05),尤其是S1.0组;S1.0组和S3.0组的小肠绒毛数量显著增多(P<0.05);S1.0组和S2.0组的小肠组织面积显著增大(P<0.05)。然而,小肠单位面积内绒毛数量不受小肽浓度的显著影响(P>0.05)(表3)。
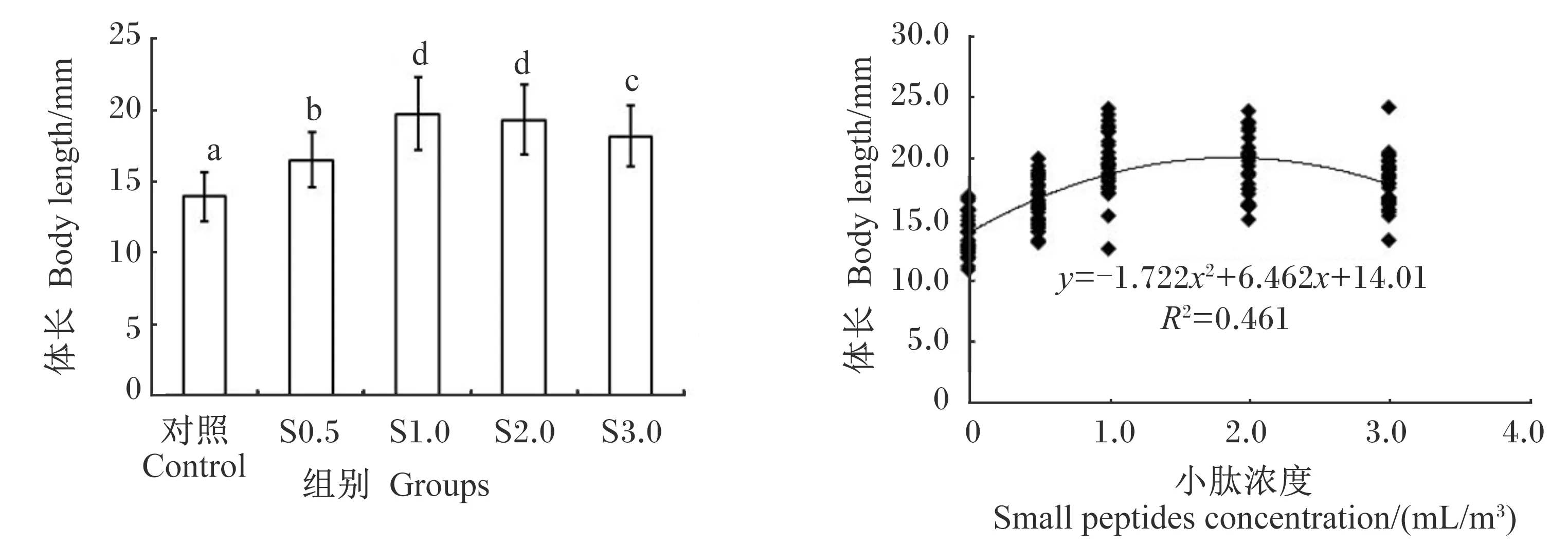
数据柱标注不同字母表示显著差异(P<0.05)。图6同。
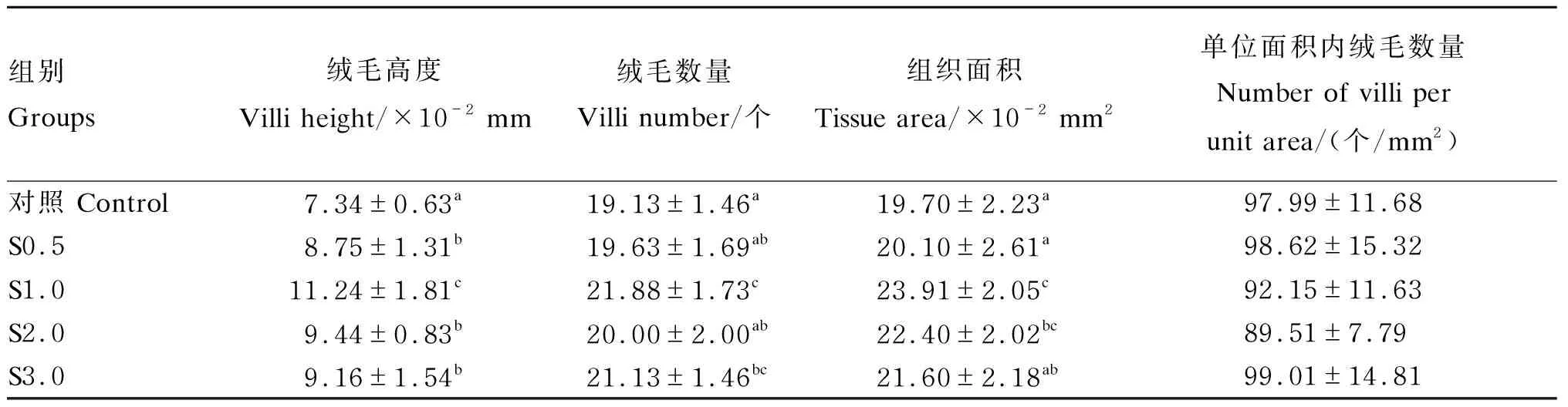
表5 小肽对大黄鱼仔鱼小肠绒毛形态的影响
2.3 小肽对大黄鱼仔鱼ROS和GSH含量的影响
由图6可知,与S0常温组相比,S1.0常温组和S3.0低温组的ROS含量显著降低(P<0.05),S0低温组、S0.5低温和S2.0低温组的ROS含量显著升高(P<0.05)。与S0常温组相比,除S0低温组的GSH含量显著降低(P<0.05)外,而小肽在常温和低温条件下均能显著增加大黄鱼仔鱼的GSH含量(P<0.05)。

图6 小肽对低温胁迫下大黄鱼仔鱼ROS(A)和GSH(B)含量的影响
2.4 小肽对大黄鱼仔鱼肝脏抗氧化相关基因表达水平的影响
由表6可知,与S0常温组相比,S1.0常温组的铜锌超氧化物歧化酶(copper-zinc superoxide dismutase,Cu/Zn-SOD)、锰超氧化物歧化酶(manganese superoxide dismutase,Mn-SOD)、CAT、谷胱甘肽过氧化物酶-1a(glutathione peroxidase-1a,GPx-1a)、谷胱甘肽过氧化物酶-1b(glutathione peroxidase-1b,GPx-1b)、GR和Nrf2基因表达水平均显著增加(P<0.05);S0低温组的Cu/Zn-SOD、CAT、GPx-1a、GR和Nrf2基因表达水平显著降低(P<0.05);S0.5低温组、S2.0低温组和S3.0低温组的Cu/Zn-SOD、Mn-SOD、CAT、GPx-1a、GPx-1b、GR和Nrf2基因表达水平均显著提高(P<0.05);S1.0低温组的Cu/Zn-SOD、Mn-SOD、CAT、GPx-1a、GR和Nrf2基因表达水平均显著提高(P<0.05)。
2.5 小肽对大黄鱼仔鱼肝脏非特异性免疫相关基因表达水平的影响
由表7可知,与S0常温组相比,S1.0常温组的c型溶菌酶(c-type lysozyme,c-typeLZM)、g型蛋白溶菌酶(g-type lysozyme,g-typeLZM)、AKP和NF-κB基因表达水平无显著变化(P>0.05);S0低温组的c-typeLZM、g-typeLZM、AKP和NF-κB基因表达水平显著降低(P<0.05);S1.0低温组、S2.0低温组和S3.0低温组的c-typeLZM、g-typeLZM、AKP和NF-κB基因表达水平显著提高(P<0.05);S0.5低温组的c-typeLZM、AKP和NF-κB基因表达水平显著增加(P<0.05)。

表6 小肽对低温胁迫下大黄鱼仔鱼肝脏抗氧化相关基因表达水平的影响

表7 小肽对低温胁迫下大黄鱼仔鱼肝脏非特异性免疫相关基因表达水平的影响
2.6 相关性分析
由表8可知,大黄鱼仔鱼ROS含量与Nrf2和NF-κB基因表达水平呈显著负相关(P<0.05);Nrf2基因表达水平与抗氧化酶(Cu-Zn-SOD、Mn-SOD、CAT、GPx-1a、GPx-1b、GR)基因表达水平呈显著正相关(P<0.05);NF-κB基因水平与非特异免疫酶(c-typeLZM、g-typeLZM、AKP)基因表达水平呈显著正相关(P<0.05)。
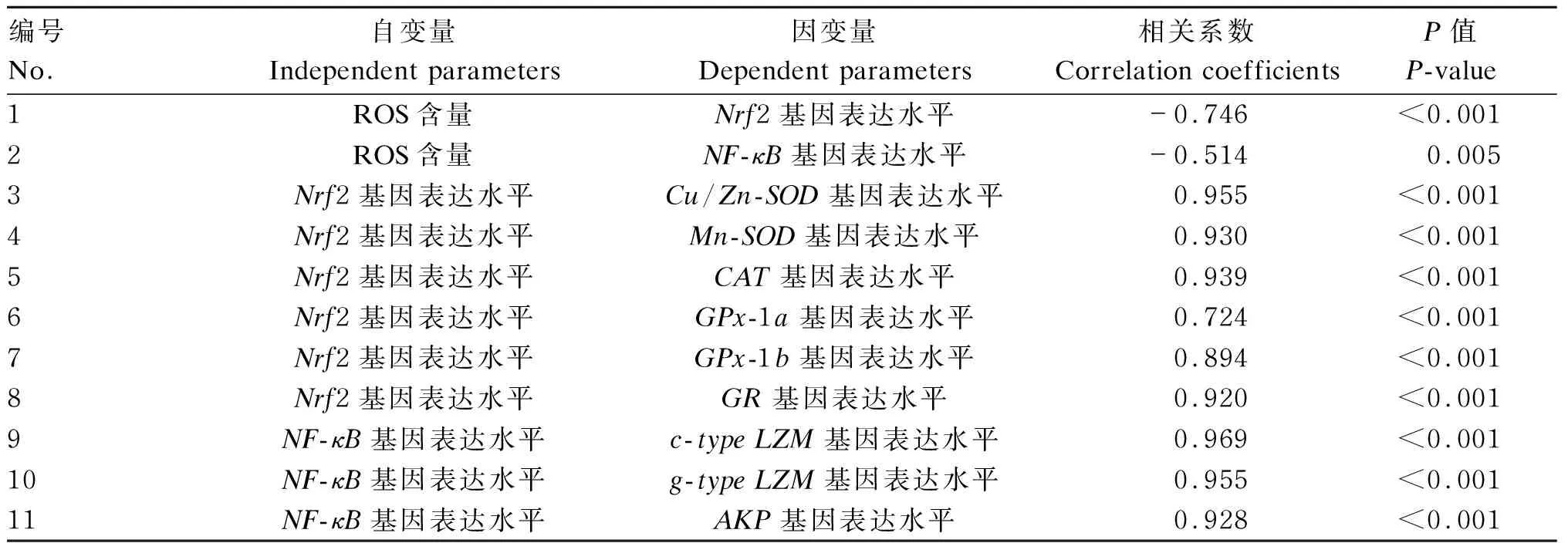
表8 大黄鱼仔鱼不同参数之间的相关性分析
3 讨 论
轮虫和卤虫是海水仔鱼育苗的主要活性饵料。然而,它们均存在营养缺陷,需要进行营养强化才适合充当开口饵料。粗蛋白质含量、氨基酸种类及其含量是重要的营养指标。在本研究中,尽管水体中小肽浓度为2.0 mL/m3时对轮虫和卤虫的粗蛋白质含量未产生显著影响,但能显著提高它们的EAA和TAA含量,表明小肽改善了轮虫和卤虫的营养价值。
抗氧化系统和免疫系统在保护机体免受环境胁迫所造成的损伤等方面发挥着积极作用[21]。当前,关于低温胁迫对鱼类影响的分子机理研究仅有少量报道。有研究表明,饲料中的小肽能够通过改善鱼类的抗氧化性能和非特异性免疫力来提高胁迫耐受性[15-16]。本试验研究了小肽营养强化轮虫和卤虫对大黄鱼仔鱼生长的影响以及对低温胁迫下大黄鱼仔鱼抗氧化性能和非特异性免疫力的影响,并试图阐明其分子机理。
与对照组相比,不同浓度小肽营养强化轮虫和卤虫均显著提高了大黄鱼仔鱼的体长、小肠绒毛高度和组织面积等生长发育指标,尤其是S1.0组,与李杰[22]的研究结果相似。小肽通过增加小肠绒毛高度、数量和组织面积来增加小肽载体数量,从而改善游离氨基酸和小肽的转运能力,进而提高鱼类机体内的蛋白质合成能力和沉淀量,最终促进鱼类的生长[23]。以大黄鱼仔鱼体长为参数,小肽最佳营养强化浓度为1.88 mL/m3。
当鱼类处于氧化应激生理状态时,机体内通常会产生大量ROS,因此ROS被认为是氧化应激标志物[24]。S0低温组的大黄鱼仔鱼ROS含量较S0常温组显著提高,表明低温对大黄鱼仔鱼产生了氧化损伤。与S0常温组相比,小肽能够显著降低大黄鱼仔鱼机体内的ROS含量,表明其抗氧化能力发生了改变,从而使机体内的氧化还原反应产生了新的平衡[5]。与S0低温组相比,小肽能够显著降低低温胁迫下大黄鱼仔鱼机体内的ROS产量,表明小肽能够缓解低温胁迫诱导的氧化损伤。非酶抗氧化剂GSH在抑制超氧化物产生、缓解氧化应激反应等方面发挥着重要作用[8]。与S0常温组相比,小肽增加了大黄鱼仔鱼机体内的GSH含量。这进一步解释了小肽能够提高大黄鱼仔鱼在低温胁迫下的抗氧化能力,从而降低ROS含量,缓解氧化损伤。

与S0常温组相比,低温胁迫(S0低温组)显著抑制大黄鱼仔鱼肝脏非特异性免疫酶(c-typeLZM、g-typeLZM和AKP)基因表达水平,从而降低了非特异性免疫力;而小肽提高了低温胁迫下大黄鱼仔鱼肝脏c-typeLZM、g-typeLZM和AKP基因表达水平,从而提高了非特异性免疫力,以此来应对低温胁迫诱导的损伤。值得注意的是,在常温条件下,大黄鱼仔鱼肝脏非特异性免疫相关基因表达水平不受小肽(S1.0常温组)的影响。有研究表明,功能性食品可改善能量代谢效率来改变鱼类宿主生理状态。一旦遭受胁迫时,鱼类即可通过改善免疫功能来保护机体免遭胁迫诱导的氧化损伤[30]。另外,当鱼类处于正常生理状态时,非特异性免疫相关基因的过量表达也会对宿主产生负面影响[31]。
基因表达水平受核转录因子的调控,核转录因子Nrf2和NF-κB分别在调控抗氧化反应和非特异性免疫反应过程中发挥重要作用[12,32]。本研究中,低温胁迫抑制了大黄鱼仔鱼肝脏Nrf2和NF-κB基因的表达,这与汞胁迫状态下大黄鱼的研究结果[30-32]相似。Nrf2基因表达水平与Cu/Zn-SOD、Mn-SOD、CAT、GPx-1a、GPx-1b、GR基因表达水平呈显著正相关,表明这些抗氧化酶基因表达受Nrf2调控。NF-κB基因表达水平与c-typeLZM、g-typeLZM和AKP基因表达水平呈显著正相关,表明这些非特异性免疫酶基因表达的激活依赖于NF-κB信号通路。ROS可充当抗氧化反应和非特异性免疫反应的第二信号分子。ROS可激活Nrf2和NF-κB基因表达,从而调控抗氧化酶基因和非特异性免疫酶基因的表达[33-34]。ROS含量与Nrf2和NF-κB基因表达水平呈显著负相关验证了这一观点。
4 结 论
① 小肽能够提高轮虫和卤虫的必需氨基酸和总氨基酸含量,从而促进大黄鱼仔鱼的生长和小肠发育,最佳营养强化浓度为1.88 mL/m3。
② 小肽通过诱导核转录基因Nrf2和NF-κB的表达来增加抗氧化酶基因和非特异性免疫酶基因表达水平,从而缓解低温胁迫诱导的氧化损伤。
致谢:
感谢台州大陈黄鱼有限公司陈国业工程师对大黄鱼仔鱼养殖所提供的宝贵意见和技术指导。
