超临界二氧化碳萃取黄榆籽油工艺及抗疲劳活性研究
2021-02-06马挺军
潘 迪 马挺军
(北京农学院食品科学与工程学院,北京 102206)
黄榆(Ulmusmacrocarpa)为榆科榆属落叶乔木或灌木植物,高达20 m,胸径30 cm,分布于我国东北及华北、西北部分省区,朝鲜、俄罗斯也有分布[1]。作为防护林工程的优良树种之一,黄榆可防风固沙、固土保水、城市绿化,不仅生态价值巨大,还具有较高的药用价值。研究表明黄榆提取物具有抗肿瘤、抗过敏[2]、抗氧化、抗皮肤衰老[3]、抗高脂血[4]、免疫[5]等药理功效。本实验室测得黄榆籽中,脂肪含量9.44 g/100 g,蛋白质23.5 g/100 g,总糖(以葡萄糖计)4 g/100 g,灰分3.65 g/100 g,水分及挥发物5.044 g/100 g。因此,黄榆籽油具有广阔的开发前景。
植物油的提取方法有压榨法[6],浸提法[7],超声波辅助法[8],水酶法[9]等,虽然都取得了一定效果,但压榨法出油率低、浸提法和超声辅助法存在溶剂残留、水酶法酶的选择性高等缺点。而超临界二氧化碳萃取法可以克服上述提取方法的不足,它是在超临界状态下使用二氧化碳作为溶剂,可以在较低的温度下进行萃取,不会对热敏性物质产生影响,更不会引起部分物质的氧化,具有绿色、无毒、无溶剂残留、萃取率高、操作简便等优点,但该方法仪器设备昂贵,且相关理论及技术要求较高,不适合大规模工业化生产,目前也仅用作小油种提取油脂的中试和小批量生产[10-12]。高妮娜等[13]比较了压榨法、溶剂浸提法、水酶法和超临界CO2萃取法对奇亚籽油品质特性的影响,结果发现超临界CO2萃取法的油脂得率最高(85.5%),其次是溶剂浸提法(65.8%)和压榨法(40.9%),水酶法最低(33.2%)。阿吉姑·阿布都热西提等[14]采用正交实验优化了萃取压力、温度、CO2流量和萃取时间对巴旦杏仁油超临界CO2萃取得率的影响,结果表明萃取压力35 MPa、萃取温度40 ℃、二氧化碳流量6 L/min、萃取时间4 h 为最优条件,在此条件下巴旦杏仁油萃取得率达到43.10%。Achicanoy等[15]采用超临界二氧化碳萃取番茄籽油,得到的最佳萃取条件为压力38.1 MPa,温度64 ℃,萃取率为21.07%。故本实验采用超临界二氧化碳萃取黄榆籽油。
剧烈运动会增加能量消耗,加速活性氧的积累,导致氧化应激和脂质过氧化而产生身体疲劳[16]。而补充具有抗氧化能力的物质,可以提高抗氧化酶活性,从而延长运动能力,减少身体疲劳[17]。有文献报道,油脂中的亚油酸、亚麻酸和油酸等不饱和脂肪酸,具有抗氧化、降血脂、增强免疫力等功效[18]。此外,植物油脂中的活性成分如植物甾醇、生育酚、黄酮类、多酚类等,也具有抗氧化、抗衰老活性[19]。黄榆籽油作为新型的植物油脂,也受到了关注,但目前国内对黄榆籽油体内抗疲劳、抗氧化作用的研究鲜见报道。本实验以黄榆籽为原料,采用超临界二氧化碳萃取黄榆籽油,在单因素的基础上采用正交试验,研究萃取压力、萃取温度、萃取时间对黄榆籽油萃取率的影响;然后对在此条件下萃取的黄榆籽油进行理化性质分析;并将其灌喂小鼠,通过小鼠负重游泳实验,分析小鼠体内抗疲劳、抗氧化活性,以期为黄榆籽油的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
黄榆籽采自吉林省国家级向海自然保护区蒙古黄榆树林(内蒙古科尔沁保护区黄榆林5,6月(该树一般两年结一次果,果熟5-6月);CO2纯度99.99%,食用级;色拉油 Aceties Monterreal S.A;香菇多糖片;鼠维持颗粒饲料 生产许可证号:SCXK(京)2019-0012;尿素氮测定试剂盒(BUN)、乳酸试剂盒(LA)、肝糖试剂盒(LG)、丙二醛试剂盒(MDA)、超氧化物歧化酶试剂盒(SOD)和谷胱甘肽过氧化物酶试剂盒(GSH-Px);氢氧化钠、甲醇、三氟化硼均为分析纯。
1.2 仪器与设备
PE AutoSystem XL-TurbeMass GC/MS联用仪,毛细管色谱柱为SE254型(30 m×0.25 mm×0.25 μm),超临界流体萃取系统,UV-1601PC型可见紫外分光光度计,雷杜Chemray360全自动生化分析仪,HD型单列恒温水浴锅,小鼠笼具规格300 mm×180 mm×130 mm,材质为PC聚碳酸酯。
1.3 动物
雄性ICR小鼠 60只,起始体重(17.9±1.0)g,6周龄,动物生产许可证号:SCXK(京)2019-0009。
实验小鼠被圈养在笼子里,每笼6只。在恒温(20~25 ℃)和湿度50%~70%下,每日12 h/12 h光/暗交替照明(早上8点到晚上8点光照),并且小鼠在SPF(特异性无病原体)动物饲养室内可自由食用标准饲料和无菌饮用水。
1.4 实验方法
1.4.1 黄榆籽油的超临界流体萃取
参考王玉玲等[20]的方法,取清理去杂后的黄榆籽,在干燥箱中于105 ℃烘烤2 h后粉碎,过60目筛子,备用。准确称取一定量的黄榆籽粉投入萃取釜中,调节系统的温度、压力至设定值,CO2流量为2.5 L/min,然后进行循环萃取。当达到设定时间后,从出料口收集产物并计算萃取率,每组实验重复3次,取平均。按下式计算黄榆籽油的萃取率。
萃取率=(萃取的黄榆籽油质量/黄榆籽粉质量)×100%
1.4.2 单因素实验
按照1.4.1的实验方法,以黄榆籽油萃取率为试验指标,分别考察萃取压力(10、20、30、40、50、60 MPa)、萃取温度(10、20、30、40、50、60 ℃)、萃取时间(30、60、90、120、150 min)对黄榆籽油萃取率的影响,采用控制变量法,确定各个因素的大致范围。
1.4.3 正交试验
在单因素试验的基础上,选取萃取压力(A)、萃取温度(B)、萃取时间(C)为考察因素,每个因素选取3个水平,萃取率为考察指标,采用L9(34)正交表进行试验。具体因素水平值见表1。

表1 正交试验因素水平表
1.4.4 黄榆籽油的理化性质分析
酸价按GB 5009.229—2016测定,过氧化值按GB 5009.227—2016测定,碘值按GB/T 5532—2008测定,皂化值按GB/T 5534—2008 测定,水分及挥发值含量按GB 5009.236—2016测定。
1.4.5 抗疲劳、抗氧化实验
1.4.5.1 动物分组及饲喂
适应性喂养1周后,根据体重将小鼠随机分为5组,每组12只:正常对照组(NC)、阳性对照组(PC)、低剂量组(LD)、中剂量组(MD)和高剂量(HD)。样品低、中、高剂量组每只小鼠每天分别灌胃黄榆籽油2.5、5、10 mL/kg(以体质量bw计,下同);正常对照组小鼠每只每天灌喂等量色拉油10 mL/kg;阳性对照组小鼠每只每天灌喂香菇多糖300 mg/kg。每日1次,连续28 d,灌胃期间自由取食和饮水。
不同剂量黄榆籽油的配制方法:高剂量直接应用黄榆籽油原油,中、低剂量组用色拉油稀释配制,用时搅拌器混匀。密封,4 ℃冰箱贮藏,备用;使用时充分摇匀,每次给药剩余药液废弃。
1.4.5.2 小鼠力竭游泳实验
参考马挺军等[21]的方法,小鼠负重游泳实验如下:末次给药1 h后,在小鼠尾部负小鼠体重5%的铅皮,投入水温为(27±0.5) ℃,水深40 cm的游泳箱中游泳,从放入小鼠开始计时,至小鼠沉于水面下10 s后不能浮出水面的时间作为力竭游泳时间,观察并记录小鼠的力竭游泳时间。
1.4.5.3 抗疲劳生化指标测定
参考Xia等[22]方法并进行修改,小鼠负重游泳1 h后,眼球采血,血凝固后2 000 r/min离心15 min,取血清冻存,用于测定血尿素氮(BUN)、血乳酸(LA)。之后立即处死小鼠,取其肝脏,经冰冻生理盐水漂洗后用滤纸吸干,用于测定丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和肝糖原(LG)含量。其中,BUN用全自动生化分析仪测定,其他指标均按照试剂盒进行操作。
1.5 数据分析
2 结果与讨论
2.1 单因素实验
2.1.1 萃取压力对黄榆籽油萃取率的影响
从图1可以看出,萃取压力在10~30 MPa范围内,随着萃取压力的增加,黄榆籽油的萃取率逐渐增大,达到30 MPa时萃取率达到最大值40.89%。这是因为萃取压力升高,CO2密度增大,从而对溶质溶解性能增加,有利于萃取[23]。当萃取压力超过30 MPa时,黄榆籽油的萃取率没有明显变化。在实际生产过程中,萃取压力过大会导致企业的经营成本和设备投资明显增加。综合考虑,选择萃取压力为30 MPa。

图1 萃取压力、萃取温度、萃取时间对黄榆籽油萃取率的影响
2.1.2 萃取温度对黄榆籽油萃取率的影响
由图1可知,随着萃取温度的升高,黄榆籽油的萃取率先增大后减小。当萃取温度为40 ℃时,萃取率达到最大值。这可能是因为萃取温度的升高,蒸汽压增大,使分子间热运动加剧,提高了黄榆籽油在CO2中的溶解度进而萃取速率提高;但是温度升高还会导致CO2流体的密度降低,从而降低了黄榆籽油溶解度[24]。因此,确定了最佳萃取温度为40 ℃。
2.1.3 萃取时间对黄榆籽油萃取率的影响
如图1所示,随着萃取时间延长,黄榆籽油萃取率逐渐增大。这是因为萃取刚开始时,超临界二氧化碳流体与黄榆籽接触的较少,萃取率低,随着时间延长,两者充分接触导致萃取率增大。当萃取时间超过120 min后,黄榆籽油的萃取率趋于平缓。这是由于黄榆籽油大部分被萃取出来,萃取时间继续延长会导致能耗增大。所以选择萃取时间为120 min。
2.2 正交实验
从表2可以看出,各因素对黄榆籽油萃取率的影响顺序为:萃取压力>萃取时间>萃取温度(A>C>B)。根据表3的方差分析结果,萃取压力(A)对超临界二氧化碳萃取黄榆籽油的萃取率有显著影响,萃取温度(B)和萃取时间(C)对黄榆籽油萃取率影响不显著。综合分析正交实验结果,确定最佳工艺条件为A2B3C2,即萃取压力为30 MPa,萃取温度为50 ℃,萃取时间为120 min,通过实验验证,该条件下的萃取率为45.26%。

表2 L9(34) 正交实验结果

表3 方差分析表
2.3 黄榆籽油的理化性质
GB 2716—2018规定:食用植物油的酸价(KOH)≤3 mg/g,过氧化值≤0.25 g/100 g。由表4可知,超临界二氧化碳萃取的黄榆籽油的酸价为3 mg/g,过氧化值0.052 g/100 g,符合食用植物油标准。

表4 黄榆籽油品质分析
2.4 黄榆籽油抗疲劳、抗氧化实验
2.4.1 黄榆籽油对小鼠力竭游泳时间的影响
力竭游泳时间是小鼠运动能力的体现,也是抗疲劳试验指标之一。近年来,药用植物多糖被认为是一种新型的天然抗疲劳剂,故选择香菇多糖作为阳性对照组。由图2可知,与NC组相比,各组小鼠力竭游泳时间均延长。LD、MD组均延长不显著;HD、PC组均延长极显著(P<0.01),分别延长了4.67倍、20.37倍。以上结果表明,香菇多糖和黄榆籽油均可延长小鼠的力竭游泳时间,在不同剂量组黄榆籽油中高剂量组效果最好。

注:NC-空白,PC-香菇多糖组。*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。下同。图2 黄榆籽油对小鼠力竭游泳时间的影响
2.4.2 黄榆籽油对小鼠BUN、LA、LG含量的影响
血尿素氮BUN是蛋白质和氨基酸的代谢产物,当身体不能从碳水化合物和脂肪中获得能量时,蛋白质和氨基酸就成为分解代谢的替代来源,以满足能量需求,因此BUN含量升高导致机体产生疲劳[25]。此外,长时间的运动还会增加肌肉的耗氧量,进而导致缺氧,加速糖酵解,产生大量的酸性物质,如乳酸和丙酮;而乳酸的积累会使肌肉和血液的pH降低,直接或间接导致肌肉运动能力下降,造成运动性疲劳[26,27]。由图3可知,与NC组相比,各组的BUN、LA含量均有所降低,HD组小鼠的BUN、LA含量显著降低(P<0.05),分别降低了17.11%、24.37%;PC组小鼠的LA含量显著下降了27.97%(P<0.05),而其他各组小鼠的BUN、LA含量无显著性差异。结果说明,黄榆籽油在高剂量下能有效抑制血尿素氮和乳酸的产生,延缓疲劳的发生,与香菇多糖效果相一致。
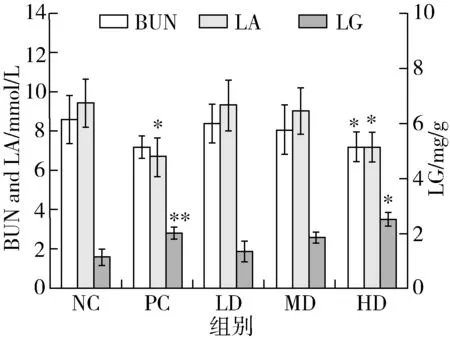
图3 黄榆籽油对小鼠BUN、LA、LG含量的影响
肝糖原是运动过程中重要的能量来源,它可以被分解转化成葡萄糖,为机体运动提供更多的能量,从而延缓运动疲劳的产生[28]。由图3可见,与NC组相比,各剂量组小鼠的LG含量均有所升高,其中,PC组小鼠的LG含量极显著升高(P<0.01),而黄榆籽油剂量组中随着剂量的增加,小鼠的LG含量逐渐升高,在HD组时达到显著水平(P<0.05),并且比PC组提高了24.04%。这说明黄榆籽油可提高小鼠体内肝糖原的含量,且高剂量组黄榆籽油的作用效果优于香菇多糖。
2.4.3 黄榆籽油对小鼠MDA、SOD、GSH-Px含量的影响
MDA是脂质过氧化的产物,MDA含量降低,可以减轻氧化应激,改善运动性疲劳[29]。SOD和GSH-Px是生物体内重要的抗氧化酶,可清除积累的氧自由基,维持体内平衡,减弱活性氧的作用,从而保护细胞结构不受破坏,防止疲劳的发生[30]。由表5知,与NC组相比,各剂量组MDA含量均有所降低,PC组显著降低(P<0.05),LD、MD组降低不显著,HD组极显著降低(P<0.01);与NC组相比,各剂量组SOD和GSH-Px活力均有所升高,其中,SOD活力在HD组升高极显著(P<0.01),而在其余各组均无显著性差异;GSH-Px活力在MD、HD组均显著提高(P<0.05),在PC组极显著提高(P<0.01)。这表明,黄榆籽油可以提高小鼠体内抗氧化酶活性,防止过度运动引起的氧化应激,降低氧化损伤。随着黄榆籽油剂量的增加,其作用效果越显著,甚至优于香菇多糖。
表5 黄榆籽油对小鼠MDA、SOD、GSH-Px含量的影响
3 结论
通过单因素和正交实验设计,超临界二氧化碳萃取黄榆籽油的最佳工艺为萃取压力30 MPa、萃取温度50 ℃、萃取时间120 min,在此条件下黄榆籽油油萃取率为45.26%。
对萃取的黄榆籽油进行理化实验分析,酸价为3 mgKOH/g、过氧化值为0.052 g/100 g、碘值为7.8 gI/100 g、皂化值为300 mg/g、水分及挥发物含量为3.51 g/100 g。本试验测得的油脂的各项指标均在食用油标准范围之内,所以黄榆籽可以作为开发食用油的新食品原料。
与对照组相比,黄榆籽油高剂量组可显著延长小鼠游泳时间(P<0.05),降低BUN、LA含量(P<0.05),并提高LG含量(P<0.05);同时,显著提高SOD、GSH-Px活力(P<0.05或P<0.01),降低MDA水平(P<0.01)。表明黄榆籽油具有良好的抗疲劳、抗氧化活性,且其活性与黄榆籽油剂量呈正相关,达到高剂量组时活性最强。
