高敏肌钙蛋白T对慢性肾衰竭非透析患者急性心肌梗死的诊断价值
2021-02-06李欣悦刘素芬
李欣悦,耿 巍,刘素芬,田 祥*
(1.河北省保定市第一中心医院心血管内科,河北 保定 071000;2.河北省保定市第一中心医院眼科,河北 保定 071000)
慢性肾脏病(chronic kidney disease,CKD)是各种肾脏疾病的总称,其发病率逐年升高。当CKD进展至晚期及终末期,即CKD4-5期,肾小球滤过率(glomerular filtration rate,eGFR)下降到失代偿阶段导致肾脏结构及功能严重受损,称为慢性肾衰竭(chronic renal failure,CRF)。由CKD早期进展至CRF的过程复杂的血流动力学、神经-体液机制的激活及炎症因子介导等多种途径的汇合,这些途径彼此之间相互作用,进一步加速肾功能恶化并累及其他脏器[1],其中以心血管系统的损伤最为常见[2-3]。心血管疾病(cardiovascular disease,CVD)已经取代感染成为威胁CRF患者生命的首要原因,考虑到心血管事件的高并发率,准确而敏感的生物学标志物对于CRF患者CVD的诊断和危险分层至关重要。高敏肌钙蛋白T(high-sensitive cardiac troponin T,hs-cTnT)与CRF患者缺血性心脏损害与包括不良心血管事件在内的全因死亡率密切相关。然而,即使在缺乏临床可疑的心肌缺血的情况下,hs-cTnT水平往往也会持续升高[4]。最新版急性心肌梗死(acute myocardial infarction,AMI)的诊断标准强调心肌肌钙蛋白水平升高(至少超过99%参考值上限)伴随动态变化这一最关键的因素[5]。所以对于CRF患者AMI的诊断,如何消除hs-cTnT水平普遍升高的干扰,并为其制定准确而独立的临床诊断标准,是临床目前需要解决的难题。
1 资料与方法
1.1一般资料 选取2018年12月—2019年12月在河北省保定市第一中心医院就诊的患者中符合CKD4期非透析合并AMI患者52例(A组),选取单纯CKD4期非透析患者52例(B组)。鉴于CKD5期患者已经步入终末期肾病(end stage renal disease,ESRD)阶段,这些患者几乎全部需要终生接受肾脏替代治疗,包括血液透析、腹膜透析及肾脏移植,对血清hs-cTnT水平的波动造成一定程度的影响。所以本研究不纳入CKD5期的患者。2组患者性别、年龄、体重指数(body mass index,BMI)、收缩压、舒张压、心血管疾病危险因素(吸烟史、高血压病、糖尿病、血脂异常、家族史)、心脏病史(冠心病、陈旧性心肌梗死、血运重建史)等,差异均无统计学意义(P>0.05),具有可比性;2组间心电图ST-T段表现差异有统计学意义(P<0.01),见表1。
本研究经过医院伦理委员会批准,所有入组患者均签署知情同意书。
1.2纳入标准
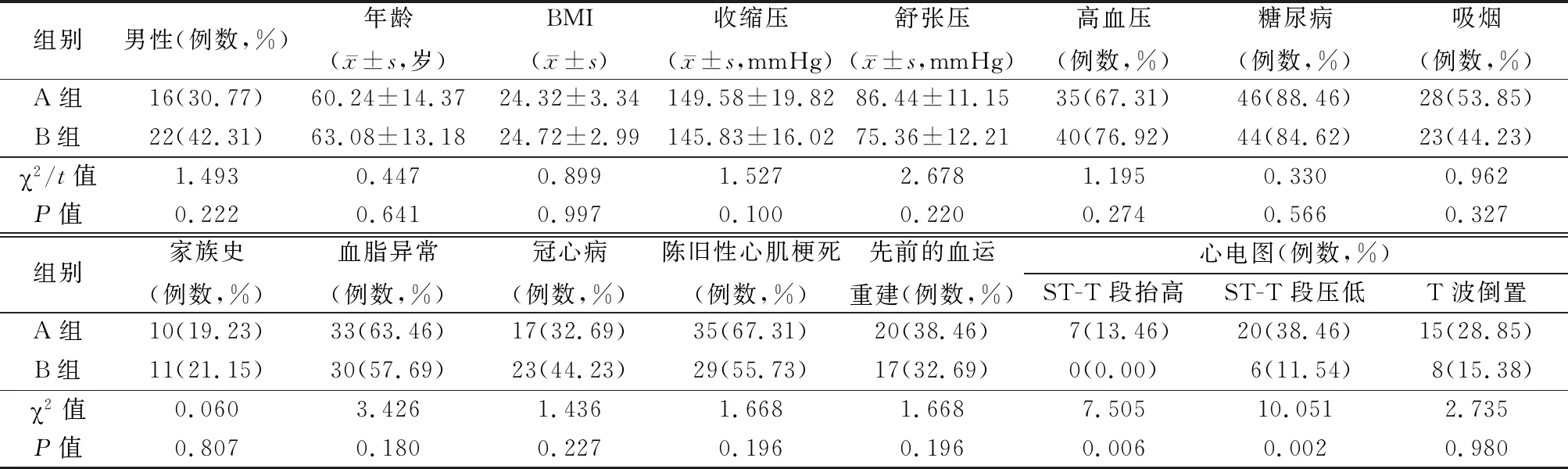
表1 2组基线资料比较Table 1 Comparison of baseline data between two groups (n=52)
1.2.1符合AMI诊断标准 根据2018年最新《第4版心肌梗死通用定义》[6],简而言之,在心肌缺血的临床环境中存在心肌损伤的证据, 即可诊断为AMI。心肌损伤的诊断标准是肌钙蛋白值存在升高和或下降过程,至少有一项心肌肌钙蛋白(普通或高敏)升高超过正常值上限第99百分位数。
1.2.2符合CKD4期诊断标准 根据K/DOQI分期标准,即肾小球滤过率15~29 mL·min-1·1.73 m-2。
1.2.3诊断结果 由我院两名经验丰富的心内科专家综合其临床病史、体格检查、实验室检验结果(包括hs-cTnT水平)、心电图、超声心动图以及冠状动脉造影(当存在冠状动脉急性闭塞,TIMI 0~Ⅱ级血流或新的室壁运动异常)等指标共同判定。
1.3排除标准 ①已经接受肾脏替代治疗;②近1个月内发生AMI;③先天性心脏病;④心脏瓣膜置换术后;⑤肺栓塞;⑥全身感染性疾病;⑦严重肝脏、胰腺疾病或恶性肿瘤;⑧急性肾损伤;⑨心肌炎或心包炎;⑩急性脑卒中(缺血性和出血性)的患者。
1.4方法 收集所有患者的基线资料,包括性别、年龄、BMI、收缩压、舒张压、心血管疾病危险因素(吸烟史、高血压病、糖尿病、血脂异常、家族史)、心脏方面病史(冠心病、陈旧性心肌梗死、血运重建史)等;收集AMI患者发病时临床症状及心电图表现;入院时抽取肘静脉血检测血肌酐(serum creatinine,SCr)及hs-cTnT水平,采用简化的MDRD公式计算eGFR,eGFR[ mL·min-1·1.73 m-2]=186.3×[SCr(mg/dL)]-1.154×[年龄(岁)]-0.203.若为女性则再乘以系数0.742。计算CKD分期;行超声心动图检测左心房内径(left atriumdimension,LAD)、左心室舒张末期内径(left ventricular enddiastolic dimension,LVEDD)、左心室收缩末期内径(left ventricular endsystolic dimension,LVESD)及左心室射血分数(left ventricularejection fraction,LVEF)。
1.5统计学方法 应用SPSS25.0统计软件处理数据,计量资料采用独立样本t检验和秩和检验;计数资料采用χ2检验。相关性采用 Pearson双变量线性相关检验,多因素分析采用多元线性回归。P<0.05为差异有统计学意义。
2 结 果
2.12组血清hs-cTnT化验指标比较 2组患者间血清hs-cTnT水平经过SK正态性检验呈非正态分布,经两个独立样本秩和检验显示,血清hs-cTnT水平A组[76.50(14.91)]与B组[54.00(21.75)]之间差异有统计学意义(Z=-5.617,P<0.001)。
2.2血清hs-cTnT水平与各指标间的相关性 LAD、LVESD、LVEDD与 hs-cTnT成正相关;LVEF及eGFR与hs-cTnT均成负相关,见表2。经单因素分析筛选,以上五个因素均为导致血清hs-cTnT水平变化的可疑影响因素,继续进行后续的多因素研究,即多元线性回归分析。
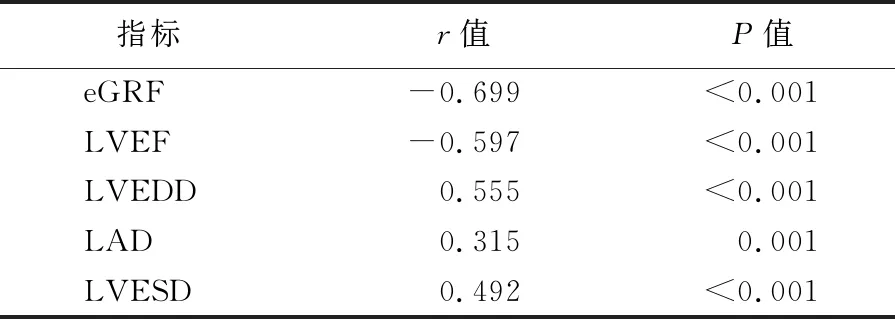
表2 血清hs-cTnT与各指标间相关性Table 2 Correlation between serum hs-cTnT and other indexes
2.3血清hs-cTnT水平的独立影响因素 多元线性回归分析显示 LVEDD、LVEF及eGFR是血清hs-cTnT水平的独立影响因素,见表3。

表3 血清hs-cTnT的多元线性回归Table 3 Multiple linear regression of serum hs-cTnT
2.4评估血清 hs-cTnT对CRF非透析患者AMI的临界值 以A组为试验组,B组为对照组,分析ROC曲线下面积为0.836,95%可信区间为(0.725~0.916),根据敏感度和特异度之和最大的方法确定诊断临界值为72.50 ng/L,当临界值为72.50 ng/L时,计算血清hs-cTnT对CRF非透析患者AMI患者诊断价值是敏感度为75.00%,特异度为90.38%,见图1。
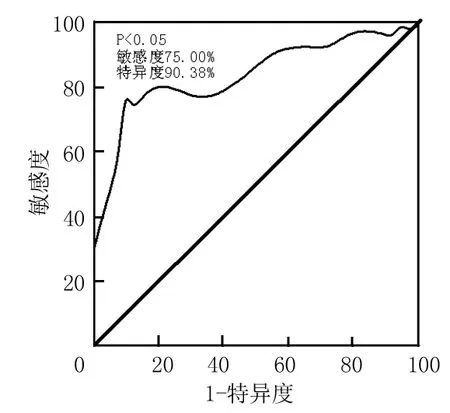
图1 血清hs-cTnT诊断CRF非透析患者AMI的ROC曲线Figure 1 Receiver-operating characteristic curve for diagnosis of AMI in CRF patients without dialysis
3 讨 论
鉴于CRF患者基线hs-cTnT水平往往是参考范围的第99百分位数的几倍之高,在考虑AMI这一诊断时,适当地提高诊断的截点值,是关键的第一步[7]。hs-cTnT基线升高的常见原因可以解释为心肌损伤和肾脏清除功能降低[6-8]。CRF与心肌损伤的共线性潜在机制可称作肾脏特异性心脏损伤,CRF患者长期并存的血管顺应降低、慢性贫血、氧化应激反应等因素导致心脏容量、压力负荷长期超载和心脏工作量的不断增加,肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldoster-one system,RAAS)的慢性激活损伤线粒体并减少心肌细胞的能量供应,尿毒症毒素的蓄积加速心肌细胞纤维化、重塑及凋亡,进一步破坏心脏的结构及功能[9]。受损的心肌细胞释放hs-cTnT进入血液循环,所以hs-cTnT常被认为与心脏重构、左心室肥厚(left ventricularhypertrophy,LVH)及左心室功能障碍相关,这一结论与我们研究中的LAD、LVEDD、LVESD及LVEF与hs-cTnT成显著相关性相一致。多元线性回归分析表明,LVEDD、LVEF及eGFR是hs-cTnT的独立影响因素,提示血清中hs-cTnT水平的持续升高,与心血管事件预后不良和全因死亡率的增加密切相关。CKD进入2期以来,伴随的肾性高血压和钙化性瓣膜病变等因素持续加重心脏压力负荷,导致LVH,随着CKD病程进展至CRF,这种改变尤为普遍[10]。除此之外,成纤维细胞生长因子23通过对心肌细胞的生长及分化进行调控来增加左心室的质量,肾脏滤过功能的下降导致血清磷酸盐在体内大量积累并促进FGF-23的分泌,从而加速LVH的进展。另外,对血清hs-cTnT水平升高的心力衰竭患者的研究在指出,通过测量从主动脉到冠状窦的hs-cTnT的浓度梯度,CKD患者相比其他患者主动脉肌钙蛋白浓度较高,提示心肌钙蛋白由肾脏排泄。故CKD4阶段,肾小球滤过功能的严重失代偿可加速血浆hs-cTnT的蓄积。当hs-cTnT临界值为72.50 ng/L,以提高诊断CRF非透析患者AMI的敏感度和特异度。
本研究同样证实了之前的研究结果,CRF患者的诊断难题与心电图ST-T段普遍非抬高有关,而ST段压低或T波倒置更为常见,甚至有些患者并无明显ST-T段改变。大量研究表明,一部分CRF合并AMI的患者,并未存在冠状动脉血管主支狭窄,推测可能与微小的心肌梗死、心内膜血管灌注不足以及LVH导致冠状动脉血流储备降低相关[11-13]。这部分患者往往发生静息痛,且无明显诱因及昼夜节律性[14]。
Gobeaux等[15]通过一项多中心、前瞻性的研究,对367例胸痛患者(其中75例为CKD患者)血清hs-cTnT对AMI的诊断性能进行评估,CKD组与肾功能正常组相比,hs-cTnT诊断AMI需要更高的临界值(35.8 ng/L,敏感度为94%,特异度为86%),相比于以健康人群99%参考值上限为截点值(14.0 ng/L,敏感度为100%,特异度为54%),其诊断的特异性明显提高,本研究结果与之相似,其诊断截点的差异可能是由于选择的CKD患者病情阶段不同所致,Gobeaux所纳入肾功能不全患者为CKD3-5期人群。Koppen等[16]测量了125例CKD患者hs-cTnT在胸痛症状发生后1、2 h的绝对数值和相对数值(百分比),显示hs-cTnT的绝对数值变化更能准确地诊断AMI。所以,密切注意血清hs-cTnT水平的变化情况,对于CRF患者AMI的诊断同样具有重要价值。如果hs-cTnT升高的水平保持恒定,即使升高的幅度显著,也提示反映慢性心肌的损伤。然而,如果出现hs-cTnT水平的动态变化,提示急性心肌损伤的可能性很大,此时应严密监测患者有无缺血症状、新发缺血性ECG改变或影像学检查显示存活心肌丢失等,存在一项心肌缺血的证据即可诊断AMI。特别需要注意的是,当CRF患者胸痛症状发作,心电图存在ST-T段改变,即使在短时间内没有出现hs-cTnT水平的升高或下降,尤其是其基线值升高的情况下,不应排除AMI的诊断,因为此种情况临床证据很强。
Rhee等[17]对美国274家医院收治的近50 000例AMI患者的数据进行分析后指出,由于CKD患者这一特殊人群接受临床试验及循证疗法的局限性,导致中重度CKD患者AMI的发病率及预后情况尚未得到充分的研究。在纳入的AMI患者中,ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)的CKD患者占30.5%,非ST段抬高型心肌梗死(non-ST-segment elevation myocardial infarction,NSTEMI)的CKD患者占42.9%,这些患者主要以CKD4-5期,即CRF居多。调整基线因素后,CKD患者的院内死亡风险是非CKD 患者的7.7倍。和预期结果一致,对于CKD患者而言,STEMI(13.4%)较NSTEMI(1.8%)患者院内死亡风险增加。而CRF患者一旦合并AMI,无论是哪种类型,其病死率、病残率均会显著升高,由于存在极大的出血风险以及心血管药物相关不良事件的高发生率,其接受的抗凝、抗血小板以及再灌注心肌治疗非常有限,进一步加重了CRF患者的不良预后。其次,CRF患者AMI的临床表现大多缺乏临床特异性,本研究纳入的52例CRF合并AMI患者,仅38.46%的患者具有胸闷、胸痛等心前区不适症状,更多的患者表现为呼吸困难,甚至部分患者起病隐匿,并无明显不适,在一定程度上延误了AMI的诊断与治疗。不当的饮食、药物、感染等因素可诱发AMI,可能与细胞外液的过量超载及左心室充盈压的急剧升高进一步加重心功能恶化,而CRF患者几乎已经丧失对血液动力学变化的调节机制有关[18]。
在临床工作中应加强对该疾病的认识,对于CRF非透析患者,严密监测临床症状、体征及心电图表现,定期监测血清 hs-cTnT水平变化以及加强液体管理,对于早期筛查AMI高风险人群以及尽快采取干预措施十分重要。此外,针对特定的临床环境和特殊的患病人群,及时调整诊断界值,是生物学标记物临床应用的关键步骤。为了确保hs-cTnT发挥最大的诊断性能,CRF患者AMI诊断的临界水平需要适当上调。
本研究局限性:首先,本研究样本量有限,且为单中心研究,需要大样本多中心前瞻性研究进一步证实;其次,鉴于这些结果是横断面研究,我们可能无法就其方向或因果关系得出明确的推论。
