μ阿片受体基因多态性对腰椎手术患者痛觉敏感性的影响
2021-02-05杨惠鸿喇宏玲阿里木江司马义徐桂萍
杨惠鸿,喇宏玲,陈 楠,阿里木江·司马义,徐桂萍
术后疼痛是组织损伤所引起的急性创伤性疼痛,尽管疼痛治疗取得了明显进步,但仍有患者在术后遭受中至重度的疼痛,有效的术后疼痛管理仍是临床医师面临的一个挑战[1]。术后疼痛会增加围术期风险,危害患者心理、生理健康,降低患者满意度[2]。临床上观察到疼痛存在个体差异,接受相同手术治疗的患者术后发生疼痛的程度不同。影响疼痛的因素较多。有研究[3]表明术前痛觉敏感性与术后疼痛存在联系,疼痛敏感性阈值越高,术后疼痛的程度降低,使用的镇痛药物的消耗量减少。而痛觉敏感性与基因的单核苷酸多态性有关[4~6]。μ阿片受体OPRM1基因多态性是人类常见的突变位点,其可影响阿片类药物的镇痛效果[7]。μ阿片受体基因多态性与实验性痛觉敏感性之间的联系是否遗传变异对个体疼痛差异的影响值得我们深入研究。结合主观疼痛测量结果和客观基因多态性的数据,是实现个体化疼痛治疗的关键方法[8]。本研究旨在探索μ阿片受体基因多态性与腰椎手术患者电刺激痛阈、耐痛阈的关系,为遗传学指导个体化用药提供理论依据,现报告如下。
1 对象与方法
1.1研究对象 选择2018-08~2019-12新疆维吾尔自治区人民医院全麻下行腰椎手术的患者218例。根据OPRM1 A118G基因型将患者分为三组:野生型纯合子组(AA组,85例)、突变型纯合子组(AG组,104例)和突变型杂合子组(GG组,29例)。三组年龄、性别、体质量指数(Body Mass Index,BMI)和美国麻醉师协会(American Society of Anesthesiologists,ASA)分级、病因等情况比较差异无统计学意义,具有可比性。见表1。纳入标准:(1)年龄30~65岁;(2)ASA分级为Ⅰ~Ⅱ级;(3)BMI为18~28 kg/m2;(4)同意使用舒芬太尼行术后镇痛治疗;(5)能进行有效沟通并有完全认知能力。排除标准:(1)既往有麻醉药物过敏史、慢性疼痛及长期服用镇痛药物史;(2)有重要器官合并症的患者;(3)既往有周围神经病变史;(4)术前1周使用阿片类药物的患者。本研究已获新疆维吾尔自治区人民医院伦理委员会批准,并与患者签署知情同意书。

表1 三组一般情况比较
1.2研究方法
1.2.1 OPRM1 A118G基因多态性检测与分组 麻醉诱导前采集静脉血2 ml,加入枸橼酸钠抗凝管中,颠倒混合后于-80 ℃保存备用。用柱式小量血液基因组DNA提取试剂盒(上海天昊生物科技有限公司)提取人全血DNA。采用聚合酶链反应-限制性片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)技术进行OPRM1 A118G基因多态性位点的检测。根据OPRM1 A118G基因型将研究对象分为野生型纯合子组(AA组)、突变型纯合子组(AG组)和突变型杂合子组(GG)。
1.2.2 痛阈、耐痛阈的检测 患者入室后安静平卧,采用MEB-5100型电刺激仪(光电公司,日本)进行痛阈、耐痛阈的检测。用75%酒精消毒受检部位皮肤,将两电极固定在右侧上臂三角肌部位,两电极大小均为5 mm×5 mm,电极间距离1.5 cm,刺激频率50 Hz,波宽0.5 ms,刺激数定为64次,220 V电压进行刺激。电流强度从0 mA开始,每次递增0.2 mA,逐渐调大输出电流强度并询问和观察患者反应。实验前事先告知患者当有轻微刺痛和不能忍受疼痛时立刻报告,记录患者有轻微刺痛和不能忍受疼痛时刻的电流大小(mA)作为痛阈和耐痛阈。重复测定3次取其平均值。
1.2.3 舒芬太尼术后镇痛 术前禁饮禁食,入室后常规监测血压(blood pressure,BP)、心率(heart rate,HR)、心电图(electrocardiogram,ECG)、血氧饱和度(pulse oxygen saturation,SpO2)和脑电双频指数(Bispectral Index,BIS),建立外周静脉通路。麻醉诱导:依次静脉注射咪达唑仑(江苏恩华)0.04 mg/kg、舒芬太尼(宜昌人福药业)0.4 μg/kg、丙泊酚中/长链脂肪乳(北京费森尤斯卡比医药)2 mg/kg和顺式阿曲库铵(上海恒瑞)0.3 mg/kg,快速诱导气管插管,设置呼吸机参数:潮气量为6~8 ml/kg,通气频率为12次/min,I∶E为1∶1.5,维持呼气末二氧化碳分压在35~45 mmHg。麻醉维持:静脉泵注丙泊酚中/长链脂肪乳4~12 mg/(kg·h)和瑞芬太尼(宜昌人福药业)0.3 μg/(kg·min),间断静脉推注顺式阿曲库铵0.15 mg/kg维持肌松。术中BIS值维持在40~60。手术结束前予静脉注射托烷司琼5 mg,术毕待患者意识和自主呼吸恢复后拔除气管导管,予经静脉患者自控镇痛(patient controlled intravenous analgesia,PCIA)。PCIA配方:舒芬太尼2 μg/kg,用生理盐水稀释至100 ml,负荷量2 ml,背景剂量2 ml/h,患者自控镇痛(patient controlled analgesia,PCA)剂量0.5 ml,锁定时间15 min。维持静息时视觉模拟量表(Visual Analogue Scale,VAS)评分≤3分,当VAS评分>3分,给予曲马多(德国赫素)100 mg进行补救镇痛。
1.3观察指标 (1)数字评分量表(Numerical Rating Scale,NRS)评分[9]:记录术后6 h、24 h、48 h时静息时和活动时NRS评分,根据疼痛程度用0到10的数字描述其疼痛程度。其中“0”表示“无疼痛”,“10”表示“无法忍受的疼痛”。静息时NRS评分表示安静卧床和休息时的评分;活动时NRS评分表示深吸气、咳嗽和翻身等时的评分。(2)术后镇痛满意度:由患者和家属对镇痛效果、不良反应和性价比作综合评定:1=非常满意;2=满意;3=一般;4=不满意。满意率=(非常满意例数+满意例数)/总例数×100%。

2 结果
2.1三组术前痛阈、耐痛阈比较 AA组痛阈、耐痛阈高于AG组和GG组,差异有统计学意义(P<0.05);但AG组与GG组痛阈、耐痛阈比较差异无统计学意义(P>0.05)。见表2。
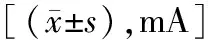
表2 三组术前痛阈、耐痛阈比较
2.2三组同基因型不同性别痛阈、耐痛阈比较 同基因型男性患者的痛阈和耐痛阈均显著高于女性患者(P<0.05)。见表3。
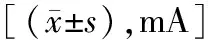
表3 三组同基因型不同性别痛阈、耐痛阈比较
2.3三组同基因型不同年龄层痛阈、耐痛阈比较 GG基因型中≥50岁患者的痛阈、耐痛阈低于30~39岁和40~49岁患者(P<0.05)。AA基因型和AG基因型患者的痛阈、耐痛阈与年龄无显著关联(P>0.05)。见表4。
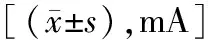
表4 三组同基因型不同年龄层痛阈、耐痛阈比较
2.4三组术后静息时和活动时NRS评分比较 在术后6~48 h,三组静息时和活动时NRS评分均呈下降趋势。对于静息时NRS评分,三组下降趋势变化差异无统计学意义(P>0.05),三组静息时NRS评分在各时点比较差异均无统计学意义(P>0.05)。对于活动时NRS评分,三组下降趋势变化差异有统计学意义(P<0.05)。在术后6 h、24 h、48 h,GG组活动时NRS评分均显著高于AA组和AG组(P<0.05),但AA组与AG组比较差异无统计学意义(P>0.05)。见表5。

表5 三组术后静息时和活动时NRS评分比较分]
2.5三组术后镇痛满意度比较 AA组和AG组术后镇痛整体满意度显著高于GG组(P<0.05)。见表6。

表6 三组术后镇痛满意度比较(n)
3 讨论
3.1μ阿片受体OPRM1 A118G基因多态性在人群中相对普遍。有研究[10]表明,μ阿片受体OPRM1基因多态性对疼痛感觉有调节作用,不仅可以调节生理疼痛,还对心理疼痛具有调节作用。OPRM1基因多态性对痛觉敏感性的影响可能与b-内啡肽有关,而b-内啡肽的结合亲和力受OPRM1 A118G基因的调控[11]。疼痛是一种复杂的不愉快情感体验,不同程度的疼痛会对不同个体造成不同的感觉体验,所以疼痛测量十分困难。尽管实验疼痛不能完全替代临床疼痛,但对于临床研究亦有其研究价值。本研究选择在入手术室后进行痛阈和耐痛阈值的测量,这可有效降低因患者心理紧张而造成的结果差异。机体对疼痛刺激的反应能力称为疼痛敏感性。有研究[12]显示,患者疼痛敏感性与腰椎手术后疼痛程度存在关联性。鉴此认为通过基因型分析与术前疼痛敏感性关系的评估可以预测患者术后疼痛的程度,完善术后镇痛,提高患者对围术期镇痛的满意度。
3.2本研究发现,OPRM1 A118G基因的AG型和GG型患者的痛阈和耐痛阈均显著低于AA型,这与Matic等[13]的研究结果相似,携带OPRM1 A118G等位基因G的患者对疼痛刺激的敏感性更高,对疼痛的耐受能力降低。术前疼痛敏感性的评估可预测患者术后的镇痛需求,术前痛阈值较低的患者更应该接受围术期镇痛[14]。携带突变纯合子的患者对疼痛刺激的感觉更强烈,所以更容易遭受术后疼痛的困扰,更需要良好的围术期镇痛。另外,本研究结果显示,同基因型的男性患者其痛阈、耐痛阈均显著高于女性患者,这与Palanisami等[14]的研究结果一致。Mattos Feijó等[15]的研究也表明,疼痛反应存在性别差异,女性对伤害性刺激更敏感,在遭受长期疼痛困扰时,女性内心表现更脆弱。疼痛敏感性的性别差异可能与性激素有关,性激素水平的变化在疼痛敏感性和镇痛反应中起着重要作用[16]。因此认为,OPRM1 A118G突变型纯合子的患者,尤其是女性患者更容易遭受术后疼痛的影响,更需要结合手术方式采取合理的术后镇痛措施,最大限度地降低术后疼痛,提高患者对围术期疼痛管理的满意度,真正实现舒适化、个体化的术后疼痛管理。
3.3随着年龄的增长,机体对疼痛的敏感性降低[17]。本研究发现,OPRM1 A118G基因GG型≥50岁患者的痛阈和耐痛阈显著低于同基因型的30~39岁和40~49岁患者。刘礼锋等[18]的研究结果显示,患者的手术后疼痛感觉程度与年龄呈负相关性。这与我们的研究结果不一致,本研究中携带GG基因型的≥50岁患者的疼痛敏感性低于同基因型的30~39岁和40~49岁患者,这可能与影响痛觉敏感性的原因较多、实验性疼痛的痛觉敏感性并不能完全替代临床疼痛有关。今后的研究中,可考虑影响疼痛的更多因素来进一步分析。
3.4不同的麻醉方式也会影响腰椎手术患者的术后疼痛程度[19],为减少偏倚,本研究均纳入行气管插管全身麻醉的患者,结果显示,三组患者术后6~48 h的静息时NRS评分差异无统计学意义(P>0.05);但GG组术后6~48 h的活动时NRS评分显著高于AA组和AG组。参考相关文献[20],本研究舒芬太尼术后镇痛剂量为2 μg/kg,结果提示该剂量对于安静休息的三组患者的镇痛效果相当;但对于活动状态下的患者,该剂量对GG组患者的镇痛效果较差。另外,本研究结果显示,GG组的术后镇痛满意率显著低于AA和AG组,也进一步证实OPRM1 A118G基因GG型患者对疼痛更敏感,需结合术前疼痛测量值来优化术后镇痛方案,降低患者围手术期疼痛感,提高患者术后镇痛满意率。
综上所述,OPRM1 A118G基因多态性和患者术前痛觉敏感及术后疼痛感觉存在关联性,在今后的研究中可选择不同的方式对患者的痛阈和耐痛阈进行测量,为进一步完善围术期疼痛管理提供理论依据。
