小鼠口腔癌不同时期淋巴结和骨髓的VEGF表达情况及其微环境对淋巴道转移的影响
2021-02-05颜启璋郭梦竹于大海
路 莹,程 立,颜启璋,陈 念,李 晶,郭梦竹,于大海
口腔鳞状细胞癌是上皮来源口腔恶性肿瘤,主要发生淋巴道转移[1]。肿瘤转移的一个关键步骤是循环肿瘤细胞进入二级或较远的器官部位,成为播散肿瘤细胞(disseminated tumor cell,DTC)[2]。DTC能否在远处器官定植、生长成瘤的影响因素很多[3,4]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种分泌性生长因子,其主要作用是促进血管生成,与肿瘤的发展及转移密切相关,其在口腔癌发生、发展中的作用已有较多研究[5,6]。但是,关于口腔癌发展过程中淋巴结和骨髓内的VEGF表达及其与DTC的相互作用尚无研究。在前期研究[7,8]中,本课题组成功使用4-硝基喹啉-1-氧化物(4-nitroquinoline-1-oxide,4-NQO)饮水法构建了Balb/c小鼠口腔癌颌下淋巴结转移模型,该模型可以获取口腔癌发生、发展及转移过程中不同时期的颌下淋巴结、骨髓进行研究,且小鼠间个体差异小,可连续观测,结果的可靠性及精确度较高。因此,在前期研究基础上,本研究旨在观察口腔癌发展各阶段中骨髓、淋巴结微环境及癌细胞的VEGF表达情况,探讨其在口腔癌淋巴道转移靶向性的相互作用。
1 材料与方法
1.1动物来源与建模 选入40只6周龄雄性健康Balb/c小鼠(购于北京维通利华实验动物技术有限公司)构建小鼠口腔癌淋巴道转移模型,将其随机分为A、B、C、D、E组,每组8只。建模方法[7,8]:用纯水将4-NQO(购自Sigma,美国)配置成1%浓度,4 ℃冰箱保存。A组小鼠将自来水置于塑料瓶中,自由饮用。B~E组小鼠将配制好的4-NQO溶液以自来水稀释成200 mg/L浓度置于避光饮水瓶内,自由饮用,后改喂自来水。B组小鼠饮用混有4-NQO溶液的自来水8周后改喂单纯自来水,该时期小鼠舌部黏膜尚未出现病理改变,但已经存在4-NQO药物影响。C组小鼠饮用混有4-NQO溶液的自来水20周后处死,该时期小鼠舌部黏膜已经出现异常增生表现,但未形成癌症。D组小鼠饮用混有4-NQO溶液的自来水20周后改喂单纯自来水4~8周,该时期小鼠已经形成舌癌,但尚未发生转移。E组小鼠饮用混有4-NQO溶液的自来水20周后改喂单纯自来水8~12周,该时期小鼠口腔癌已经形成,并伴有下颌淋巴结转移。
1.2标本的获取方法与检测
1.2.1 标本的获取方法 (1)HE染色与免疫组化染色的标本获取:颈椎脱臼法处死小鼠,切取小鼠舌体组织及双侧下颌下淋巴结,以福尔马林溶液进行固定。取双侧股骨,清洗去净肌肉及软骨组织,剪去股骨两端,应用注射器抽取1 ml生理盐水,冲洗股骨骨髓至EDTA抗凝管,上下颠倒几次后充分摇匀,置于冰盒内运回实验室保存备用。(2)液相芯片法的标本获取:颈椎脱臼法处死小鼠,取小鼠颌下淋巴结,放入DMEM培养液中剪碎研磨,过滤获得单细胞悬液,作为淋巴结微环境样本。应用注射器抽取培养液冲出股骨骨髓,作为骨髓微环境样本。
1.2.2 HE染色与免疫组化染色法检测小鼠口腔癌分期 分别收集5组小鼠的舌体组织及颌下淋巴结组织,常规脱水包埋,连续5 μm切片,60 ℃烤片3 h。舌体组织切片进行常规HE染色,光学显微镜下观察各组病理学特点。颌下淋巴结组织切片行Pan-CK免疫组化染色,柠檬酸盐缓冲液高压修复抗原,3% H2O2封闭处理,4 ℃下Pan-CK一抗(兔抗鼠多克隆抗体,博士德)孵育过夜,滴加二抗,室温下孵育30 min,二氨基联苯胺(diaminobenzidine,DAB)显色。采用已知Pan-CK抗体阳性组织作为阳性对照,以磷酸缓冲盐溶液(phosphate buffer saline,PBS)代替一抗作为阴性对照。
1.2.3 免疫组化法检测VEGF表达 收集5组小鼠的颌下淋巴结组织,常规脱水包埋,连续5 μm切片,60 ℃烤片3 h。滴1滴骨髓溶液至载玻片,将骨髓溶液向载玻片的另一端方向推动涂抹,直至骨髓铺完成膜,室温下晾干,4%多聚甲醛固定,制作骨髓涂片。免疫组织化学染色采用常规SP法。淋巴结组织石蜡切片脱蜡复水,柠檬酸盐缓冲液高压修复抗原。骨髓涂片0.5% Triton X-100室温下孵育10 min。淋巴结组织切片及骨髓涂片均用H2O2阻断内源性过氧化物酶。滴加VEGF一抗(兔单克隆抗体,浓度:1∶400,Abcam),4 ℃孵育过夜。滴加二抗,室温下孵育30 min,滴加DAB显色,镜下观察并控制显色时间。以已知VEGF抗体阳性组织作为阳性对照,PBS代替一抗作为阴性对照。结果判定标准[9]:VEGF表达于胞浆,以胞浆中出现明显的棕黄色染色为阳性表达。
1.2.4 共培养模型建立 使用0.4 μm孔径聚碳酸酯膜的Transwell小室,置于24孔板中。提前1 d将人舌鳞状细胞癌细胞系(SAS细胞,购自南京科佰生物科技有限公司)种入下室中,细胞密度5×104/ml。将取得的A、B、C、D各组淋巴结或骨髓微环境样本放入上室中进行共培养,作为实验组。将淋巴结或骨髓微环境置于上室中,下室不加入SAS细胞,仅有培养基作为对照组。均在共培养0 h、24 h、48 h、72 h后,收集微环境上清液,将上清液置入液氮中迅速冷冻,并保存于-80 ℃超低温冰箱。共培养模型目的是模拟检测VEGF的表达对骨髓、淋巴结中DTC影响,而E组已形成转移癌,意味着DTC已增殖成瘤,因此未构建E组共培养模型。由于每组仅取得1例样本,未行重复实验。
1.2.5 液相芯片法检测VEGF表达 按照VEGF液相芯片试剂盒(Thermo Invitrogen,美国)操作。取96孔板,每孔加50 μl预混微球,平放在磁性分离板上2 min后弃上清液,然后每孔加入1.2.4中的骨髓、淋巴结、共培养样本及标准品各50 μl,室温下振荡反应30 min,于4 ℃静置过夜。弃上清液,每孔加入1×检测抗体混合液25 μl,室温震荡反应30 min,最后每孔加入SA-PE 50 μl。将96孔板从磁性分离板上取出,室温震荡反应30 min,洗板后上机。采用Bio-Plex 200检测系统检测样本的荧光强度,根据标准品的荧光强度计算各样本细胞因子浓度。判定方法:采用五参数非线性回归的方式拟合标准曲线,计算出浓度值。
1.3统计学方法 应用SPSS24.0统计软件进行数据分析,不符合正态分布的计量资料以中位数(下四分位数,上四分位数)[M(P25,P75)]表示,组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1各组小鼠舌部HE染色及颌下淋巴结Pan-CK免疫组化染色结果 HE染色结果显示,A组、B组小鼠舌部未见病理改变;C组可见上皮钉突明显增长,细胞呈多形性,出现有丝分裂;D组、E组细胞呈团块样排列,中心部分可见角化珠。A、B、C、D组颌下淋巴结Pan-CK免疫组化染色呈阴性;E组可见淋巴结转移灶内成片分布的Pan-CK阳性染色细胞,着色深,提示小鼠已发生口腔癌颌下淋巴结转移。见图1。
2.2各组小鼠骨髓中VEGF表达情况 VEGF免疫组化染色结果显示,阳性染色细胞于胞浆内着色,同一张玻片不同视野即可见阳性染色的细胞表达情况有明显差异。骨髓涂片上骨髓细胞散在且分布稀疏,且由于不同视野下细胞数量及阳性表达细胞差距较大,因此难以进行评估分析。见图2。
2.3各组小鼠颌下淋巴结中VEGF表达情况 VEGF免疫组化染色结果显示,5组淋巴结均可见VEGF表达,胞浆染色阳性。A组呈聚集分布;B组少许散在的点状分布;C组阳性染色细胞较多,开始聚集;D组可见大量阳性染色细胞聚集;E组阳性染色的细胞呈大块片状聚集。见图3。
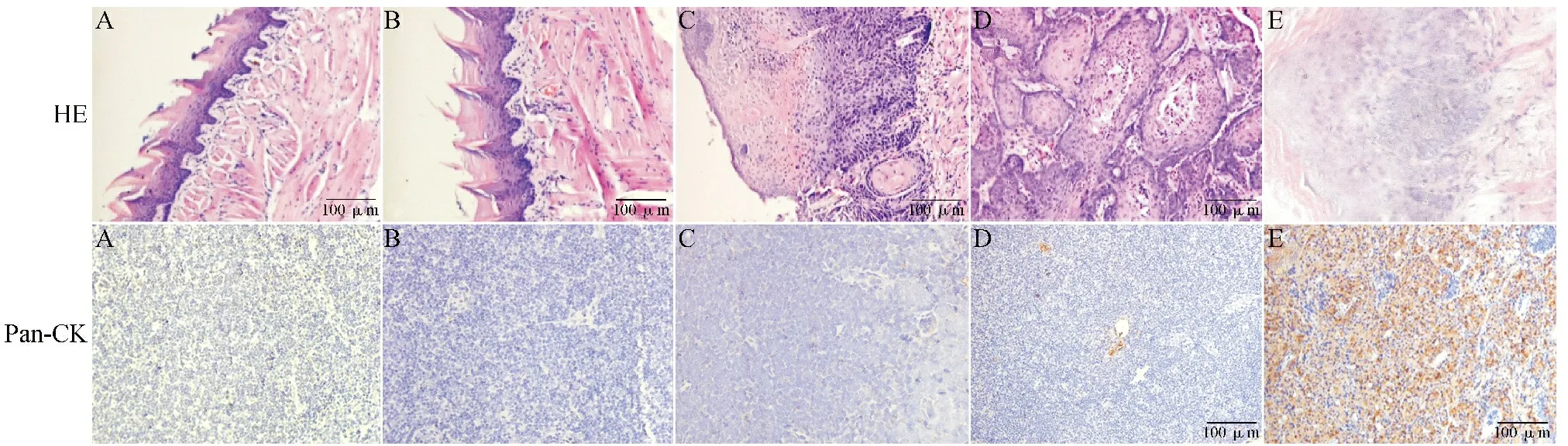
图1 各组小鼠舌部HE染色及颌下淋巴结Pan-CK免疫组化染色所见(×200)

ⓐVEGF阳性染色的细胞数量少,着色浅;ⓑ阳性染色的细胞数量多且着色深

黑色箭头所指为阳性染色
2.4各组小鼠骨髓和淋巴结的VEGF表达比较 液相芯片法检测结果显示,对于淋巴结组织,A组VEGF表达水平显著高于C组和D组(P<0.05),E组显著高于C组(P<0.05),其余组间比较差异无统计学意义(P>0.05)。对于骨髓组织,A组和B组VEGF表达水平显著高于C组、D组和E组(P<0.05),其余组间比较差异无统计学意义(P>0.05)。5组小鼠骨髓组织的VEGF表达水平均显著高于淋巴结组织(P<0.05)。见表1。

表1 各组小鼠骨髓和淋巴结的VEGF表达比较[M(P25,P75),pg/ml]
2.5各组小鼠SAS细胞在不同时期淋巴结及骨髓微环境中各时间点VEGF的表达情况 共培养实验结果显示,在A组、B组和C组时期的淋巴结和骨髓微环境中,SAS细胞在24~72 h时段内的VEGF表达呈上升趋势。而在D组时期淋巴结微环境中,SAS细胞在24~72 h时段内的VEGF的表达呈下降趋势,但在D组时期骨髓微环境中,SAS细胞在24~72 h时段内的VEGF的表达呈上升趋势。见表2。

表2 各组小鼠SAS细胞在不同时期淋巴结及骨髓微环境中各时间点VEGF的表达情况(pg/ml)
3 讨论
3.1Schwonzen等[10]的研究表明,骨髓涂片检查不能如实反映骨髓情况。本实验的骨髓涂片免疫组化结果也显示,在不同高倍镜视野下,阳性染色的细胞表达差异较大。且受实验者操作的影响,不同涂片间的误差也较大,导致其免疫组织化学法检测结果不可靠。Aguirre-Ghiso[11]认为肿瘤休眠可分为免疫休眠、细胞休眠以及血管休眠。本课题组的前期研究[12]发现,不同微环境对肿瘤细胞有着不同作用,可影响肿瘤细胞的增殖与休眠,最终被动形成淋巴道转移的靶向性。Kazerounian和Lawler[13]的研究表明,血管休眠机制是指通过抑制内皮细胞增殖和血管生长的因素,导致肿瘤细胞缺氧和营养剥夺而使肿瘤细胞进入休眠状态。血管生成是肿瘤生长和进展的标志,肿瘤的生长和转移具有血管依赖性。另一方面,本课题组在研究过程中发现免疫介导的休眠参与了口腔癌淋巴结转移靶向性的形成。在口腔癌发生、发展直至转移的过程中,小鼠骨髓内CD4+/CD8+T细胞比值呈上升趋势;而在淋巴结内,转移癌期CD4+/CD8+T细胞比值下降,免疫失衡,造成机体识别和杀伤肿瘤细胞的能力下降。这种骨髓及淋巴结微环境中免疫状态的差异,是使骨髓内DTC保持休眠状态,而淋巴结内DTC增殖的原因之一。Shiozawa等[14]研究发现骨髓中的造血干细胞可以分泌生长停滞特异性蛋白6(growth arrest specific protein 6,GAS6)、骨形成蛋白4(bone morphogenetic protein 4,BMP4)、骨形成蛋白7(bone morphogenetic protein 7,BMP7)、转化生长因子β2(transforming growth factor β2,TGFβ2)等,通过细胞休眠机制,可抑制骨髓内DTC增殖成瘤。
3.2Murrell等[15]认为在微环境改变时,DTC被“唤醒”,从而在该微环境被动时发生了转移。Nishida等[16]的研究表明,肿瘤的发生、发展依赖于新生血管的生成,肿瘤细胞可通过合成和分泌血管生成因子调节肿瘤组织的血管生成。VEGF不仅可作用于血管内皮细胞上的受体诱导血管形成,间接促进肿瘤细胞的生长,而且还可通过作用于肿瘤细胞上的受体,直接促进肿瘤生长。VEGF作为特异内皮细胞的有丝分裂素,是主要的血管生成因子,可增加血管通透性,促进肿瘤血管形成。本实验结果显示,经成瘤干预8周小鼠的淋巴结组织的VEGF的表达水平先出现降低,但随着病情的进展,VEGF的表达水平又逐渐上升,并在转移期达到最高水平。VEGF是肿瘤血管发生过程中的主要正性调控因子,通过促血管生成作用,参与肿瘤的发展过程。且由于淋巴结内免疫失衡,缺乏骨髓内存在的造血干细胞等因素,未能分泌相关抑制因子,因而未能抑制DTC增殖。VEGF在淋巴结组织的表达上升,促进血管生成,增加淋巴结转移发生的风险。
3.3Lech-Maranda等[17]的研究表明VEGF能够增加血管通透性,导致血浆蛋白和纤维蛋白及液体经血管外渗而引起细胞外基质改变,有效促进血管和新基质形成,为肿瘤侵袭及转移提供基础。本实验结果显示,A组和B组骨髓组织的VEGF表达水平显著高于C组、D组和E组。骨髓组织VEGF的表达降低可能是免疫功能增强及其他细胞因子共同作用的结果。而当VEGF在骨髓内的表达下降,血管生成受到抑制,使骨髓内DTC处于血管休眠状态,未能形成骨髓转移。尽管本研究液相芯片的结果显示,小鼠骨髓组织的VEGF表达水平显著高于淋巴结组织,但是由于淋巴结内免疫失衡,且缺乏骨髓内存在的造血干细胞,未能分泌相关抑制因子,故未能形成DTC免疫休眠及细胞休眠,因而不能抑制DTC增殖,并通过VEGF表达上升,血管生成增加而成瘤。而骨髓组织可通过免疫、细胞及血管休眠的协同作用使DTC处于休眠状态,抑制增殖成瘤。这与临床上口腔癌多为淋巴结转移,很少发生骨髓转移的现象相一致。
3.4由于本课题组的前期研究[18]发现在中重度异常增生时期,DTC已经进入骨髓和淋巴结中,由此推测从该时期始,DTC可能已经对组织微环境造成影响。在肿瘤发展及转移时期,DTC数目增多,也是恶性程度不断上升的细胞累积过程[19]。本研究中共培养实验的结果显示,除D组时期骨髓微环境中SAS细胞在24~72 h时段内的VEGF的表达呈下降趋势外,在其余组别时期的骨髓或淋巴结微环境均促进了SAS细胞在24~72 h时段内VEGF的表达。考虑为由于D组时期骨髓组织中其他细胞因子的影响,抑制了VEGF的分泌,导致其表达下降,这可能也是口腔癌较少骨髓转移的原因之一,有待进一步开展研究验证。由于在转移癌形成之前,微环境内仅有散在分布的DTC,其可能仅影响细胞周围微环境中VEGF的表达,而对于整个淋巴结或骨髓微环境影响作用较小。随着DTC累积增多,当其对VEGF的促进作用超过了微环境中其他因素抑制其表达的能力,VEGF则表达升高,从而促进DTC团块血管生成[20,21]。DTC增殖和VEGF表达形成了相互促进的机制。本研究结果显示,无论是组织检测还是共培养,A组的VEGF表达均高于B组、C组和D组,这可能是由于4-NQO药物对小鼠机体早期影响所造成,当机体适应了药物的影响,VEGF逐渐随疾病进展持续升高。
综上所述,骨髓和淋巴结组织微环境可与DTC相互影响,共同作用,这可能是口腔癌淋巴道转移的靶向性的机制之一。
