当今慢性乙型肝炎治疗实践对HBV核酸检测方法的新需求
2021-02-05杨瑞锋陈红松鲁凤民
杨瑞锋,陈红松,鲁凤民
乙型肝炎病毒(hepatitis B virus,HBV)感染引起的慢性乙型肝炎(chronic hepatitis B,CHB)是我国肝硬化和肝细胞癌(hepatocellular carcinoma,HCC)的主要病因。自20世纪90年代起我国开展HBV疫苗新生儿普种以来,我国一般人群的HBV表面抗原(hepatitis B surface antigen,HBsAg)阳性率已降到5%左右,但由于既往感染者众多,现有慢性HBV感染者仍有8 000万人[1]。目前,我国每年CHB死亡人数超过30.8万,而诊断率仅为19%,治疗率仅为10%~11%,达成世界卫生组织提出2030年“全面消除病毒性肝炎作为重大公共安全威胁”的目标仍任重而道远[2]。当前,治疗CHB以恩替卡韦(entecavir,ETV)、替诺福韦(tenofovir disoproxil fumarate,TDF)和丙酚替诺福韦(tenofovir alafenamide,TAF)等一线核苷(酸)类似物[nucleos(t)ide analog,NUC]为主,可强效抑制病毒复制,阻滞CHB向肝硬化和HCC发展,但在启动治疗、疗效监测及停药判定等方面,均存在一定困难或争议。
1 对HBV低病毒载量血症(low-level viremia,LLV)的关注:进一步增加对HBV DNA试剂灵敏度的要求
LLV一般定义为血清HBV DNA持续或间歇高于最低检测限(limit of detection,LOD),同时<2 000国际单位(international unit,IU)/ml。有两种不同类型的LLV被关注,一是处于HBV感染自然病程免疫控制期的患者,即e抗原(hepatitis B e antigen,HBeAg)阴性的非活动性HBsAg携带状态。有数据显示,处于“非活动性”携带状态的患者其HCC风险依然存在。如最近一项来自韩国的随访中位数为5.1年的回顾性研究[3]显示,代偿期肝硬化患者5年HCC发生率为13.7%(19/139),而非肝硬化组HCC发生率也高达2.0%(17/867)。我国慢性HBV感染者基数依然庞大,并且随感染者年龄逐渐增加,肝硬化、肝癌风险逐年增高。为进一步通过抗病毒治疗减少终末期肝病及肝癌的发生,我国《慢性乙型肝炎防治指南(2019年版)》扩大了CHB的治疗适应证[4]。降低抗病毒治疗的“门槛”,不仅仅是一个科学问题,也关乎感染者的远期健康和国家的医疗负荷。当前更多被讨论的LLV状态,则指CHB患者接受NUC治疗但未取得完全病毒学应答的情形。当今即使在接受强效NUC治疗的CHB患者中,LLV的情形也非罕见。日本Ogawa等[5]报道,经ETV治疗2年的CHB患者,仍有19.9%(38/191)处于LLV。我国Sun等[6]纳入239例CHB患者,其中163例在基线时有明显肝纤维化,经ETV治疗78周后,30%的患者仍可检测到低水平HBV DNA。NUC治疗中的LLV是预后不良的预测因素。TDF治疗78周时血清HBV DNA可检出(多在20~200 IU/ml之间)和饮酒是基线Ishak≥3分患者肝纤维化进展的两个促进因素,表明持续、低水平的HBV DNA仍会促进肝纤维化进展[6]。NUC治疗中的LLV还会增加罹患HCC的风险,韩国Kim等[7]纳入875例接受ETV单药治疗的CHB患者,随访中位数为4.5年。LLV组和持续性病毒学应答组5年进展为HCC的风险比为1.98(14.3% vs 7.5%,P=0.015),且风险集中于肝硬化患者。当接受ETV或TDF治疗的CHB患者出现LLV时该如何处理,是当下临床关心的问题:是继续坚持治疗,还是换用或联合另一种NUC或长效干扰素;如需调整,如何确定调整的时机;调整后,病毒学应答率可提高多少;对患者的长期预后有多大改善。已有一些研究尝试回答这些问题,如Ogawa等[5]在一项多中心、回顾性队列研究中,连续纳入313例日本CHB患者,经ETV单药(n=191)或NUC联合治疗(n=122)至少2年,其中ETV治疗组34例维持LLV状态,NUC联合治疗组9例仍维持LLV状态。之后,所有受试者换为TAF治疗,48周后,ETV经治组和NUC联合经治组分别有97.1%(33/34)和77.8%(7/9)患者获得完全病毒学应答,提示换用TAF可能有助于LLV问题的解决。此外,药物用量、服药方式和患者的依从性等现实因素也可能造成间歇性LLV,也应纳入考量[8~10]。例如,有学者通过观察TDF治疗8年的CHB患者队列(n=641),发现病毒学突破或DNA闪现(blip)事件41次,平均DNA水平1 356拷贝/ml;其中71%(29/41)与患者依从性欠佳有关,继续用药都能获得病毒学抑制,也未发现TDF相关耐药突变。Liu等[10]倾向于认为,只要TDF治疗时间足够长,LLV并不至于触发治疗方案的改变。不过,该研究受试者为欧美人群,宿主和HBV基因型与亚洲均不同。未来需要更多的前瞻性、随机双盲对照临床试验,进一步明确如何更科学地管理LLV,以及解决LLV能使患者有多少现实获益等重要问题。目前各大指南对HBV DNA检测灵敏度(或称LOD)都提出了更高要求(见表1)。目前,国内外主流的HBV DNA定量试剂灵敏度可达到1~2 log10IU/ml或以下,且结果重复性较好[11],超敏试剂将有助于临床更早发现LLV。进一步说,病毒载量极低、接近检测试剂LOD的LLV也应引起重视。Kim等[7]认为,间歇性、极低载量LLV同样会导致不良预后。Sun等[6]发现,基线有肝纤维化、经TDF治疗的患者,即使HBV DNA“转阴”(<20 IU/ml),仍有6.3%的患者肝纤维化出现进展。对此可能的解释是,作者使用的LOD和线性范围低限均为20 IU/ml,灵敏度仍未达到美国肝病学会(AASLD)推荐的检测灵敏度(5~10 IU/ml),且研究者没有区分HBV DNA“未检测到”和“<20 IU/ml”线性检测下限两种结果模式,后者表示有PCR扩增曲线、仍有痕量DNA存在,只是无法准确定量(见图1)。这样一来,那些被判断为DNA“阴性”的肝纤维化进展患者,实际上外周血可能仍存在痕量HBV DNA,即处于极低病毒载量的LLV状态。据此我们建议,在LLV日益引起关注的当下,检验报告应增加对超敏HBV DNA试剂各种结果模式的备注,以帮助临床医师,尤其肝病科医师,清楚辨析这些复杂的结果模式(见图1)。从检验方法学角度分析,LLV风险和危害被不断强调的当下,临床诊治对HBV DNA检测下限的要求似乎“进无止境”,但我们究竟需要多么灵敏的HBV DNA检测试剂?最近一项来自欧洲的献血者和受血者的随访研究证实,抗-HBc阳性的隐匿性HBV感染(occult hepatitis B virus infection,OBI)的献血者血液中含有0.15 IU/ml的HBV DNA,即可导致受血者感染[12],而当前主流的HBV DNA定性或定量试剂,都远远达不到这个灵敏度要求。借鉴到临床肝病诊治的实践中,我们还需待进一步明确极低病毒载量HBV感染者的自然转归,以及通过更强效NUC治疗方案解决LLV后患者的真实获益。此外,片面强调试剂的灵敏度会导致污染产生的低值阳性结果被误当做LLV,从而给CHB的诊治带来困扰。PCR产物污染像一把悬于核酸检测实验室的“达摩克利剑”——一次充分反应的PCR可产生多达1012拷贝的DNA片段,将其投入标准的奥林匹克游泳池稀释,再从中取出和反应体系相同体积的水,其中仍含有400拷贝的DNA片段,足以伪装成LLV的假象[13]。面对LLV结果,应从临床和检验方法学两个角度辩证看待,如有必要,需动态监测(见图2)。此外,我们还需认识到,大部分国产试剂属于开放性试剂,可灵活适应于不同的核酸提取平台和PCR仪。但由此产生的问题是,操作过程及结果分析等步骤,易受操作者主观因素影响,结果偏倚较大,这是既往报道的、国产试剂和进口封闭性试剂性能有差距的重要原因。新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染疫情客观上促进了核酸检测人员的培养和场地、设备在医疗机构的完善,全自动、封闭式的提取和扩增平台以及结果自动定量算法的建立[14],都可进一步减轻操作负担,减少人为干扰,提高检测灵敏度、准确度和重复性,应成为未来几年国产核酸检测的发展方向。

表1 最新指南中对HBV DNA检测灵敏度的要求

图1 超敏HBV DNA定量结果报告模式及对应的解释

图2 从临床和检验方法学角度科学解读和管理间歇性LLV
2 预测NUC治疗停药:HBV pgRNA有潜在价值
近年来,我国NUC药品价格迅速降低,大大减轻了CHB患者长期服药的经济负担,但长期服药仍面临药物副作用、依从性、精神压力等挑战。各指南均推荐了NUC停药标准(见表2)。HBsAg的消失和(或)血清学转换是CHB功能性治愈的可靠标志,但现有治疗方案仅能使少数患者达到这一“理想终点”,因此HBsAg作为预测停药标志物,受众有限。近年来,新标志物如HBV前基因组RNA(pregenomic RNA,pgRNA)和核心相关抗原(hepatitis B core-related antigen,HBcrAg)等被陆续报道用于预测NUC治疗停药。pgRNA和HBcrAg均可反映cccDNA活性[18,19],且血清中两标志物水平也存在正相关[20]。在NUC治疗中,两个标志物的消失晚于HBV DNA而又早于HBsAg,因此,作为预测停药标志物,理论上兼具灵敏性和特异性(见图3)。Wang等[21]最早将pgRNA检测用于停药后复发风险研究,发现若停药时血清pgRNA阳性,则100%(21/21)停药后24周出现病毒学复发;若停药时pgRNA测不到,则复发率仅为25%(3/12)。Fan等[22]纳入127例HBeAg阳性、接受替比夫定联合阿德福韦或替比夫定单药治疗的CHB患者作为实验组,这些患者获得HBeAg血清学转换后停药并随访4年。以停药时血清HBV DNA和pgRNA作为临床复发[HBV DNA>2 000 IU/ml,丙氨酸氨基转移酶(alanine transaminase,ALT)≥2倍正常值上限]的预测指标,DNA和RNA“双阴性”患者复发率为8%(2/25),而DNA和(或)RNA阳性患者的复发率为31.4%(32/102,P=0.02);此外,纳入40例HBeAg阳性、接受ETV或TDF治疗的患者作为验证组,HBeAg血清学转换后停止治疗并随访5.5年,DNA和RNA“双阴性”患者复发率为15.4%(2/13),而DNA和(或)RNA阳性患者的复发率为33.3%(9/27,P=0.29)。Liu等[23]纳入30例HBeAg阳性(n=17)和阴性(n=13)且符合一定停药指征的CHB患者,随访2年,同样发现pgRNA有停药预测价值,相比停药时血清pgRNA“阳性”患者,pgRNA“阴性”患者的临床复发率更低(38.27% vs 17.50%,P=0.042)。从方法学角度看,HBV pgRNA的检测技术壁垒较低,技术原理与丙型肝炎病毒(hepatitis C virus,HCV)、人免疫缺陷病毒(human immunodeficiency virus,HIV)或SARS-CoV-2 RNA类似,已有基于实时荧光定量PCR原理的科研用试剂,LOD为50拷贝/ml,线性范围为100~1×109拷贝/ml,不同试剂的定量结果也有一定的可比性[24],但目前尚无国际标准品,也无获得国家食品药品监督管理局批准注册的试剂。值得注意的是,考虑到RNA提取纯化过程中HBV DNA残留可能会导致RNA水平被高估,从临床意义和技术特点两方面考虑,我们不建议将HBV pgRNA试剂用于HBV DNA高值阳性样本的检测;如确有必需,可考虑采用基于核酸依赖序列扩增(nucleic acid sequence-based amplification,NASBA)技术的pgRNA检测方法,可特异性扩增RNA而非双链DNA[25]。总结新近的pgRNA指导停药研究可发现,即使停药时HBV pgRNA“转阴”,仍有一定概率复发,提示我们两点:第一,各研究所使用的pgRNA检测方法不同,灵敏度也不尽相同,pgRNA“转阴”患者,实际上可能是试剂LOD之下的低RNA载量患者。第二,pgRNA单独(或与HBcrAg等指标并联)使用时,“阳性预测价值”(positive predictive value,PPV)更大,即“阳性”则提示有较高的复发风险,患者应继续规范用药;检测结果“阴性”提示复发风险较低,但并非小到可以忽略,需综合判断。
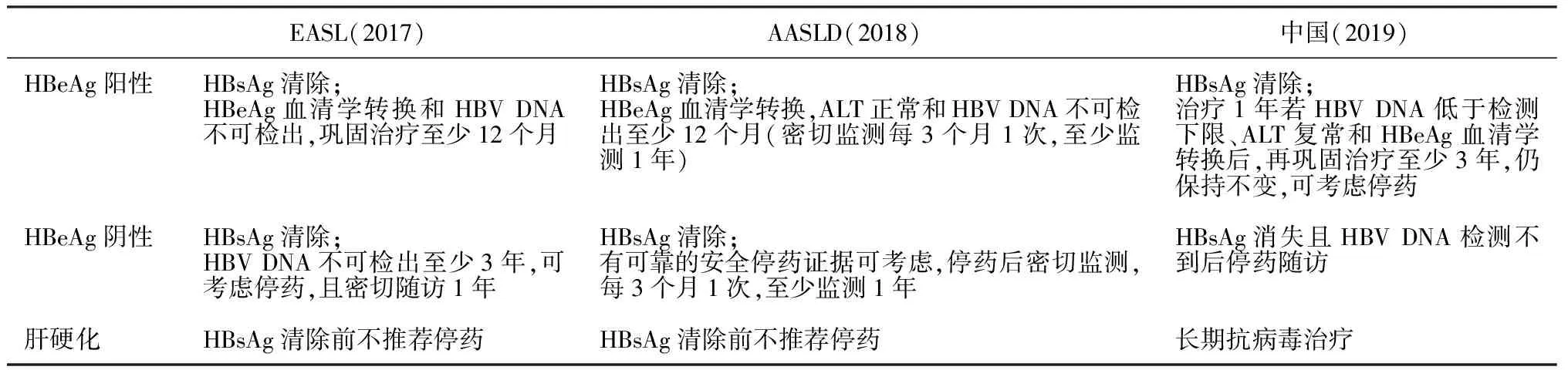
表2 不同指南推荐的CHB患者停药标准[4,12,13]
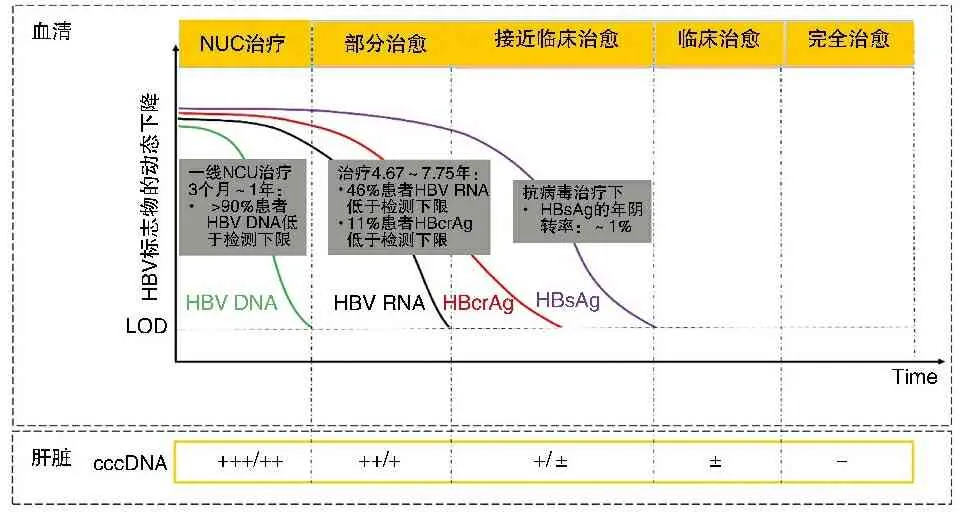
图3 血清HBV DNA、RNA及HBcrAg、HBsAg在抗病毒治疗过程中的动态变化[26]
3 NUC抗病毒治疗:对HBV DNA、pgRNA定量试剂结果有影响
对于未经NUC治疗的CHB患者,外周血病毒核酸以Dane颗粒包裹的松弛环状DNA(relaxed-circular DNA,rcDNA)为主,还有7%~20%的双链线性DNA(duplex-linear DNA,dlDNA)[27],现有的商品化试剂可检测两者,而不能区分是rcDNA还是dlDNA。不同HBV DNA试剂定量结果差异,主要源于引物或探针设计区域病毒突变造成的扩增效率降低,为避免这种情况,大多数HBV DNA试剂采用简并引物或探针。而在NUC治疗下,逆转录过程因NUC插入使rcDNA形成被抑制,血清HBV DNA主要由3′末端残缺的不完整的负链DNA片段构成。临床HBV DNA检测时,位于5′端最先被逆转录出的X片段最易被检测到,位于3′端的PreC/C基因序列则最早消失。与此相反,pgRNA片段位于3′端的X区的序列最易被丢失,而5′端的序列更易被保留。不同品牌HBV DNA和pgRNA定量试剂,针对不同的区域设计引物和探针[28],检测NUC治疗患者血清,结果会有差异(见图4)。我们回顾性检测10例接受替比夫定治疗的CHB患者系列血清中的HBV DNA和RNA,发现rcDNA在治疗开始后最先消失,前C/C、S和X区基因片段依次消失;而出现病毒学反弹的患者,X区DNA首先出现[29]。由此可见,NUC治疗会对HBV DNA和pgRNA检测造成影响,如有必要,可像SARS-CoV-2或HIV RNA检测试剂一样,采用针对≥2个目标基因的引物和探针,以避免漏检或低估病毒载量。此外,在pgRNA引物和探针区域的选择上,还需考虑NUC治疗下pgRNA剪接变异体的问题[30,31]。

图4 NUC治疗造成HBV DNA和RNA片段顺次消失,从而影响不同品牌HBV DNA和pgRNA定量试剂结果
4 CHB诊治现状对检测方法的需求:定性标志物追求“定量”,而定量标志物则追求“超敏”
HBV的血清学和分子生物学标志物众多,大部分已实现定量化检测(见表3),同时,定量标志物又有进一步提高灵敏度的需求[32]。然而HBV诊治的新旧标志物众多,研究结论也有不尽相同甚至矛盾之处,反映出当前我们对HBV的复制和病理机制仍然了解不足,CHB的治疗仍然欠缺有效根除病毒的手段,cccDNA潜伏、NUC需长期治疗、部分治疗的患者肝硬化和肝癌仍在潜滋暗长,这些都是我们无法回避的痛点和难点。推广HBsAg定量、开发抗-HBc、HBcrAg和HBV pgRNA等新型定量标志物,苛求HBV DNA高灵敏度及准确性,仍是当前治疗水平下、在根治性治疗方法问世之前,实现CHB精准治疗所需。
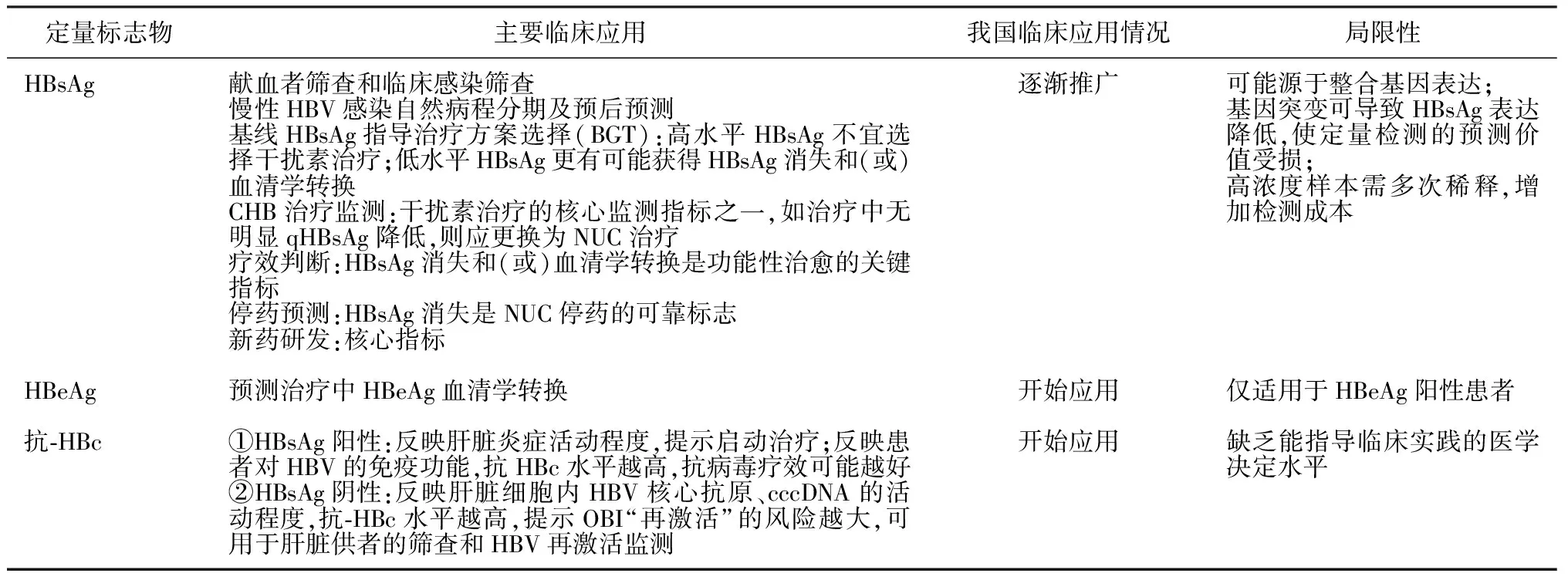
表3 HBV定量标志物的临床诊治价值及应用前景

续表3
5 结语
理论研究有助于新标志物应用于临床,而现实世界中,可能面临新技术难度大,可及性差,或新试剂性能缺乏全面评价,不同实验室结果变异大、PCR携带污染或气溶胶污染造成假阳性DNA/pgRNA结果等现实问题,提示我们有必要在理论和实践之间寻找平衡。不过,即使如此,我们仍需对研发新标志物、不断提高现有标志物检测性能保持热情,以不断促进我们对HBV这一“狡猾”的病毒特性的理解。以“功能性治愈”甚至“根治”为目标的新药研发,也需要纳入这些标志物以评价有效性[33]。此外,从人类病毒学研究的历史看,HBV的血清学和分子生物学标志物的研发和应用经验,也可为其他病毒或新发病毒的诊治提供有益借鉴。
