SO2、NO2 与针铁矿、赤铁矿、磁铁矿的非均相反应
2021-02-05贾小红顾文君张欢欢唐钰婧唐明金
贾小红, 王 甫, 任 燕, 李 锐, 顾文君, 张欢欢, 唐钰婧, 彭 超*, 唐明金
(1. 中国科学院 广州地球化学研究所 有机地球化学国家重点实验室/广东省环境资源利用与保护重点实验室/粤港澳环境污染过程与控制联合实验室, 广东 广州 510640; 2. 深圳市龙华疾病预防控制中心, 广东 深圳 518109; 3. 中国科学院大学, 北京 100049)
0 引 言
矿质颗粒物主要来源于干旱和半干旱地区, 据估计全球每年约有1000~3000 Tg 矿质颗粒物排放至大气中[1-2], 对对流层化学过程[3-4]、气候变化[5-8]和人类健康[9-10]等产生非常重要的影响。矿质颗粒物的沉降是开放海域地区关键微量营养元素(如Fe 和P 等)的主要来源[11-13], 在很大程度上决定了海洋的初级生产力[14], 最终影响生物地球化学循环。Fe 是矿质颗粒物的重要组分, 绝大多数以难溶态铁的形式存在[15-16]。研究表明, 远海洋上空气溶胶中的水溶性铁含量远远高于近沙尘源区[17-18], 而大气化学过程(如成云过程)能够显著提高矿质颗粒物中的水溶性铁含量[14,19,20]。但目前关于非均相反应对矿质颗粒物中Fe 元素水溶性影响的研究十分有限[17,21]。
硫酸盐是我国大气颗粒物的重要组分[22-24], 可吸收和散射太阳辐射直接影响全球气候变化[25-26], 也可作为云凝结核间接改变大气辐射平衡[25,27,28]。SO2的氧化是对流层中硫酸盐的主要来源, 有3个主要途径, 即SO2与OH 自由基的气相氧化[27]; O3、H2O2、OH 自由基氧化和过渡金属(Fe 和Mn 等)催化作用下的O2氧化等液相氧化[27]; 非均相反应氧化[29-32]。与外场观测比, 数值模拟一般高估SO2浓度而低估硫酸盐浓度[30,33,34], 仅用气相反应和液相反应已不足以解释这一现象。外场观测表明, 矿质颗粒物表面常常覆盖有硫酸盐[35-36], 而模式研究中[37]加入矿质颗粒物的非均相反应, 可以更好地模拟硫酸盐浓度。因此SO2与矿质颗粒物非均相反应可能是硫酸盐形成的重要途径[37-38]。
近年来, 许多学者相继开展了SO2与Fe2O3、FeOOH、MgO、Al2O3、撒哈拉沙尘和中国黄土等非均相反应研究[32,39-45]。例如, Adamset al.[39]和Usheret al.[44]使用内壁涂层流动管和努森池等研究了SO2与撒哈拉沙尘、中国黄土的非均相反应, 测得初始反应摄取系数为(6.6±0.8)×10−5和(4±2)×10−5; 使用漫反射傅里叶变换红外光谱仪研究得到SO2与撒哈拉沙尘、CaCO3非均相反应的初始摄取系数低两个数量级[31,43]。此外, 低相对湿度条件下, SO2与Fe2O3、FeOOH 非均相反应极其微弱[46-47]; 当相对湿度由0%增加至82%, SO2与Fe2O3非均相反应的摄取系数先增大后减小[46]。相对湿度的增加显著提高了SO2与CaSO4、CaCO3和美国亚利桑那沙尘等反应摄取系数[48-50]。共存气体可能会促进SO2与矿质颗粒物非均相反应硫酸盐的形成。目前, 许多学者已开展了SO2、NO2与撒哈拉沙尘、Fe2O3、MgO、CaO 和Al2O3等矿质颗粒物非均相反应的复合效应研究[30,32,42], 与SO2的非均相反应相比, NO2的共存显著促进了硫酸盐的形成。此外, O3、H2O2和HCOOH等共存也能显著影响SO2在矿质颗粒物表面硫酸盐的生成[31,44,51-53]。
本研究拟开展SO2、NO2与针铁矿、磁铁矿、赤铁矿在不同相对湿度(0%、30%、60%和90%)条件下的非均相反应, 定量分析反应后颗粒物表面生成的硫酸盐、硝酸盐以及水溶性铁的含量随反应时间的变化。进一步阐明SO2和矿质颗粒物的非均相反应对硫酸盐和水溶性铁的贡献, 有助于更好地评估矿质颗粒物的非均相反应对硫酸盐和Fe 元素水溶性的影响。
1 实验方法
1.1 样品制备
本研究选取了3 种含铁矿物, 即针铁矿(>98%, santa cruz)、磁铁矿(>95%, strem chemicals)和赤铁矿(>99.8%, strem chemicals) 。 采 用 比 表 面 积(Brunauer-Emmett-Teller, BET)和孔径分布测定仪(ASAP 2640, micromeritics)测定了3 种样品的比表面积, 分别为(11.30±0.08) m2/g、(6.34±0.04) m2/g 和(9.23±0.17) m2/g[21]。
为了使反应气体与颗粒物充分接触, 将颗粒物均匀附着在聚四氟乙烯(PTFE, 47 mm, Whatman)滤膜上。制备方法如下: 称取0.25 g 颗粒物于500 mL塑料广口瓶中, 加入500 mL 乙醇溶液(高效液相色谱纯, 天津市科密欧化学试剂有限公司)。使用磁力搅拌器不断搅拌使颗粒物在酒精中均匀分散, 得到0.5 g/L 颗粒物和乙醇混合物。吸取10 mL 混合物滴于空白PTFE 滤膜上, 待酒精完全挥发后, 取出制备好的样品膜并置于干净的膜盒中, 将膜盒置于托盘中。在托盘上方铺放干净的保鲜膜, 使用该方法能够避免样品膜与实验室空气的接触。反复称重, 最终颗粒物的质量为(5±1) mg。
1.2 非均相反应
图1 为SO2和NO2与矿质颗粒物非均相反应的装置示意图, 左上部分为气路系统, 右上部分为反应系统。气路系统由4 路气体组成, 即(1) NO2标准气体; (2) SO2标准气体; (3) 干合成空气; (4) 湿合成空气。MFC1、MFC2、MFC3 和MFC4 均为质量流量控制器(D07-7K, 北京七星华创电子股份有限公司), 分别控制上述4 路气体的流速。NO2标准气体(2.05×103μg/L, 中国计量科学研究院国家标准物质研究中心)和SO2标准气体(2.86×103μg/L, 佛山得力梅塞尔气体有限公司)的流速均为 0~10 mL/min, 干、湿合成空气(>99.999%, 佛山华特气体有限公司)的总流速为350 mL/min。湿合成空气通过两个串联的鼓泡装置(125 mL, 品牌SYNTHWARE)产生, 通过调节干湿两路合成空气的流速比以控制混合气的相对湿度, 相对湿度范围为0%~90%, 精度为1%。4路气体在通入反应器之前相互混合, 最终得到总流速约为350 mL/min 的模拟空气, 混合气中SO2和NO2的浓度分别为(7.14±0.29) μg/L 和(5.13±0.21) μg/L。
反应系统主要由空白反应器(blank)和样品反应器(sample)组成, 空白反应器放置一张空白PTFE 滤膜, 在反应开始之前, 混合气通入空白反应器中平衡。待SO2和NO2气体浓度稳定后, 将混合气切换至样品反应器中, 开始反应。反应过程中, 混合气自上而下穿过样品膜。反应结束后, 将混合气切换至空白反应器, 取出反应后的样品膜并存放于塑料膜盒中, 密封保存, 在30 min 内尽快分析。为了减小混合气在反应器中的壁损失, 选取两个完全相同且为特氟龙(PFA)材质的膜托(47 mm, Savillex)作为空白反应器和样品反应器, 内径为42 mm, 内壁长度为48 mm, 反应器内部体积为66 mL, 流速为350 mL/min, 混合气在反应器中的停留时间大约为11 s。
如图1 右下部分所示, 反应后的混合气经实验室空气混合稀释, 最终进入SO2分析仪(T100, API)和氮氧化物分析仪(T200, Teledyne API)进行在线检测。混合气被实验室空气(经滤膜过滤)稀释后总流速约为1100 mL/min, 参与反应的混合气(350 mL/min)最终被稀释了3.14 倍。整个实验过程中, 过滤后实验室空气中SO2浓度小于0.06 μg/L, NO2浓度小于0.10 μg/L, 对混合气中SO2和NO2浓度的检测影响可忽略不计(<1%)。
1.3 样品分析
反应结束后, 使用陶瓷剪刀将样品膜一分为二, 取半张膜剪碎并用10 mL 去离子水浸没, 轨道摇床震荡提取2 h (转速300 r/min)。提取后, 使用0.22 μm过滤头(聚醚砜, 上海安谱实验科技有限公司)过滤。使用Metrohm公司ECO 型离子色谱仪分析反应前后硫酸盐和硝酸盐等, 该仪器配备有万通品牌且型号为Metrohm suppressor Module 抑制器, 采用型号为Metrohm Metrosep A Supp 4-250/4.0 型分离柱实现不同离子的分离。淋洗液为 1.8 mmol/L Na2CO3和1.7 mmol/L NaHCO3混合缓冲溶液, 流速为1.0 mL/min, 抑制液为92 mmol/L的H2SO4溶液, 单次进样量为10 μL。
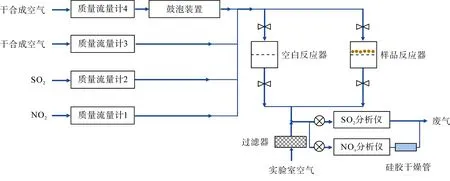
图1 SO2 和NO2 与矿质颗粒物非均相反应装置示意图 Fig.1 Schematic of the apparatus used to investigate heterogeneous reaction of SO2 and NO2 with mineral dust particles
为了更好地模拟大气颗粒物在海洋中的沉降, 许多研究学者使用低pH 缓冲溶液提取实际大气样品中水溶性铁含量[17,54-57]。本研究也使用类似方法提取和分析样品中水溶性铁, 即将另一半样品膜剪碎并用10 mL 5 mmol/L pH=4.18 的醋酸和醋酸钠缓冲溶液浸没, 轨道摇床震荡提取2 h。使用0.22 μm过滤头过滤, 加入59 μL 69% HNO3溶液(OPTIMA, fisher)酸化至提取液中HNO3体积分数为0.4%。使用电感耦合等离子体质谱(iCAP-Q, Thermo Fisher Scientific)分析总水溶性铁含量[21]。
2 结果与讨论
2.1 针铁矿的非均相反应
2.1.1 SO2与针铁矿的非均相反应
4 个不同相对湿度条件下, SO2与针铁矿反应24 h硫酸盐的生成量(硫酸盐质量与针铁矿质量比即(m(SO42−)/m(针铁矿))随相对湿度变化如图2 所示。随着相对湿度的增加, 硫酸盐生成量呈显著递增趋势。在干态下(相对湿度为0%), SO2与针铁矿反应几乎无硫酸盐生成; 当相对湿度为30%和60%时, 硫酸盐生成量分别约为(0.45±0.17)%和(0.62±0.04)%; 在相对湿度为90%的高湿度条件下, 硫酸盐生成量最大可达(0.79±0.04)%。已有研究表明[41,46,47,58], 干态下SO2与大多数矿质颗粒物非均相反应几乎无硫酸盐生成, 而高相对湿度更有助于非均相反应的发生, 进而促进更多的硫酸盐生成, 与本研究的结果较为吻合。

图2 不同相对湿度(0%、30%、60%和90%)条件下, SO2与针铁矿非均相反应24 h 硫酸盐的生成量 Fig.2 Sulfate formation in heterogeneous reaction of goethite with SO2 at 0%, 30%, 60% and 90% relative humidity for 24 h
2.1.2 SO2和NO2与针铁矿的非均相反应
不同反应时长和不同相对湿度条件下, SO2和NO2共存时与针铁矿反应硫酸盐的生成量如图3a 所示。在干态下(相对湿度为0%), SO2、NO2共存时与针铁矿反应24 h 后几乎无硫酸盐生成; 相对湿度为30%、60%、90%时, 反应24 h 仍未达到饱和; 相对湿度为30%和60%时, 反应有明显的硫酸盐生成, 硫酸盐的生成量最大为(0.55±0.16)%; 相对湿度增加至90%时, 硫酸盐生成量最高达(0.66±0.17)%。这表明相对湿度的增加有助于非均相反应的发生, 进而促进硫酸盐的生成。从整体来看, SO2和NO2共存时与针铁矿反应生成硫酸盐的量不足1%, 该反应对硫酸盐贡献有限。此外, 从SO2单独与针铁矿的反应结果相比, SO2、NO2共存时与针铁矿反应对硫酸盐的生成几乎无影响, 而已有研究表明, NO2和O3等气体的共存能够促进SO2和矿质颗粒物非均相氧化硫酸盐的形成[30-32]。例如, Liuet al.[32]使用漫反射傅里叶变换红外光谱技术(DRIFTS)开展了SO2、NO2分别与α-Fe2O3、CaO 和α-Al2O3等颗粒物的非均相反应研究, 发现NO2共存时能够显著促进SO2非均相反应硫酸盐的生成, 可能的原因是NO2共存时能够将颗粒物表面的亚硫酸盐氧化为硫酸盐, 最终生成更多的硫酸盐。在本研究中, NO2共存时对SO2非均相反应硫酸盐的生成几乎无影响, 推测是已有文献中使用的气体浓度(SO2浓度为5.71×102μg/L, NO2浓度为4.11×102μg/L)远远高于本研究, 低浓度NO2可能不足以将亚硫酸盐氧化成硫酸盐, 最终未能生成更多的硫酸盐。
图3b 为SO2和NO2共存时与针铁矿非均相反应的硝酸盐生成量。4 个不同相对湿度下, SO2、NO2共存时与针铁矿反应24 h 后仍未达到饱和。干态下(相对湿度为0%), SO2、NO2共存时与针铁矿反应24 h 后硝酸盐的生成量为(0.27±0.01)%; 相对湿度为30%和60%时, 有明显硝酸盐生成且最大生成量为(0.65±0.04)%; 当相对湿度增加至90%时, 硝酸盐生成量最高达(1.18±0.16)%。该结果表明, 随着相对湿度的增加, 硝酸盐的生成量呈显著增加趋势。这表明相对湿度的增加有助于NO2的非均相氧化过程, 进而促进硝酸盐的生成。此外, 同NO2与针铁矿的非均相反应相比[21], SO2和NO2共存时硝酸盐的生成量明显减少, 这表明SO2的共存抑制了硝酸盐的生成。这一研究结果与文献报道中的结果一致[32,42]。Liuet al.[32]研究表明, SO2的共存均能够抑制NO2与 α-Fe2O3非均相反应硝酸盐的生成。已有研究表明, 硫酸盐的吸湿性弱于硝酸盐[59]。当NO2与颗粒物发生非均相反应, 生成了硝酸盐; 而SO2和NO2共存时反应生成了硫酸盐和硝酸盐, 二者产物的存在使得颗粒物的吸湿性相对于NO2反应时减弱, 最终使颗粒物表面的吸附水减少, 进而抑制了硝酸盐的生成。在本研究中, 也可能是上述原因导致SO2和NO2共存时硝酸盐生成被抑制。
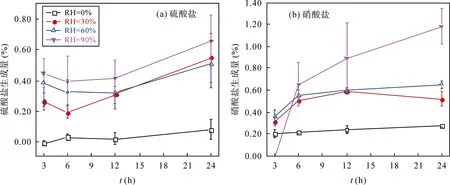
图3 不同相对湿度条件下, SO2、NO2 与针铁矿非均相反应硫酸盐和硝酸盐的生成量(RH 为相对湿度) Fig.3 Sulfate and nitrate formation in heterogeneous reaction of goethite with SO2 and NO2 at different relative humidity levels
2.1.3 反应摄取系数
摄取系数是定量大气非均相反应的重要参数, 是大气颗粒物摄取或反应能力的量化指标[60]。本研究计算了SO2非均相氧化反应的摄取系数γ(SO2), 其定义为矿质颗粒物表面硫酸盐的生成速率(r=d[SO42−]/dt)与SO2在颗粒物表面碰撞总频率(f)之比[31,46], 即:

对于SO2与针铁矿, SO2和NO2共存时与针铁矿反应24 h, SO2的平均反应摄取系数如表1 所示。SO2与针铁矿非均相反应24 h, SO2的平均反应摄取系数小于1×10−8, 且SO2反应摄取系数随相对湿度增加而增大。这可能由于一方面随着相对湿度的增加, 矿质颗粒物表面形成了水膜, 有助于SO2的吸收进而促进非均相反应进行[43]; 另一方面生成的硫酸盐具有一定吸湿性, 吸收更多水分子进而促进硫酸盐的形成[61]。SO2和NO2共存时与针铁矿反应前24 h, SO2平均反应摄取系数小于1×10−8, 相对湿度的变化对SO2反应摄取系数无显著影响。此外, NO2的存在对SO2反应摄取系数几乎无影响。

表1 SO2 与针铁矿非均相反应平均反应摄取系数 Table 1 Average reactive uptake coefficients of SO2 for goethite
本研究将反应生成的硫酸盐归一化为生成的硫酸盐在矿质颗粒物表面的覆盖层数, 计算公式[2]如下。
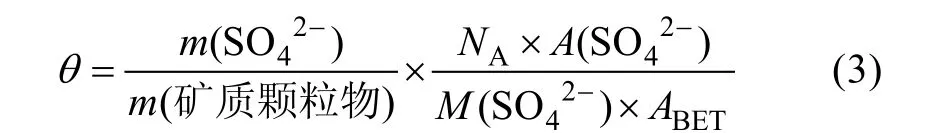
式中,θ表示硫酸盐在矿质颗粒物表面的覆盖层数,m(SO42−)和m(矿质颗粒物)分别为硫酸盐和矿质颗粒物的质量(单位, g),NA为阿伏伽德罗常数(6.02×1023mol−1),M(SO42−)为硫酸根离子的摩尔质量(96 g/mol),ABET为矿质颗粒物的BET 比表面积,A(SO42−)表示1 个硫酸根离子的截面积(假设其近似等同于1 个吸附水的截面积1×10−15cm2)[2]。SO2或SO2和NO2共存时与针铁矿非均相反应m(SO42−)/m(针铁矿)最大值分别为(7.88±0.41)×10−3和(6.59±1.71)×10−3, 由计算可知, 反应生成的硫酸盐在针铁矿表面的最大覆盖密度分别为(4.42±0.23)×1014cm−2和(4.81±1.90)× 1014cm−2, 覆盖层数分别为(0.44±0.02)和(0.48±0.09), 均不足1 个分子单层, 这表明SO2以及SO2和NO2共存时与针铁矿非均相反应对硫酸盐的贡献比较有限。
2.2 磁铁矿和赤铁矿的非均相反应
不同湿度条件下, SO2与磁铁矿或赤铁矿非均相反应24 h 后均无硫酸盐生成; SO2和NO2共存时反应24 h 也几乎无硫酸盐生成, 只有少量硝酸盐生成。图4a 为SO2、NO2共存时与磁铁矿反应后硝酸盐生成量, 随着相对湿度的增加, 硝酸盐生成量呈显著增加趋势; 当相对湿度增加至90%时, 硝酸盐生成量达到最大(0.16±0.01)%, 这表明高相对湿度更有助于NO2的非均相氧化过程。与NO2和磁铁矿反应相比[21], SO2和NO2共存时硝酸盐的生成量明显减少, 这表明SO2的共存抑制了硝酸盐的生成, 这一结果与文献报道中的结果具有良好的一致性[32,42]。SO2和NO2共存时与赤铁矿非均相反应后硝酸盐的生成量如图4b 所示, 相对湿度的变化对硝酸盐生成量几乎无影响, 反应24 h 后硝酸盐生成量平均为(0.12±0.03)%。与NO2和赤铁矿反应结果相比, SO2共存对硝酸盐生成无显著影响。
2.3 非均相反应对水溶性铁的影响
本研究中, Fe 元素的水溶性(iron solubility)定义为水溶性铁的质量在总铁质量中的占比。在定量反应所生成的水溶性铁之前, 首先定量了未反应3 种样品膜中水溶性铁含量。分析结果表明, 未反应针铁矿、磁铁矿和赤铁矿中水溶性铁的浓度依次为(17.18±1.55) μg/L、(3.05±1.61) μg/L 和(0.02±0.41) μg/L, 其中未反应赤铁矿中的水溶性铁浓度远远低于检测限1 μg/L。计算得到未反应针铁矿、磁铁矿和赤铁矿样品中Fe 元素水溶性分别为(9.16±0.47)×10−5、(1.80±1.06)×10−5和(0.01±0.23)×10−5。
图5a 为SO2与针铁矿非均相反应24 h 对Fe 元素水溶性的影响, 反应只有少量水溶性铁生成, Fe元素水溶性的增加值小于1×10−4; 相对湿度的变化对水溶性铁生成几乎无影响。Cartledgeet al.[17]开展了14.29 μg/L SO2与针铁矿在相对湿度为23%和98%下的非均相反应研究, 结果表明, SO2与针铁矿非均相反应24 h 对水溶性铁生成非常有限, 相对湿度的变化对Fe 元素水溶性几乎无影响, 相关结果与本研究较为吻合。本工作进一步探究了不同相对湿度以及不同反应时间条件下SO2、NO2共存与针铁矿非均相反应对Fe 元素水溶性的影响, 结果如图5b所示。SO2、NO2与针铁矿非均相反应只有少量水溶性铁生成, 但Fe 元素水溶性的增加值小于5×10−4; 相对湿度和反应时间的变化对水溶性铁的含量几乎无影响。
SO2和磁铁矿非均相反应24 h 无水溶性铁生成, 而SO2、NO2共存时与磁铁矿反应24 h, 仅在相对湿度为90%条件下生成了少量水溶性铁, 且Fe 元素水溶性增加值仅为(9.16±0.47)×10−5。赤铁矿非均相反应对Fe 元素水溶性的影响如图5c 和图5d。Fe 元素水溶性的增加值均小于1×10−5, 比针铁矿反应低1个数量级; 此外, 相对湿度的变化对Fe 元素水溶性无影响。这表明SO2或SO2、NO2共存时与赤铁矿的非均相反应对Fe 元素水溶性的影响极其微弱。该研究结果与Cartledgeet al.[17]结果具有良好的一致性。发生非均相反应后样品中Fe 元素的水溶性均较低, 与未反应样品中相比, 二者相差较小甚至在某些条件下接近, 故图5 中的不确定度较大。
3 结 论
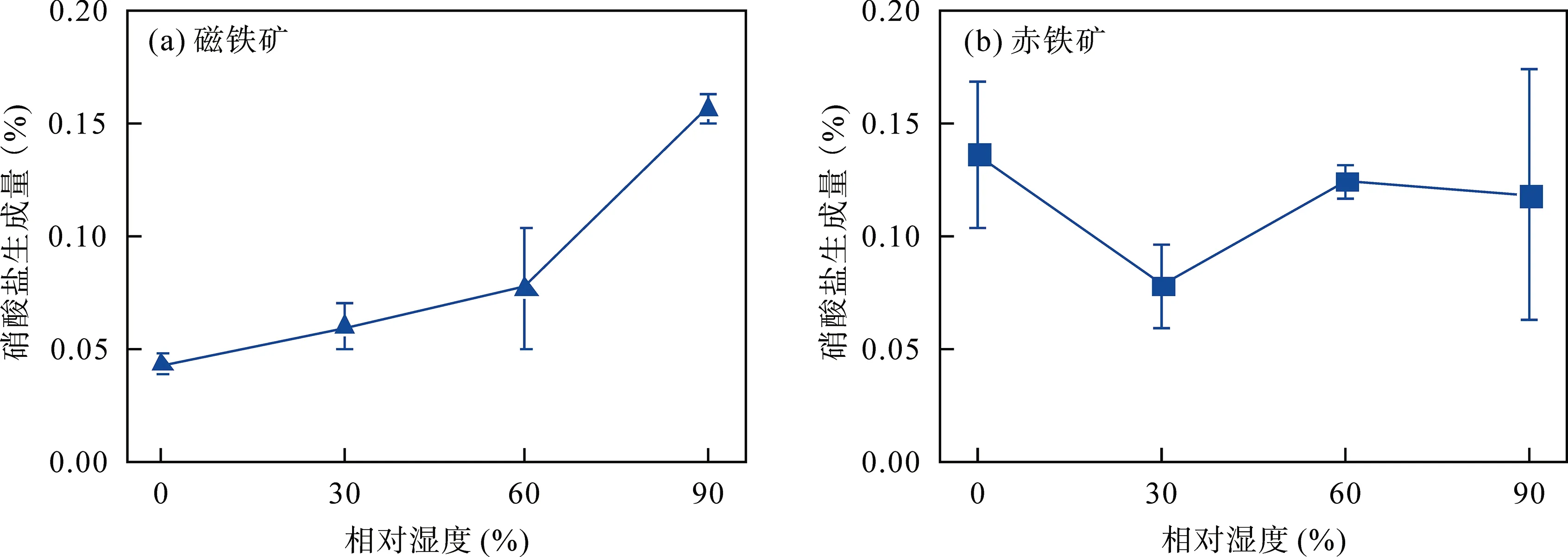
图4 不同相对湿度(0%、30%、60%和90%)条件下, SO2、NO2 与磁铁矿、赤铁矿非均相反应24 h 硝酸盐的生成量 Fig.4 Nitrate formation in heterogeneous reaction of magnetite and hematite with SO2 and NO2 at 0%, 30%, 60%, and 90% relative humidity for 24 h
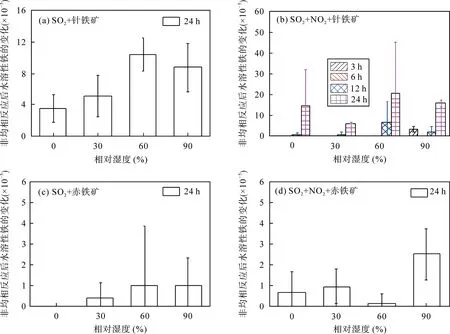
图5 非均相反应后水溶性铁的变化 Fig.5 Changes in iron fractional solubility due to heterogeneous reaction
(1) 对针铁矿而言, SO2或SO2、NO2共存时与针 铁矿反应24 h 均未达到饱和, 相对湿度的增加明显促进硫酸盐和硝酸盐的生成。NO2的存在对SO2和针铁矿非均相反应硫酸盐生成无影响, 而SO2存在条件下对硝酸盐的生成有明显抑制作用。SO2或SO2和NO2共存时针铁矿非均相反应SO2的平均反应摄取系数均小于1×10−8。
(2) 对于磁铁矿和赤铁矿而言, SO2或SO2和NO2共存时非均相反应几乎无硫酸盐生成, 仅在SO2和NO2共存时有极少量硝酸盐生成。对于3 种含铁矿物, 针铁矿反应性最强, 但硫酸盐的最大生成量不足0.80%。因此, SO2与含铁矿物非均相反应对硫酸盐贡献比较有限。
(3) SO2与3 种含铁矿物的非均相反应对Fe 元素水溶性的贡献均小于1×10−4, 几乎可忽略不计。目前关于非均相反应对Fe 元素水溶性影响的研究集中于简单的含铁矿物, 对于成分更为复杂的黏土矿物和实际沙尘的研究还处于空白阶段。此外, 大气中不同氧化剂(如O3、H2O2和HONO 等)、共存组分(如硝酸盐)、光照以及温度等可能会影响SO2的非均相反应氧化程度, 因此不同反应条件对非均相反应以及Fe 元素水溶性的贡献还有待进一步详细探究。
特别感谢两位审稿专家对本文提出的建设性的修改意见及建议。
