利用Tet-On系统构建稳定表达Pdx1的小鼠ESC细胞株*
2021-02-05夏忠胜倪楚燕黎洁瑶陈其奎
钟 娃, 夏忠胜, 于 涛, 倪楚燕, 黎洁瑶, 陈其奎
(中山大学孙逸仙纪念医院消化内科,广东广州510120)
胰腺干细胞属于未分化细胞,具备分化为胰腺内分泌细胞、腺泡细胞和导管细胞的潜能,可以表达干细胞的一些分子标志,但尚未发现其特异性分子标志[1]。近年来研究认为,胰十二指肠同源异形框1(pancreatic and duodenal homeobox 1,Pdx1)是胰腺干细胞分子标志之一。Pdx1 是胰腺发育早期、β 细胞分化及成熟胰岛细胞中重要的转录因子[2]。Pdx1可以诱导内胚层向胰腺定向发育和成熟,其活化可促进胰岛素、生长抑素、葡萄糖激酶、葡萄糖转运因子2 和胰岛淀粉样多肽等细胞重要基因的表达[3]。在胚胎发育早期,敲除Pdx1后导致小鼠胰腺发育不良[4]。在胚胎发育晚期,敲除Pdx1将影响 β 细胞的成熟,使小鼠糖耐量异常、血糖升高[5]。因此,Pdx1+细胞可以认为是胰腺的前体细胞。本研究采用Tet-On 系统构建稳定表达Pdx1的小鼠胚胎干细胞(embryonic stem cell,ESC)株,实现Pdx1基因的定时、定点和定量表达,为下一步通过调控表达Pdx1诱导胰腺前体细胞分化奠定了基础。
材 料 和 方 法
1 材料
1.1 细胞 小鼠ESC 名称:ES-E14TG2a;小鼠品系:129/Ola,购于 American Type Culture Collection(ATCC)。
1.2 主要试剂及仪器 DMEM 培养基(Gibco BRL);胎牛血清(fetal bovine serum,FBS)购于Biochrom;白血症抑制因子(leukemia inhitory factor,LIF)购于Millipore;限制性内切酶(NEB);In-Fusion™PCR Cloning Kit(Clontech);Taq polymerase(Sino-Bio);Lipofectamine 2000、目的基因引物和 Trizol(Invitrogen);293T 细胞、嘌呤霉素、强力霉素和大肠杆菌菌株DH5α(吉凯基因公司);PrimeScriptTMRTPCR Kit 和 SYBR®Premix Ex Taq™ Ⅱ(TaKaRa);小鼠抗小鼠Pdx1 单克隆抗体(R&D);Annexin V-FITC/PI 试剂盒(Becton Dickinson);RNA 引物(上海生工生物技术有限公司);羊抗兔IgG、兔抗小鼠IgG 和兔抗小鼠GAPDH 单克隆抗体(CST)。流式细胞仪(BD Biosciences);LightCycler 480 荧 光 定 量 PCR 仪(Roche);荧光显微镜(Olympus)。
2 方法
2.1 小鼠胚胎干细胞的培养 小鼠ESC 在无饲养层细胞中贴壁培养,以高糖DMEM 为基础培养基,添加10% FBS、0.12%碳酸氢钠、0.1 mmol/L 非必需氨基酸、10 mmol/L HEPES、0.1 mmol/L β-巯基乙醇、1×105U/L 青霉素、100 mg/L 链霉素和 1×107U/L LIF,放在37℃、5% CO2的细胞培养箱内,每天观察并换液,2~3 d传代1次[6]。
2.2 采用Tet-On 系统构建具有绿色荧光蛋白标记及嘌呤霉素抗性的Pdx1过表达慢病毒载体 基因名称:Pdx1(NM_008814),载体名称:GV347(图1)。元件顺序:TetIIP-MCS-EGFP-3FLAG-Ubi-TetR-IRESPuromycin,克隆位点是AgeI/AgeI。首先,化学合成目的基因Pdx1序列,用AgeI/AgeI 酶切化学合成的含有Pdx1的质粒;其次,通过将PCR 产物连接入线性化表达载体从而构建Pdx1重组质粒,转染293T细胞,荧光显微镜观察细胞内绿色荧光蛋白(green fluorescent protein,GFP)的表达,Western blot 检测Pdx1蛋白的表达;最后,将编码慢病毒颗粒的重组病毒质粒及其两种辅助包装元件载体质粒,按Lipofectamine 2000 使用说明共转染293T 细胞,收集富含慢病毒颗粒的细胞上清液,在293T 细胞中测定并标定病毒滴度。

Figure 1.The lentiviral vector GV347.图1 病毒载体GV347
2.3 慢病毒转染ESC 实验分为空白对照组(ESC组)、空载慢病毒对照组(PDX1-ESC 组)和Pdx1慢病毒转染组(PDX1+ESC 组)。将1×105个胚胎干细胞接种于6 孔板培养板中,培养16 h 后细胞融合度达20%~30%时用于转染。换无血清培养基,加终浓度为 5 mg/L 的 polybrene,加入滴度为 1×1012TU/L 的病毒6 μL,总体积为1 mL。转染后12 h 更换为含10% FBS 的培养基2 mL,每日换液。转染后48 h,按 1∶4~1∶6 传代,次日换液,加入嘌呤霉素至终浓度为800 μg/L。筛选2 d 后,换无嘌呤霉素的培养基培养细胞至密度大于80%时,按1∶4~1∶6 传代至6孔板中。
2.4 流式细胞术检测转染细胞阳性率以及稳定表达Pdx1的ESC 株和阴性对照ESC 株的构建 取ESC组及2 mg/L 多西环素(doxycycline,DOX)诱导24 h后的 PDX1-ESC 组和 PDX1+ESC 组细胞,PBS 清洗,消化、中和、离心后取5×105个细胞,再离心、去上清,用200 μL PBS 将细胞重悬成单细胞悬液,上机检测细胞转染率。按上述方法调整细胞密度为1×1010/L,用流式分选仪分选PDX1-ESC 组和PDX1+ESC 组GFP+细胞,ESC 组细胞作为对照。分选后的阳性细胞立即进行离心、去上清,接种至6 孔板中培养,时间定义为d0。d1 加入终浓度为800 μg/L 的嘌呤霉素,每天换液。d3 可见抗性克隆。用胰酶在单克隆附近消化干净,用10 μL 的枪头挑取单克隆,放入96孔板培养。24 h 后加入终浓度为400 μg/L 的嘌呤霉素,维持筛选出单克隆,再逐渐转入24孔板-12孔板-6孔板培养,逐渐扩增起来,建立稳定转染的细胞株。经扩增、传代、液氮灌冻存,为下一步实验备用。
2.5 荧光显微镜下观察GFP 的表达 ESC 组、PDX1-ESC 组和PDX1+ESC 组细胞分别接种至6 孔板中,每组接种2孔,24 h后其中一孔加DOX 至终浓度为2 mg/L。24 h后在荧光显微镜下观察。
2.6 RT-qPCR 检测 Pdx1 的 mRNA 表达 Trizol试剂提取细胞的总RNA,逆转录成cDNA,再进行扩增。PCR 扩增体系为:SYBR Premix Ex Taq(2×)10 μL,Pdx1 上、下游引物(序列见表1)各0.4 μL,cDNA 2 μL,加单蒸水7.2 μL 至总体积20 μL。扩增条件为:95℃ 30 s;95℃ 5 s,60℃ 20 s,40个循环。用2-ΔΔCt法计算mRNA的相对表达量。

表1 RT-qPCR的引物序列Table 1.The sequences of the primers for RT-qPCR
2.7 Western blot 检测Pdx1 融合蛋白的表达 收取细胞加入RIPA 缓冲液提取总蛋白。采用BCA 蛋白检测试剂盒测定蛋白质含量。蛋白质经SDS-PAGE分离后转移到PVDF膜上。用1∶1 000稀释的小鼠抗小鼠单克隆Pdx1 抗体在4℃孵育过夜。洗膜3 次后,孵育1∶1 000 稀释的兔抗小鼠IgG,室温1 h。以βactin 作为内参照,进行各目的条带灰度的半定量分析,条带的灰度分析采用ImageJ 软件。实验重复3次。
2.8 稳定转染细胞株的冻存 当转染后的ESC 扩增到密度为70%~80%时进行冻存。弃去旧液,经清洗、消化、中和,用吸管吹打后把细胞悬液转移至离心管中,离心后弃上清,加入冻存液重悬细胞,细胞浓度约为(1.0~1.2)×1010/L。把细胞悬液转移至冻存管中,于4℃放置30 min,再转至-30℃放置30 min,然后转至-80℃过夜,第2天转移至液氮罐中保存。
3 统计学处理
采用SPSS 17.0 软件进行统计分析。计量资料用均数±标准差(mean±SD)表示。两组间的比较采用t检验;多组间的比较采用方差分析后,进一步采用Bonferroni 校正的t检验进行各组均数间两两比较。以P<0.05为差异有统计学意义。
结 果
1 细胞流式术检测结果
转染细胞用嘌呤霉素筛选2 d 后,PDX1-ESC 组阳性率为90.72%,PDX1+ESC 组阳性率为94.01%(图2)。用流式细胞分选仪分选后,PDX1-ESC组的阳性率为97.84%,PDX1+ESC 组的阳性率为98.13%(图3)。
2 荧光显微镜下观察
不加 DOX 时,ESC 组、PDX1-ESC 组和 PDX1+ESC组均未见绿色荧光细胞;加DOX后,ESC组未见绿色荧光细胞,PDX1-ESC 组和PDX1+ESC 组均可见绿色荧光细胞(图4)。
3 Pdx1的mRNA表达
加 DOX 后 ESC 组 和 PDX1-ESC 组 Pdx1 mRNA相对表达量的差异无统计学显著性(P>0.05),而PDX1+ESC 组的 Pdx1 mRNA 水平 显 著增高(P<0.05);不加 DOX,则 3 组 Pdx1 mRNA 相对表达量的差异无统计学显著性(P>0.05);组内比较,加DOX前后 ESC 组和 PDX1-ESC 组内 Pdx1 mRNA 表达量的差异无统计学显著性(P>0.05),而PDX1+ESC 组加DOX 后Pdx1 mRNA 表达量显著增高,差异有统计学意义(P<0.05),见图5。
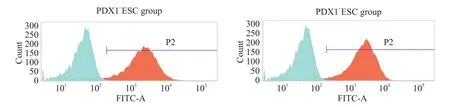
Figure 2.The transfection efficiency of lentiviral vectors determined by flow cytometry.The blue wave crest represented negative control cells,and red wave crest represented positive transfection cells.图2 流式细胞术检测转染细胞的比例
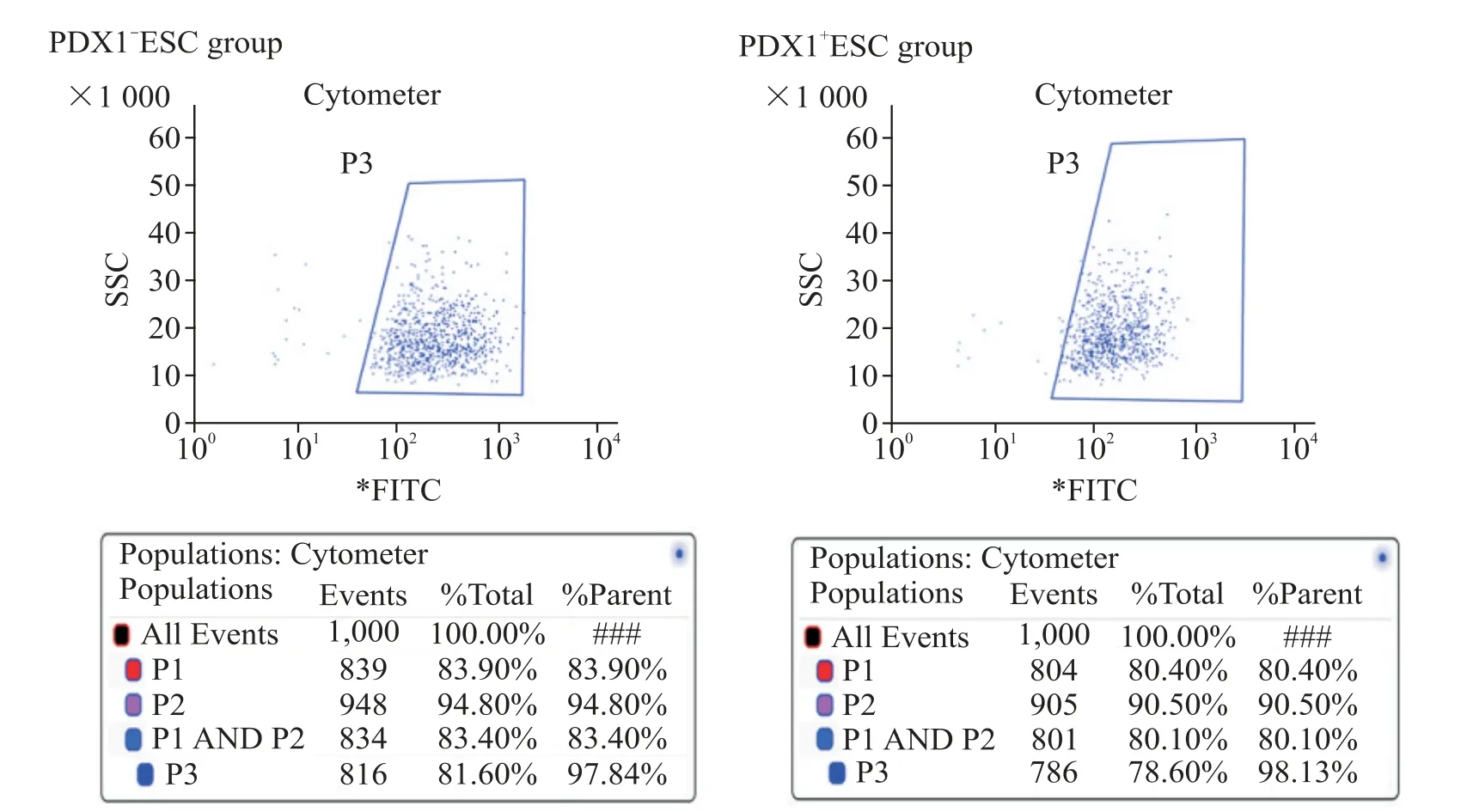
Figure 3.The positive cells were selected and exhibited in blue frame by flow cytometry.图3 流式细胞术筛选阳性细胞
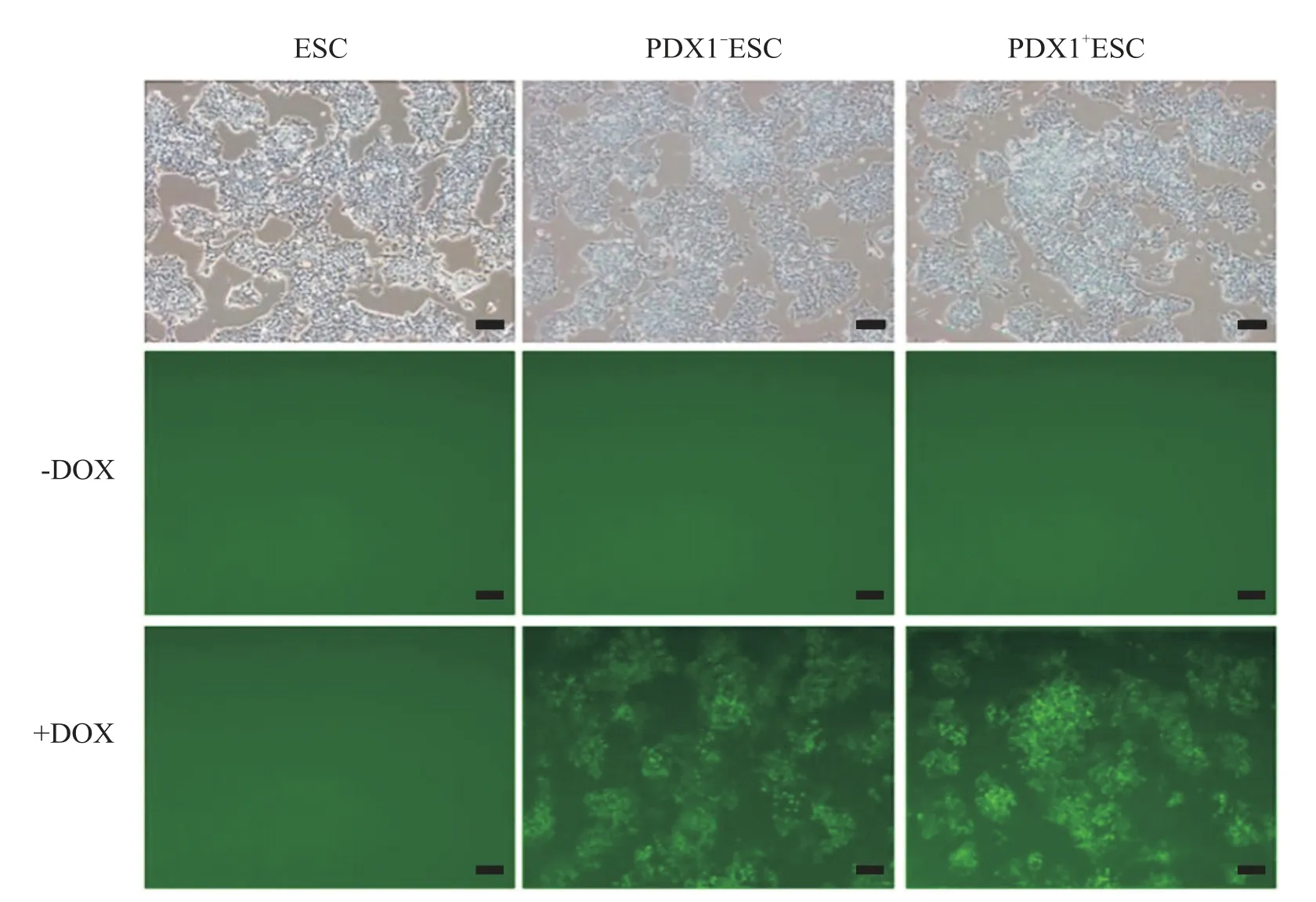
Figure 4.Expression of green fluorescent protein was induced by activating the Tet-On system.The scale bar=100 μm.图4 启动Tet-on系统诱导增强绿色荧光蛋白的表达

Figure 5.The mRNA expression of Pdx1 was induced by activating the Tet-On system.Mean±SD. n=3.*P<0.05 vs PDX1+ESC+DOX group.图5 启动Tet-on系统诱导Pdx1 mRNA的表达
4 Pdx1蛋白的表达
加 DOX 后 ESC 组 和 PDX1-ESC 组 Pdx1 蛋 白 的表达差异无统计学显著性(P>0.05),而PDX1+ESC组的Pdx1 蛋白水平明显增高(P<0.05),在46 kD 见Pdx1蛋白表达外,在75 kD左右见Pdx1与EGFP融合蛋白表达;不加DOX,则3组Pdx1蛋白表达的差异无统计学显著性(P>0.05);组内比较,加 DOX 前后ESC 组和PDX1-ESC 组内Pdx1 蛋白表达的差异无统计学显著性(P>0.05),而 PDX1+ESC 组加 DOX 后Pdx1 蛋白表达量显著增高,差异有统计学意义(P<0.05),见图6。
5 稳定转染株的活性及调控
3 个月后,从液氮灌取出稳定转染细胞株,复苏后培养,细胞仍然存活,并受DOX调控。
讨 论
Iwashita等[7]发现Pdx1过表达导致胰岛相关基因的表达增强。研究表明[8],上调Ptf1α和Pdx1可以确定胰腺发育的方向,促进胰腺组织的分化;相反,下调Pdx1启动子活性,将诱导内胚层向肠道上皮的方向分化。在定型内胚层表达Pdx1基因是定型内胚层向胰腺细胞方向分化的前提。所以,定型内胚层表达Pdx1 的细胞又称为胰腺前体细胞。为了能够分化获得尽可能多的胰腺样细胞,以满足细胞移植的需要,上调Pdx1基因在定型内胚层的表达,让更多的定型内胚层细胞表达Pdx1基因,是非常关键的一步。

Figure 6.The protein expression of Pdx1 was induced by activating the Tet-On system.Mean±SD. n=3.*P<0.05 vs PDX1+ESC+DOX group.图6 启动Tet-on系统诱导Pdx1蛋白的表达
Gossen 等[9-10]在 1995 年提出四环素基因表达调节系统(Tet-On 系统)。在Tet-On 基因表达系统中,当四环素或强力霉素增加时,外源基因表达逐渐增加,正向调节基因的表达,而且,Tet-On 基因表达系统只对四环素或强力霉素反应,是一个严密、高效的反应系统,同时也是目前广泛使用的条件性基因表达调控系统,它可以人为地控制目的基因在靶细胞里按需表达。Tet-On 系统已经运用多年,并且得到了不断的完善,构建技术成熟。该系统的使用,对目的基因的调控更加便利。钟女奇等[11]报道建立了表达Tet-On 的人肝癌细胞模型,为研究任何感兴趣的目的基因的调控打下了基础。在Tet-On 调控系统中,目的基因表达的量与DOX 的诱导浓度有关。通过控制DOX 的诱导浓度可以对目的基因实现定量表达。有研究认为,DOX 的浓度在0~10 mg/L 范围中,诱导浓度与目的基因表达的量成正相关,DOX 的诱导浓度越高,目的基因表达的量就越大[12]。但不同的细胞对DOX 浓度的承受能力是不同的。有研究[13]用浓度为 1 mg/L 的 DOX 诱导目的基因在胚胎干细胞中的表达。D′Alessandro 等[14]用 2.5 mg/L 的DOX 诱导目的基因在肿瘤细胞中表达。我们在预实验中曾试用3 mg/L 的DOX 诱导Pdx1在胚胎干细胞中的表达,结果细胞状态差,大部分死亡。通过不同浓度的尝试,最后用DOX 终浓度为2 mg/L 诱导Pdx1的表达,细胞保持良好的增殖状态。在Tet-On 调控系统中,目的基因表达的量与DOX 的诱导时间亦有关系。Kumar 等[12]加入 DOX 后 0~24 h 诱导目的基因表达,发现随着诱导时间的延长,目的基因表达的量增加。本实验中,我们采用DOX 诱导24 h 上调Pdx1表达。我们可以通过嘌呤霉素对感染的细胞进行筛选,筛选出成功转染Pdx1基因的具有嘌呤霉素抗性的细胞。在筛选实验前,我们先对未转染的胚胎干细胞进行预实验。用终浓度分别为100 μg/L、200 μg/L、300 μg/L、400 μg/L、500 μg/L、600 μg/L、700 μg/L、800 μg/L 和900 μg/L 的嘌呤霉素培养胚胎干细胞,2 天后,嘌呤霉素终浓度为 800 μg/L 培养的细胞,有大于80%的胚胎干细胞死亡,该浓度为嘌呤霉素的最佳筛选浓度。本实验,我们构建单质粒模式的、具有绿色荧光蛋白标记及嘌呤霉素抗性的Tet-On调控系统Pdx1过表达慢病毒载体,并且感染胚胎干细胞。在荧光显微镜下观察,加DOX 后,ESC组未见绿色荧光细胞,PDX1-ESC 组和PDX1+ESC 组均可见绿色荧光细胞;不加DOX,3 组均未见绿色荧光细胞。目的基因Pdx1位于荧光基因的上游,说明加DOX 可以诱导Tet-On 系统荧光蛋白和Pdx1的表达。RT-qPCR 和 Western blot 的 结果 发现 ,加 DOX 后 ,PDX1+ESC组Pdx1的mRNA和蛋白表达明显升高;不加DOX,3 组间 Pdx1 的 mRNA 和蛋白表达的差异无统计学显著性,提示本研究构建的Tet-On 调控系统Pdx1过表达慢病毒载体受DOX 调控,调控正常。稳定转染株经扩增、传代,液氮灌冻存3 月后,取出冻存的稳定转染株,复苏培养,细胞仍然存活,并受DOX 调控。结果说明,稳定转染株构建成功。周光纪等[15]报道成功构建Pdx1基因真核表达载体质粒并且在胚胎干细胞中表达。我们进一步利用Tet-On系统构建了稳定表达Pdx1的小鼠ESC 株,为下一步研究的实施提供了便利。
我们构建的单质粒模式的Tet-On调控系统Pdx1过表达慢病毒载体,不仅操作简单,而且运用Tet-On调控系统调控Pdx1在定型内胚层的表达,实现了对Pdx1定时、定点、定量的调控,为进一步研究定型内胚层向胰腺细胞分化奠定了基础。
