大气颗粒物急性暴露对C57BL/6小鼠肺脏病理改变和气道上皮细胞IL-6和IL-8表达的影响*
2021-02-05王强,董年
王 强, 董 年
(温州医科大学附属第一医院呼吸与危重症医学科,浙江温州325000)
伴随着不断推进的工业化、城市化的进程,日益严重的空气污染是我国目前严重危害健康的公共卫生问题[1]。大气颗粒物(particulate matter,PM)是空气污染物中的重要成分,根据空气动力学直径又可划分为粗颗粒物(PM10)、细颗粒物(PM2.5)和超细颗粒物(PM0.1)。PM 可以随呼吸运动广泛沉积在肺脏,与肺部疾病的发生发展密切相关[2-3]。气道上皮是PM 进入肺脏后的第一道防线,目前认识到气道上皮不仅是肺脏结构细胞,而且扮演了启动细胞和继发受体的角色[4-5]。受限于难以直接获取PM 急性暴露的人体肺脏标本,目前PM 暴露气道炎症反应的分子机制尚未完全阐明。本研究拟采用PM 急性暴露的小鼠模型,观察肺脏的病理改变和炎症介质白细胞介素6(interlukin-6,IL-6)和白细胞介素8(interlukin-8,IL-8)的分泌。已知IL-6 和 IL-8 是常见的趋化因子,具有趋化中性粒细胞、级联扩大炎症反应、引发肺部疾病的作用[6-7]。不同于既往主要聚焦免疫细胞来源的IL-6 和IL-8,本研究拟在小鼠肺脏病理改变的基础上,采取肺脏固有结构细胞气道上皮细胞来研究PM诱导IL-6和IL-8的分子机制。
材 料 和 方 法
1 材料
6~8 周 SPF 级雄性 C57BL/6 小鼠(20~22 g)购自北京维通利华实验动物技术公司,许可证号为SXCK(京)2016-0011。人正常气道上皮细胞系BEAS-2B购自上海中科院细胞库。PM 购自NIST;RPMI-1640培养液和胎牛血清购自Gibco;兔抗人p-Akt和Akt抗体购自 CST;兔抗人 GAPDH 抗体购自 Santa Cruz;PI3K抑制剂LY294002 购自Sigma;BCA 蛋白浓度测定试剂盒、预染蛋白Marker和ECL发光液购自Thermo。
2 方法
2.1 动 物 模 型 选 取 20 只 6~8 周 SPF 级 雄 性C57BL/6 小鼠(20~22 g),均腹腔注射 10 mL/kg 的水合氯醛麻醉,随机分为 2 组(n=10):(1)空白对照(vehicle)组:PBS 25 μL 气道滴注,连续气道滴注2 d;(2)PM 实验组:4 g/L PM 悬浮液25 μL 气道滴注,连续气道滴注2 d。空白对照组和PM 实验组在末次气道滴注24 h 后处死小鼠获取动物标本进行后续实验。
2.2 细胞模型 BEAS-2B 细胞使用含10%胎牛血清和1%青霉素/链霉素的RPMI-1640 培养液,置于37℃、5% CO2恒温培养箱中培养。使用0.25%胰酶溶液进行消化传代,获取生长状况良好的对数生长期细胞。具体实验分组如下:(1)200 mg/L 的PM 刺激 BEAS-2B 细胞 3、6、12 和 24 h,检测 IL-6 和 IL-8 的mRNA 变化;(2)25、50、100、200 和 400 mg/L 的 PM刺激 BEAS-2B 细胞 24 h,检测 IL-6 和 IL-8 的蛋白变化;(3)200 mg/L 的 PM 刺激 BESA-2B 细胞 5、10 和15 min,检测PI3K 信号通路相关蛋白的变化;(4)预先给予 5 μmol/L PI3K 抑制剂 LY294002 干预 0.5 h,200 mg/L 的 PM 刺激 BESA-2B 细胞 15 min,检测 PI3K信号通路相关蛋白的变化。
2.3 ELISA 实验 获取小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)或细胞培养上清,4℃、1 000 r/min 离心后获取上清液,ELISA 板中添加标准品和检测样品,37℃培养箱孵育2 h后移除ELISA 板每孔中的液体,添加100 μL 的生物素抗体在37℃培养箱孵育1 h,再次洗涤去液体添加HRP-抗生物素蛋白,37℃培养箱孵育1 h,重复洗涤过程5次,然后显色和终止,利用酶标仪计算每孔吸光度(A)值,根据标准曲线计算每孔检测样品的浓度。
2.4 Western blot 实验 获取生长状况良好的对数生长期的BEAS-2B 细胞,不同实验干预之后获取细胞,细胞裂解液裂解细胞,4℃、20 913×g离心10 min提取上清液,使用BCA 测定蛋白浓度。两组细胞分别取 30 μg 蛋白进行 SDS-PAGE,湿转至 PVDF 膜,5%脱脂牛奶室温下封闭2 h,Ⅰ抗(1∶1 000)4℃孵育过夜,TBST 缓冲液洗膜10 min×3 次,Ⅱ抗(1∶5 000)室温孵育 1.5 h,再用 TBST 缓冲液洗膜 10 min×3 次,化学发光法显影条带。
2.5 real-time PCR 实验 获取生长状况良好的对数生长期的BEAS-2B 细胞,不同实验干预之后获取细胞,按照Trizol 说明书提取细胞总RNA,分光光度法测定提取的总RNA 浓度。取总RNA 2 μg 反转录为cDNA,再以适量cDNA 为模板进行Real-time PCR实验。反应条件为:95℃ 30 s;95℃ 5 s,60℃ 30 s,总共 40 个循环。以 GAPDH 为内参照,数据以 2-ΔΔCt计算。引物序列见表1。
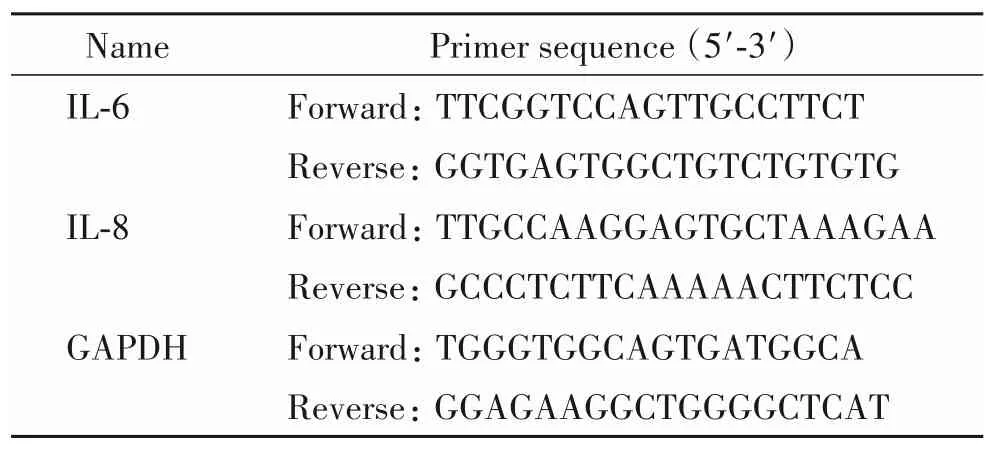
表1 real-time PCR引物序列Table 1.The sequences of the primers for real-time PCR
2.6 HE 染色、过碘酸-希夫(periodic acid-Schiff,PAS)染色及病理分级 造模成功之后处死动物,经气管插管灌注多聚甲醛填充肺脏,获取完整的肺脏置于多聚甲醛中固定,随后进行石蜡包埋,获得肺组织切片。(1)HE染色:切片依次使用二甲苯Ⅰ、Ⅱ,乙醇行脱蜡、水化处理后,苏木素染液中浸泡染色,分别浸泡在盐酸酒精,PBS 中分化、反蓝,使用用伊红染色后脱水封片。(2)PAS 染色:切片脱蜡水化并用高碘酸酒精溶液浸泡,置雪夫染液中室温染色用亚硫酸溶液,蒸馏水冲洗待干,用甲绿复染,盐酸酒精分化后脱水封片。(3)病理分级:在光学显微镜下评分,以0~3 的主观等级评估支气管周围和血管周围的炎症程度[0 分:未观察到炎症时;1 分:偶见炎症细胞;2 分:气道或血管周围不均匀分布的炎症细胞或炎症细胞围绕成薄的环状(层厚1~5 个炎症细胞);3 分:气道或血管周围分布均匀的炎症细胞或炎症细胞围绕成厚的环状(层厚>5个炎症细胞)][8]。
3 统计学处理
使用SPSS 20.0 软件进行统计分析。数据均以均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用 Bonferroni 校正的t检验。以P<0.05 为差异存在统计学意义。
结 果
1 气道滴注PM 可诱导C57BL/6 小鼠以气道炎症为主的肺组织病理改变和BALF 中IL-6 和IL-8 的分泌
针对C57BL/6 小鼠肺组织进行病理分级评分,PM 实验组小鼠肺组织气道周围炎症细胞浸润,气道上皮细胞变厚,伴随PM 在气道内的沉积,PM 实验组PAS 染色阳性,病理分级显著升高(P<0.01),见图1A、B。ELISA 结果显示,PM 实验组 C57BL/6 小鼠BALF 中炎症介质IL-6和IL-8显著升高(P<0.01),见图1C、D。
2 PM 刺激可诱导气道上皮细胞中IL-6 和IL-8 mRNA和蛋白水平的变化
使用 200 mg/L 的 PM 刺激 BEAS-2B 细胞 3、6、12和24 h,real-time PCR 显示该细胞中IL-6 和IL-8 mRNA 水平升高,在3 h 达到高峰(P<0.01),之后呈时间依赖性降低,见图2A、B。使用25、50、100、200和 400 mg/L 的 PM 刺激 BEAS-2B 细胞 24 h,ELISA 结果显示IL-6 和IL-8 分泌水平显著升高,在200 mg/L PM 刺激下达到高峰(P<0.01),在25~200 mg/L 之间呈浓度依赖性升高,见图2C、D。
3 PM 刺激对气道上皮细胞PI3K 信号通路的活化和PI3K抑制剂在其中的阻断作用
使用 200 mg/L 的 PM 刺激 BESA-2B 细胞 5、10 和15 min,Western blot 结果显示,PM 可诱导 Akt 蛋白磷酸化水平显著升高,且呈现时间依赖性,在15 min达到最高(P<0.01),见图3A。预先给予PI3K 抑制剂干预,Western blot 结果显示,PM+LY294002 组p-Akt蛋白水平较PM组显著降低(P<0.05),见图3B。
4 抑制PI3K 信号通路可部分逆转PM 诱导的气道上皮细胞IL-6和IL-8分泌
预先给予PI3K 抑制剂LY294002 干预,然后使用 200 mg/L PM 刺激 BEAS-2B 细胞 24 h,ELISA 结果显示,PI3K 抑制剂可部分逆转PM 诱导的IL-6 和IL-8 分泌,PM+LY294002 组 IL-6 和 IL-8 的分泌水平较PM组显著降低(P<0.01),见图4。
讨 论
空气污染是我国目前严重危害健康的公共卫生问题,作为空气污染物中固态颗粒状物质和液态颗粒状物质的总称,大气PM 是近年来公共卫生与预防医学的研究热点[9]。呼吸系统是PM 进入机体的主要途径,由于粒径小、重量轻和比表面积大,PM可以随呼吸气流广泛沉积于气道或肺泡[10]。流行病学调查揭示,PM 暴露与慢性气道疾病、肺恶性肿瘤等肺部疾病的发生发展密切相关[11]。既往研究过多聚焦PM 持续暴露下的气道重构或肿瘤恶性转化[12],针对PM 急性暴露下肺脏病理生理变化的研究相对缺乏。考虑到PM 急性暴露下肺脏病理生理变化可能存在一定的可逆性,深入研究PM 急性暴露下肺脏的病理变化以寻找潜在的防治靶点具有重要意义。由于临床上难以获得PM 急性暴露的人体肺脏标本,本研究采取PM 连续2 d气道滴注的体内模型以模拟临床上PM 急性暴露,获取小鼠肺脏组织进行HE 染色和PAS 染色,结果显示肺脏组织以气道炎症为主,具体病理改变包括气道PM 沉积、炎症细胞浸润和糖原染色阳性,而并未观察到气道的结构性改变,与Xu等[10]报道的相似。与此同时,针对 C57BL/6 小鼠BALF 中炎症介质IL-6 和IL-8 的检测,结果显示BALF 中 IL-6 和 IL-8 分泌水平升高。已知 IL-6 和 IL-8是重要的炎症介质,可调控中性粒细胞等炎症细胞的募集和活化,在炎症级联扩大反应中发挥重要作用。既往研究认为,在炎症反应中IL-6 和IL-8 主要来源于血液单核-巨噬细胞系统[13]。目前逐渐认识到气道上皮细胞在气道炎症中扮演启动细胞和继发受体的角色,而IL-6 和IL-8 同样可以由气道上皮细胞分泌并参与气道炎症的发生发展。考虑到动物模型中PM 急性暴露主要导致气道炎症为主,没有明显的肺泡损伤,本研究在细胞模型中采取了人气道上皮细胞,以在体外实验中更深层次研究气道上皮细胞的炎症改变。结果显示,PM刺激气道上皮细胞可以诱导IL-6 和IL-8 的分泌表达,我们推测来自气道上皮的IL-6 和IL-8 以旁分泌的形式招募血液中的中性粒细胞等炎症细胞参与气道炎症的发生发展。考虑到PM 急性暴露下气道炎症尚未发生气道重构等变化,炎症损伤具有一定的可逆性,深入研究其中的分子机制和寻找其中的关键靶点可为PM 诱导气道炎症的防治提供参考资料。

Figure 1.Effect of PM exposure on the lungs of C57BL/6 mice.The C57BL/6 mice model was established by intratracheal instillation of PM for 2 consecutive days.A:representative images of lung sections with PAS staining;B:the inflammation scores for images of lung sections;C,D:the levels of IL-6 and IL-8 in the BALF measured by ELISA.Mean±SD. n=10.*P<0.05,**P<0.01 vs vehicle group.图1 气道滴注PM可诱导C57BL/6小鼠以气道炎症为主的肺组织病理改变和BALF中IL-6和IL-8的分泌

Figure 2.PM exposure up-regulated the expression of IL-6 and IL-8.A,B:the relative mRNA levels of IL-6 and IL-8 in the BEAS-2B cells treated with 200 mg/L PM for 3,6,12 and 24 h;C,D:the concentrations of IL-6 and IL-8 in the culture supernatants of the BEAS-2B cells treated with 25,50,100,200 and 400 mg/L PM for 24 h.Mean±SD. n=3.*P<0.05,**P<0.01 vs 0 h or 0 mg/L group.图2 PM刺激可诱导气道上皮细胞IL-6和IL-8 mRNA和蛋白水平的变化

Figure 3.PM exposure induced phosphorylation of PI3K/Akt signaling pathway.A:the protein levels of p-Akt and Akt in the BEAS-2B cells exposed to PM(200 mg/L)for indicated time were measured by Western blot;B:the protein levels of p-Akt and Akt in the BEAS-2B cells exposed to PM with or without PI3K inhibitor LY294002 were measured by Western blot.Mean±SD. n=3.*P<0.05 vs 0 min or vehicle(no treatment)group;#P<0.05 vs PM group.图3 PM刺激对气道上皮细胞PI3K信号通路的活化和PI3K抑制剂在其中的阻断作用

Figure 4.PI3K inhibitor partially reversed the secretion of IL-6(A)and IL-8(B)in the BEAS-2B cells induced by PM.The BEAS-2B cells were pretreated with LY294002,and were subsequently exposed to PM for 24 h.Mean±SD. n=3.**P<0.01 vs vehicle(no treatment)group;##P<0.01 vs PM group.图4 PI3K抑制剂可部分逆转PM诱导的气道上皮细胞IL-6和IL-8分泌
已知PI3K 信号通路与细胞增殖凋亡、炎症反应、肿瘤恶性转化等密切相关,同时PI3K 信号通路的活化在肺部疾病的炎症细胞聚集、炎症介质释放和气血屏障破坏中具有重要作用[14-15]。本研究的细胞实验结果显示,PI3K 抑制剂可部分逆转PM 诱导的气道上皮细胞IL-6 和IL-8 分泌;与此同时,PM 可以诱导气道上皮细胞PI3K 信号通路的活化。以上结果表明,PI3K 信号通路在诱导炎症介质的分泌上发挥调控作用,与报道的PI3K 信号通路参与调控PM 诱导的 COX-2/PGE2表达相似[16]。相较于 PI3K 信号通路,文献报道ERK 和P38等同样介导了PM 诱导的气道上皮细胞炎症介质的分泌过程[17],围绕PI3K、ERK、P38等信号通路之间的联系是后续的重点研究方向。
本研究尚存较多的不足之处:首先,体内实验中使用PM 气道滴注的方法虽然目前被广泛使用,然而PM 气道滴注不能完全反映PM 吸入的病理生理过程,后续的研究中我们正在尝试进行PM 雾化吸入的方法;其次,体外实验中仅仅选取了一个永生化的气道上皮细胞株BEAS-2B,如能分离原代气道上皮细胞则更能反映体内的真实情况;最后,在信号转导方面,我们仅仅是证明了PI3K 信号转导在其中的调控作用,针对PM 如何调控PI3K 信号转导的活化并未深入涉及,以及没有深入验证PI3K 抑制剂在体内实验中的效果。
综上所述,本研究的动物实验揭示了PM 急性暴露下肺脏以气道炎症为主的病理改变,而体外细胞实验揭示了PI3K 信号通路介导PM 诱导气道上皮细胞IL-6 和IL-8 的分泌。本研究从动物和细胞两个层次模拟人群在PM 急性暴露下肺脏的病理生理改变,为阐明PM 诱导气道炎症的分子机制进行了初步的探索。
