基于Nrf2通路探讨阿里红三萜酸减轻脂多糖诱导的小鼠急性肺损伤的作用*
2021-02-05古丽尼歌尔阿布都米吉提沙依拜沙比提丛媛媛帕丽达阿不力孜
古丽尼歌尔·阿布都米吉提, 沙依拜·沙比提, 丛媛媛, 帕丽达·阿不力孜
(新疆医科大学药学院,新疆乌鲁木齐830011)
急性肺损伤(acute lung injury,ALI)以弥漫性肺泡肺间质水肿,难治性低氧血症及非心源性肺水肿为特征[1-2],与体内氧化应激(oxidative stress,OS)及炎症介质升高具有关联性[3]。氧化应激在体内产生大量的活性氧簇(reactive oxygen species,ROS),可引起气道和血管重塑、侵袭肺间质导致肺水肿、对肺实质细胞造成氧化损伤等[4]。研究证实,氧化应激损伤主要建立在ALI 的发生发展过程中[5]。转录因子核因子E2 相关因子2(nuclear factor E2-related factor-2,Nrf2)信号通路是一条保护性转导通路,保护机体抵抗外界氧化应激反应[6]。未受刺激时,Nrf2与Kelch 样环氧氯丙胺相关蛋白1(Kelch-like epichlorohydrin-related protein 1,Keap1)存在细胞质中,当Nrf2受到氧化应激时则与Keap1解离,Nrf2立即进入细胞核,与抗氧化反应元件结合,激活下游基因如抗氧化酶及Ⅱ相激酶的转录,进而表达一系列相关蛋白如血红素加氧酶1(heme oxygenase-1,HO-1)等,发挥抗炎和抗氧化作用[7]。
阿里红为多孔菌科层孔菌属植物苦白蹄的子实体,具有止咳平喘、祛风利湿、消肿止痛的功效,民间常用于治疗肺炎、慢性支气管炎等疾病[8]。研究显示,阿里红的主成分之一三萜酸具有抗炎和抗氧化等药理作用[9],但其是否对ALI具有保护作用鲜少见到报道。因此,本研究通过构建LPS诱导的ALI小鼠模型,探讨FOTa对ALI的作用及机制。
材 料 和 方 法
1 动物
60 只 SPF 级雄性昆明小鼠,6~8 周龄,体重为(20±2)g,购于新疆医科大学动物实验中心,动物生产许可证号:SYXK(新)2018-0003,小鼠饲养于SPF级屏障环境,在室温(20~25℃)和湿度40%~60%的环境下自由摄食饮水。
2 主要试剂
阿里红药材购于自治区维吾尔医院,由新疆医科大学药学院天药/生药教研室帕丽达·阿不力孜教授鉴定为阿里红(Fomes OfficinalsAmes)。地塞米松(dexamethasone,Dex)购自北京索莱宝科技有限公司;脂多糖(lipopolysoccharide,LPS)购自sigma;小鼠丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)ELISA 试剂盒购自上海钰博生物科技有限公司;血气片购自IDEXX;逆转录试剂盒购自赛默飞世尔科技有限公司;TaKaRa试剂盒购自大连宝生物工程有限公司;兔源Keap1、兔源Nrf2 和兔源HO-1 抗体购自Abcam;兔源β-actin购自北京博奥森生物技术有限公司;辣根过氧化物标记的山羊抗兔IgG 购自中杉金桥生物技术有限公司;Keap1、Nrf2、HO-1 和β-actin 所用引物由上海生物工程有限公司根据设计合成,序列见表1。
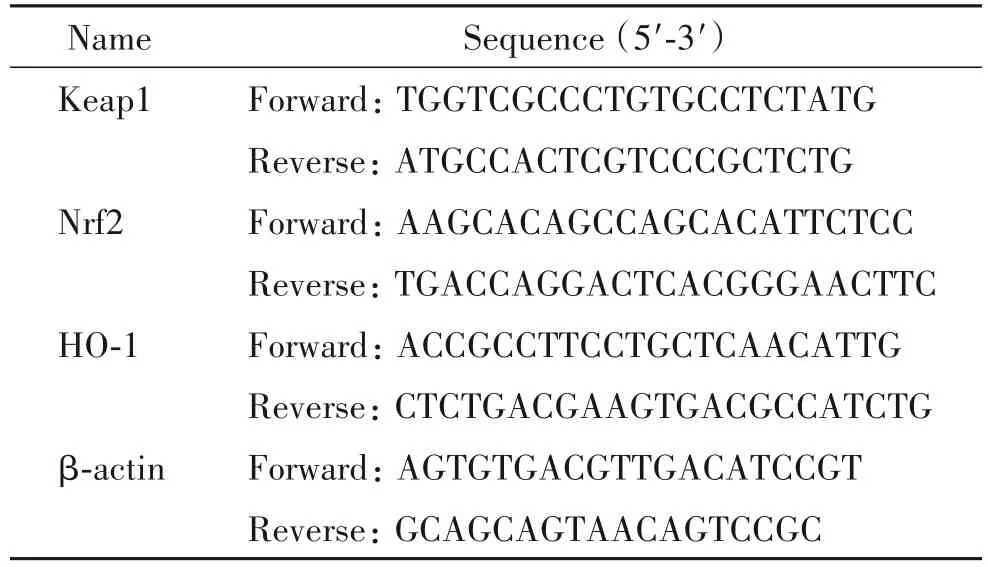
表1 RT-qPCR引物序列Table 1.The sequences of the primers for RT-PCR
3 主要方法
3.1 FOTa 的提取及含量测定 根据参考文献[10]精密称定阿里红生药材粗粉(30 目)约220 g,置圆底烧瓶中,加入95%乙醇2.2 L,称定重量,加热回流2 h,放冷,再称定重量,用乙醇补足减失的重量,过滤,即得。采用紫外-分光光度法进行FOTa 的含量测定,即Y=32.848X+0.0496,R=0.9992,含量为33.5%,得率为15.9%。给药前,按照阿里红药材成人给药剂量[11]与折算系数 W 计算出 70 mg/kg、140 mg/kg 和280 mg/kg 3 个剂量,用氯化钠注射液各配成相应浓度的溶液。
3.2 动物分组及处理 将60 只雄性昆明小鼠按随机数表法分为6 组:对照(control)组、模型[12]组(LPS 5 mg/kg 组)、地塞米松[12]组(Dex 1 mg/kg 组)及FOTa 70 mg/kg、140 mg/kg和280 mg/kg 组,每组10只。FOTa 干预组连续灌胃相应浓度FOTa 4 周,其余组灌胃同等体积生理盐水,末次灌胃生理盐水后,Dex 组腹腔注射1 mg/kg,30 min后除对照组外,其余各组腹腔注射5 mg/kg LPS 进行造模。造模成功条件以处理动物当天PaO2/FiO2值与造模前后体重变化值来确定,即 PaO2:FiO2<300 mmHg 与造模后体重骤降作为成功标志。造模后10 h,取血,脱颈处死小鼠,取左下肺叶检测肺湿/干重比值(wet/dry weight ratio,W/D),取左上肺叶放于4%多聚甲醛中固定用于病理切片,取右肺组织放置于-80℃储存备用。
3.3 小鼠血氧分压、二氧化碳分压及氧合指数分析 小鼠模型建立10 h 后,取小鼠腹主动脉血液标本行血气分析[2]。
3.4 肺组织W/D 检测 用滤纸轻轻吸干肺组织表面水分并置于称量瓶中精密称取湿重,在80 ℃干燥箱内烘烤48 h,精密称取干肺重量并按照C=W湿/W干计算肺组织的湿干重比。
3.5 试剂盒检测血清中氧化应激指标MDA、SOD和GSH-Px 含量 取血,在4 ℃,1006 ×g的条件下分离血清,按照ELISA 方法,实验中设置空白对照孔和标准品孔,采用说明书进行规范加样,最后选择450 nm波长检测A值,并根据标准品的吸光度值及相应的浓度值,制作标准曲线,根据标准曲线计算出待测样品的浓度值。
3.6 HE 染色观察肺组织病理学变化 将肺组织置于4%甲醛溶液中固定,石蜡包埋,切成约5 μm 厚的薄片之后用二甲苯脱蜡,经梯度乙醇脱水置换。按照标准程序进行苏木精-伊红染色,清洗、脱水、封片,于400 倍光学显微镜下观察组织病理学改变。分别以肺泡水肿、肺泡内充血、肺泡内充血、肺间质水肿程度评分:无改变或非常轻微为0 分,轻度改变为1 分,中度改变为2 分,重度改变为3 分,极重度改变为4 分,累计上述4 项的平均分值即为肺损伤评分[13]。
3.7 RT-qPCR 检测肺组织 Nrf2、Keap1 及 HO-1 的mRNA 表达量 肺组织用Trizol 法提取总RNA,按照试剂盒操作说明将RNA 逆转录为cDNA,RT-qPCR扩增条件为:95℃ 30 s;95℃ 5 s,60℃ 31 s,40 个循环。用目的基因的Ct 值减去内参照的Ct 值,得出ΔCt 值,然后用待测组分的ΔCt 值减去正常组的ΔCt值,得出 ΔΔCt 值,采用 2-ΔΔCt分析方法分析目的基因表达量。
3.8 Western blot 检测肺组织中 Nrf2、Keap1 及 HO-1的蛋白表达量 取50~100 mg 肺组织在液氮中进行研磨,并立刻放入RIPA 缓冲液中,待组织与缓冲液充分反应后,离心取上清,用BCA 法进行蛋白定量,每孔等量加样,依次进行SDS-PAGE,转膜,5%脱脂奶粉溶液封闭,洗膜并依次加入到Keap1、Nrf2、HO-1(1:1000)和β-actin Ⅰ抗(1∶5 000),4℃孵育过夜。次日洗膜,加入Ⅱ抗(1∶10 000)室温孵育60 min,洗膜,用增强化学发光(ECL)检测试剂盒显影。用ImageJ图像分析方法进行灰度值分析。
4 统计学处理
采用SPSS 21.0 统计软件进行统计学分析。数据结果均采用均数±标准差(mean±SD)表示,采用单因素方差分析结合多组间方差分析,以P<0.05 为差异具有统计学意义。
结 果
1 FOTa 对ALI 小鼠血氧分压、二氧化碳分压及氧合指数影响
与对照组相比,模型组PaO2与PaO2/FiO2降低(P <0.05),PaCO2升高(P <0.05);与模型组相比,FOTa-280 mg/kg 组 及 Dex 组 PaO2与 PaO2/FiO2升 高(P <0.05),PaCO2降低(P <0.05),见图1。
2 FOTa对ALI小鼠肺组织W/D的影响
与对照组相比,模型组的W/D 升高(P <0.05);与模型组相比,FOTa-280 mg/kg组及Dex组的W/D降低(P <0.05),见图2。
3 FOTa 对小鼠血清中 MDA、SOD 和 GSH-Px 水平的影响
与对照组比较,模型组小鼠的MDA 水平升高(P <0.05),SOD 及 GSH-Px 水平降低(P <0.05);与模型组比较,FOTa 280 mg/kg 组及Dex 组均能降低血清中 MDA 水平(P<0.05),升高 SOD 及GSH-Px 水平(P<0.05),见图3。
4 FOTa对小鼠肺组织病理学的影响
结果显示,对照组肺组织结构清晰,肺泡结构未见明显异常;模型组肺泡腔和间质可见大量红细胞渗出,并伴有肺间质水肿、肺泡结构被破坏、肉眼见片状血灶;FOTa-280 mg/kg组及Dex组肺组织红细胞浸润明显减少,肺泡结构有所改善,肺间质水肿减轻,片状血灶明显减少,与对照组相比,模型组肺组织损伤评分升高(P<0.05)。与模型组相比,FOTa-280 mg/kg 组及Dex 组肺组织损伤评分降低(P<0.05),见图4、5。
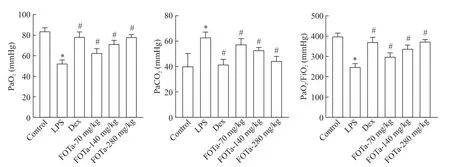
Figure 1.The effect of FOTa on indexes of arterial blood gas analysis in ALI mice.Mean±SD. n=6.*P<0.05 vs control group;#P<0.05 vs LPS group.图1 FOTa对ALI小鼠动脉血中血气分析相关指标的影响

Figure 2.The effect of FOTa on the wet-to-dry weight ratio(W/D)of the lung tissue in ALI mice.Mean±SD. n=6.*P<0.05 vs control group;#P<0.05 vs LPS group.图2 FOTa对ALI小鼠肺组织湿干重比例的影响
5 FOTa 对 ALI 小鼠肺组织 Nrf2、Keap1 及 HO-1 mRNA表达量的影响
与对照组相比,模型组Keap1 mRNA 表达水平升高(P<0.05),Nrf2 与 HO-1 mRNA 表达水平降低(P<0.05);与模型组相比,FOTa-280 mg/kg 组及Dex组 Keap1 mRNA 表达水平降低(P<0.01),Nrf2 与HO-1 mRNA表达水平升高(P<0.05),见图6。
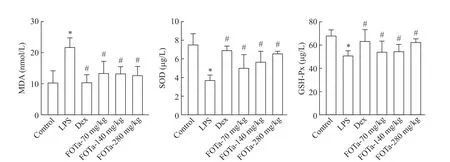
Figure 3.The effect of FOTa on the oxidative stress(serum MDA,SOD and GSH-Px levels)in ALI mice.Mean±SD. n=6.*P<0.05 vs control group;#P<0.05 vs LPS group.图3 FOTa对ALI小鼠血清中氧化应激水平的影响

Figure 4.Effect of FOTa on the histopathological changes of the lung tissue in ALI mice(HE staining,scale bar=50 μm).图4 FOTa对ALI小鼠肺组织病理学改变的影响

Figure 5.Effect of FOTa on the lung injury score of the lung tissue in ALI mice.Mean±SD. n=6.*P<0.05 vs control group;#P<0.05 vs LPS group.图5 FOTa对ALI小鼠肺组织损伤评分的影响
6 FOTa 对 ALI 小鼠肺组织 Nrf2、Keap1 及 HO-1蛋白表达的影响
与对照组相比,模型组Keap1 蛋白表达水平升高(P<0.05),Nrf2 与HO-1 蛋白表达水平降低(P<0.05);与模型组相比,FOTa 低、中、高剂量组及Dex组 Keap1 蛋白表达水平均降低(P<0.05),Nrf2 和HO-1蛋白水平升高(P<0.05),见图7。
讨 论
ALI 以发病机制繁琐,病情进展迅猛为特点,被称为临床常见的危急重疾病之一[14]。研究显示,革兰阴性细菌感染引发脓毒症是ALI 的主要原因[15],也因此而引发肺部炎症细胞的招募和浸润[16]。外膜是革兰阴性细菌细胞壁的主要致病因素,而脂多糖正是存在于外膜的内毒素主成分[17],它在很大程度上可以模拟脓毒症和ALI。在动物模型中,因为气管注射可能伴有严重出血和坏死的可能性,因此通过腹腔注射以诱发 ALI[18]。
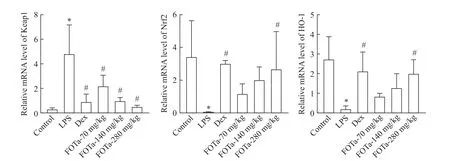
Figure 6.Effects of FOTa on the mRNA expression of Keap1,Nrf2 and HO-1 in the lung tissue of ALI mice.Mean±SD. n=6.*P<0.05 vs control group;#P<0.05 vs LPS group.图6 FOTa对ALI小鼠肺组织Keap1,Nrf2及HO-1 mRNA表达的影响

Figure 7.Effect of FOTa on the Keap1,Nrf2 and HO-1 protein expression in the lung tissue of ALI mice.Mean±SD. n=6.*P<0.05 vs control group;#P<0.05 vs LPS group.图7 FOTa对ALI小鼠肺组织中Keap1、Nrf2及HO-1蛋白表达的影响
本实验中,W/D 升高及病理切片中大量红细胞渗出、片状血灶,可视为LPS 成功诱发了炎症反应。根据柏林定义[2],将 PaO2:FiO2<300 mmHg 称作为ALI。本实验血气指标显示,模型组小鼠PaO2:FiO2<300 mmHg(PaO2/FiO2≈250,FiO2=0.21),PaCO2升高。而动脉血中PaCO2的升高严重影响了机体的换气功能。综合上述结果,该实验建立模型成功。给药组中,PaCO2明显降低说明机体换气功能有所改善。FOTa 对PaCO2的升高有了明显缓解作用,这可能是FOTa 抑制了肺部炎症反应,提高了血氧结合比,从而改善了肺部功能。
在LPS 诱导下,炎症细胞可通过浸润肺组织引发炎症因子聚集而诱发氧化应激反应[19],外源性和内源性ROS介导的氧化应激是引发炎症介质和细胞损伤的重要因素[20],其中,SOD 与 GSH-Px 两种酶在肺组织内源性抗氧化系统中起重要作用,而MDA 作为自由基脂质过氧化反应的最终产物,反映肺组织的损伤程度[21]。ELISA 法显示,模型组血清中 SOD与GSH-Px 浓度降低,此结果可能与LPS 引发的肺部氧化应激有关,而MDA 浓度升高也证明了这一结果。FOTa 的应用降低了MDA,升高了SOD 与GSHPx 的水平,从而阻止了氧化应激对正常肺组织细胞的损伤,降低了肺组织炎症细胞及红细胞浸润。
Nrf2 介导的信号通路是机体内维持氧化应激的重要信号通路。此外,研究表明Keap1 是氧化应激的关键传感器[22]。经LPS刺激,模型组中Keap1蛋白表达水平升高,此结果表明Keap1 参与了氧化应激反应的诱发。接着,在氧化胁迫下Nrf2 从Keap1 中释放出来,从而激活其在核中下游调控的基因—HO-1[23]。研究显示,HO-1 具有较强的抗炎作用[24]。根据本实验FOTa 增加HO-1 mRNA 及蛋白表达水平的结果推测FOTa 与HO-1 共同协调了抗炎作用。而Nrf2 通过调节抗氧化应激反应蛋白的功能来维持细胞稳态[24]。研究显示,Nrf2 未激活时体内的氧化应激反应水平极高,也是ALI 发展迅猛的时期[25]。给药组中FOTa 升高了Nrf2 的蛋白表达水平,表明当药物发挥保护作用时,Nrf2 是以激活的状态存在体内的。综上所述,Nrf2 信号通路参与了FOTa 减轻LPS诱导的小鼠ALI的病理生理过程。
