体外肺癌上皮-间充质转化三维模型的建立及其对顺铂抵抗的机制研究*
2021-02-05陈清勇
徐 炜, 王 剑, 宋 嘉, 陈清勇
(中国人民解放军第903医院,浙江杭州310013)
既往研究表明,上皮-间充质转化(epithelial-mesenchymal transition,EMT)与肿瘤的恶性生物学行为、药物抵抗和复发密切相关[1-2]。然而在经典的肿瘤EMT及耐药性研究方面,目前仍主要采用二维细胞培养(two-dimensional cell culture,2DCC)及动物肿瘤模型。而随着肿瘤研究的不断深入,肿瘤微环境的重要性已备受人们关注[3],由于二维培养缺少细胞外基质(extracellular matrix,ECM)环境,无法进行肿瘤细胞之间、肿瘤细胞与微环境之间的交互研究;而动物实验周期较长,并且涉及到伦理道德、个体差异、免疫排斥和种属差异等问题,导致许多人类肿瘤模型无法在动物体内复制,而且动物实验最终呈现的是实验结果,但实验的中间过程是难以被观察的。
体外三维细胞培养(three-dimensional cell culture,3DCC)是介于动物实验与二维平面细胞培养之间的实验技术,该技术满足细胞培养的直观和条件可控性的基础上,尽可能模拟体内肿瘤细胞三维形态及功能,在模拟细胞与细胞之间、细胞与基质微环境相互作用方面具有独特的优势[4]。而体外肺癌三EMT 模型尚无文献报道,本研究拟采用三维培养技术在体外构建肺癌三维模型,并用转化生长因子β1(transform growth factor-β1,TGF-β1)诱导形成三维EMT肺癌模型,并对其形态、蛋白表达和药物敏感性进行研究,揭示三维培养肺癌细胞发生EMT 和顺铂抵抗的分子机制。
材 料 和 方 法
1 材料
1.1 细胞株 人非小细胞肺癌细胞系95D 购自中科院上海细胞生物研究所。
1.2 主要试剂 胎牛血清和RPMI-1640 培养液购自 Gibco;TGF-β1 购自 PeproTech;顺铂注射液购自齐鲁制药公司;琼脂购自Gene;氯化钙颗粒(分析纯)购自天津市永大化学试剂有限公司;海藻酸钠购自Sigma;兔抗人E-cadherin、N-cadherin、vimentin、AKT、mTOR、p-AKT 和 p-mTOR 抗体均购自 Cell Signaling Technology;抗GAPDH 抗体购自Abcam;羊抗兔IgGⅡ抗购自杭州联川生物有限公司;荧光羊抗兔IgGⅡ抗购自Jackson ImmunoResearch。
2 方法
2.1 细胞培养 95D 细胞培养于含10%胎牛血清、青霉素(终浓度为1×105U/L)和链霉素(终浓度0.1 mg/L)的 RPMI-1640 培养液,常规置于37℃、5%CO2培养箱中,取对数生长期细胞实验。
2.2 细胞支架制备 支架材料为琼脂和海藻酸钠混合物,材料终浓度为5%,外形为半径4 mm、高度2 mm 的圆柱形米黄色干燥薄片。前期研究结果表明,该种材料的细胞支架具有无毒、生物兼容性好、降解率低、内部孔隙率高、细胞成球快、成球率高等优点[5],可用于肺癌细胞三维培养。
2.3 细胞接种 支架在95%乙醇中浸泡1 h 后,用无菌镊子转移将支架至24 孔板中,超净台内紫外线照射2 h,室温下晾干,调整细胞浓度为5×108/L,取40 μL 细胞悬液,轻轻添加到支架上,37℃孵育45 min之后加入1 mL培养液,每24 h换液一次。
2.4 EMT 模型诱导及细胞形态观察 细胞在支架上培养96 h 后基本形成细胞球,此时将培养液更换为含有 5 μg/L TGF-β1、0.5 μmol/L LY294002 或 10 nmol/L rapamycin 的培养液继续培养3 d,每24 h换液一次。每日用荧光倒置显微镜观察细胞形态变化。72 h 后将支架取出,PBS 柔和漂洗3 次,4%甲醛固定24 h,梯度(50%→75%→95%→100%→100%)乙醇脱水,每次脱水15 min,室温干燥12 h 后将样品固定在导电台上,表面喷金30 s 后在1.5 kV 电压下用扫描电镜观察细胞形态。
2.5 激光共聚焦观察蛋白表达 弃掉培养液,用PBS 洗 2~3 次,每次 5 min。加 1 mL 浓度为 4% 多聚甲醛,固定细胞,室温30 min。弃掉固定液,加PBS清洗3 次,每次5 min。弃液后加入1 mL 0.1%Triton X-100,室温透膜 15 min。弃液后加 PBS 清洗 3 次,每次5 min。5%PBS脱脂乳封闭1 h。加Ⅰ抗,4℃孵育过夜,弃液后加PBS清洗3次,每次5 min。加荧光Ⅱ抗,避光孵育1.5 h,弃液后加PBS 清洗3 次,每次5 min。DAPI 染色 15 min,弃液后加 PBS 清洗 3 次,每次5 min。用镊子挑起支架,用锐器轻轻刮下支架表面细胞至玻片上,盖上盖玻片后,再用激光共聚焦显微镜观察。
2.6 MTT 法检测三维培养细胞对顺铂的敏感性将支架均匀裁剪成4 份,95%乙醇浸泡消毒后,用无菌镊子将支架转移至96 孔板。调整细胞浓度为5×108/L,取10 μL 细胞悬液,轻轻添加到支架上,孵育30 min 后,加入含有 10%FBS 的培养液,每 24 h 换液1 次。待培养96 h 后,三维培养EMT 组更换为含有5 μg/L TGF-β1 的培养液和顺铂浓度分别为0、2、4、8、16和32 μmol/L 的培养液;三维培养组加入顺铂浓度分别为0、2、4、8、16和32 μmol/L的培养液,继续培养3 d,每24 h 换液1 次。两组均设5 个复孔,待培养结束后,于各孔加人20 μL MTT 溶液(5 g/L,无菌PBS配制),37℃温箱孵育4 h,弃培养液,各孔加入150 μL 二甲基亚砜,摇床避光轻摇10 min,96 孔板离心机低速离心(200×g,5 min),分离支架与上清液,每孔吸100 μL 上清液置于另一96 孔板内,酶标仪在490 nm 处检测A值,绘制细胞活力抑制率曲线,其中横坐标为药物浓度(μmol/L),纵坐标为细胞活力抑制率(%)。
2.7 Western blot 检测蛋白表达 收集细胞并加入裂解液充分裂解,低温高速离心(4℃,13 800×g,15 min),提取上清-80℃保存。BCA 法检测蛋白浓度,煮沸变性后每个泳道加入总蛋白10 μg,8% SDSPAGE 分离后,转印(300 mA,120 min)到 PVDF 膜上。5%脱脂牛奶或牛血清白蛋白室温封闭1 h。洗膜后加入Ⅰ抗,4℃孵育过夜。Ⅱ抗(1∶3 000)孵育1.5 h 后洗膜,加入ECL 发光液,凝胶成像系统照相,用ImageJ软件分析条带灰度值。
3 统计学处理
以上实验均至少重复3 次。应用SPSS 13.0 软件进行统计分析。数据以均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析(oneway ANOVA),两两比较采用 Bonferroni 校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 TGF-β1促进三维培养95D细胞EMT
倒置荧光显微镜结果显示,三维培养95D 细胞呈聚集生长,细胞无伪足,细胞球表面较为光滑,细胞球之间存在明显的界限;当加入TGF-β1 后,原本表面紧实的细胞球出现了细胞离散、迁移,见图1。
扫描电镜结果显示,三维培养95D 细胞呈球形生长,细胞球表明圆滑,而在TGF-β1 刺激后,细胞球出现了塌陷,细胞间的黏附不再紧密,底部细胞有细小伪足出现,细胞向周围迁移,见图2。
激光共聚焦显微镜观察显示,TGF-β1刺激后E-cadherin 蛋白表达无明显变化,而N-cadherin 和vimentin蛋白表达上调,见图3。
Western blot 显示,TGF-β1 刺激后 E-cadherin 蛋白表达下调(P<0.01),而N-cadherin 和vimentin 蛋白表达上调(均P<0.01),见图4。

Figure 1.The effect of TGF-β1 on the morphological changes of three-dimensionally cultured 95D cells observed by inversed fluorescence microscopy(scale bar=200 μm).A:control group;B:TGF-β1 group.图1 倒置荧光显微镜观察TGF-β1 对三维培养95D 细胞形态的影响
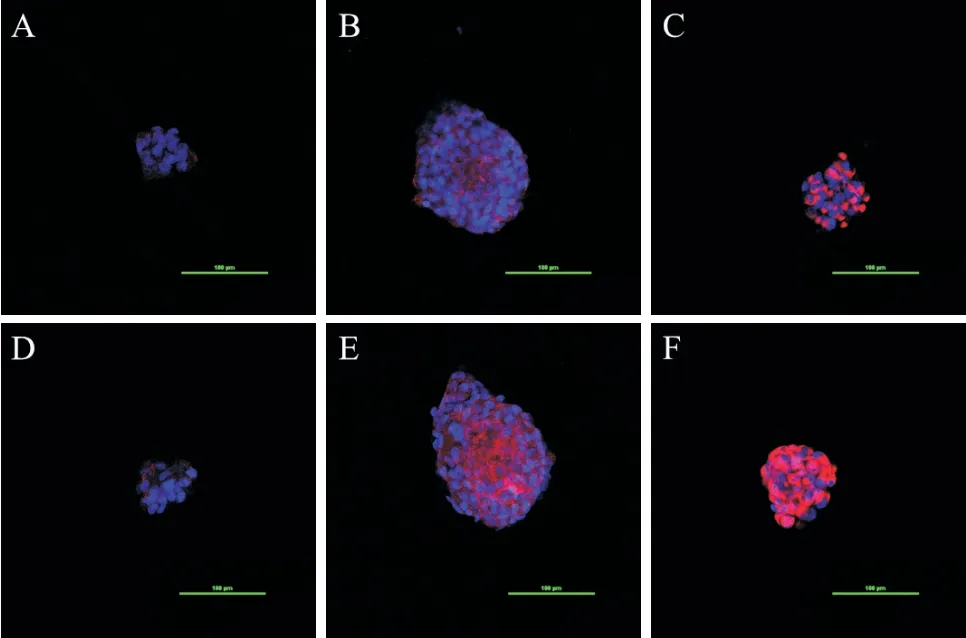
Figure 3.The effect of TGF-β1 on the protein expression in three-dimensionally cultured 95D cells observed by laser confocal microscopy(scale bar=100 μm).A,D:E-cadherin;B,E:N-cadherin;C,F:vimentin.A~C:control group;D~F:TGF-β1 group.图3 激光共聚焦显微镜观察TGF-β1 对三维培养95D 细胞蛋白表达的影响
2 LY294002 和 rapamycin 逆转 TGF-β1 诱导的三维培养95D细胞EMT
荧光倒置显微镜观察显示,PI3K 抑制剂LY294002 及 mTOR 抑制 剂 rapamycin 可显 著 抑制TGF-β1刺激后细胞球的离散和迁移,见图5。

Figure 4.The effect of TGF-β1 on the protein expression in three-dimensionally cultured 95D cells detected by Western blot.Mean±SD. n=4.**P<0.01 vs control group.图4 Western blot检测TGF-β1对三维培养95D细胞蛋白表达的影响

Figure5.LY294002 and rapamycin reversed TGF-β1-induced mesenchymal phenotype of three-dimensionally cultured 95D cells.A:control group;B:TGF-β1 group;C:TGF-β1+LY294002 group;D:TGF-β1+rapamycin group.Scale bar=200 μm.图5 LY294002和rapamycin逆转TGF-β1诱导三维培养95D细胞的间充质表型
Western blot 结果显示,与 control 组比较,TGF-β1 处理三维培养95D细胞可诱导AKT和mTOR磷酸化水平升高(P<0.05),同时E-cadherin 表达下调(P<0.05),N-cadherin和vimentin表达上调(P<0.01);与TGF-β1 组比较,LY294002 可抑制 AKT 和 mTOR 磷酸化(P<0.05),上调E-cadherin 蛋白表达(P<0.05),下调 N-cadherin 和 vimentin 表达(P<0.01);与 TGF-β1 组比较,rapamycin 不能抑制 AKT 磷酸化(P>0.05),但可抑制 mTOR 磷酸化(P<0.01),上调 E-cadherin 蛋白表达(P<0.05),下调 N-cadherin 和 vimentin表达(P<0.01),见图6。
3 LY294002 和 rapamycin 逆转 TGF-β1 诱导的三维培养95D细胞顺铂抗性
MTT 结果表明,TGF-β1 可增强三维培养 95D 细胞对顺铂的抵抗,而LY294002 和rapamycin 可逆转这一现象;计算 IC50值显示,与 TGF-β1 组[(8.42±0.61)μmol/L]相比,空白组[(6.12±0.54)μmol/L]、LY294002 组[(6.34±0.28)μmol/L]和 rapamycin 组[(6.56±0.03)μmol/L]95D 细胞对顺铂的敏感性均较高(P<0.01),见图7。
讨 论
肺癌已成为死亡率最高的肿瘤,转移和耐药是肺癌治疗失败的重要原因之一,而EMT 与此密切相关[6]。目前关于EMT 的研究基本停留在二维细胞培养模型层面,与二维模型相比,三维培养可以更好地模拟肿瘤微环境,促进细胞外基质的形成,提供更准确的扩散率和细胞形态学特征[7]。从本质上讲,三维培养具有与体内相似的肿瘤条件。例如,它们表现出缺氧区、静止区(干细胞样)和增殖细胞区、电化学梯度以及细胞-细胞和细胞-微环境相互作用,这与实体肿瘤微环境相似[8]。
三维培养条件下EMT发生时细胞形态是与二维培养不同。EMT 发生后,细胞球可长出鹿角样和树枝样的“触角”,这些“触角”是由多个细胞构成管状三维结构,可向周围侵袭生长[9]。在蛋白表达方面虽也表现为E-cadherin 下调,vimentin 和N-cadherin等蛋白上调,但与二维培养条件下发生的EMT相比,同种细胞在三维培养条件下发生EMT时表现出偏向于上皮形态,即更高的E-cadherin 和更低的vimentin表达,并且具有类似肿瘤干细胞的特性,这种特性是二维培养细胞不具备的[10]。

Figure 6.LY294002 and rapamycin reversed TGF-β1-induced epithelial-mesenchymal transformation and activation of PI3K/AKT/mTOR pathway in three-dimensionally cultured 95D cells.Mean±SD. n=4.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs TGF-β1 group.图6 LY294002和rapamycin逆转TGF-β1诱导的三维培养95D细胞上皮-间充质转化及PI3K/AKT/mTOR 通路活化
三维培养条件下构建EMT 模型的报道极少,主要受培养方法、生物材料和细胞本身对三维环境及诱导因子敏感性等因素的影响,因此构建EMT 模型较难。例如Pal 等[11]观察不同生物材料对肿瘤细胞EMT 的诱导作用,结果显示细胞接种在聚乳酸-乙醇酸[poly(lactic-co-glycolic acid),PLGA]和明胶甲基丙烯酰胺(gelatin methacrylamide,GelMA)混合材料支架后,相比单用这两种材料更易诱导细胞发生EMT。Essid等[12]采用无血清悬浮培养方法获得肿瘤细胞球,再用EGF 和FGF 等细胞因子和低氧条件诱导头颈部鳞癌细胞发生EMT,而常氧和正常血清条件可逆转EMT 过程。然而上述实验方法构建EMT模型耗时较长,需3~14 d,过程也较为繁琐,此外上述研究多集中在细胞表型、蛋白表达,对功能及相关信号通路的研究较少。本研究期望采用一种快速、简便的方法构建体外肺癌三维EMT 模型,并对其表型、蛋白表达以及功能、信号通路进行研究。我们前期在3D 打印支架上培养肺癌95D 细胞可快速构建体外肺癌三维模型[5],可在该研究基础上进一步探索EMT及药敏的分子机制。

Figure 7.LY294002 and rapamycin reversed TGF-β1-induced resistance to cisplatin in three-dimensionally cultured 95D cells.A:the cell viability was detected by MTT assay;B:the IC50 values of each group.Mean±SD. n=5.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs TGF-β1 group.图7 LY294002和rapamycin逆转TGF-β1诱导的三维培养肺癌95D细胞顺铂抗性
我们前期的预实验表明,95D 细胞在二维培养条件下,对TGF-β1 刺激无反应,但在三维培养条件下有明显反应,12 h 即可观察到细胞球离散现象,这表明三维环境可改变细胞的生物学行为。在加入TGF-β1 刺激 3 d 后,三维培养 95D 细胞球出现了明显的塌陷,细胞球中的细胞发生离散、迁移。电镜检测,加入TGF-β1 刺激后,细胞球底部的细胞生长出伪足,并向周围迁移。进一步用Western blot 验证显示,TGF-β1 刺激后的三维培养95D 细胞出现了E-cadherin 下调,N-cadherin 和 vimentin 上调,表明确实发生了EMT,与激光共聚焦观察到的结果基本一致。
既往研究表明,PI3K/AKT/mTOR 信号通路与肿瘤EMT 及耐药密切相关[13],但在三维培养条件下是否有影响需进一步探究。本实验结果显示,与对照组相比,EMT组的p-AKT和p-mTOR蛋白表达显著高于对照组,而加入PI3K及mTOR抑制剂后,p-AKT、pmTOR 蛋白表达较EMT明显下降,并且EMT被逆转,表现为 E-cadherin 上调,N-cadherin 和 vimentin 下调,细胞球未出现细胞离散现象。这表明TGF-β1 诱导三维培养肺癌细胞发生EMT 可能是通过激活PI3K/AKT/mTOR 信号通路实现的。MTT 结果显示,发生EMT 的三维培养95D 细胞对顺铂的敏感性显著低于对照组,而加入PI3K及mTOR抑制剂后,可重新增强三维培养95D 细胞对顺铂的敏感性,进一步凸显了PI3K/AKT/mTOR 信号通路在三维培养细胞对药物抵抗机制中的作用。
综上所述,本研究在3D 打印技术构建体外肺癌三维模型基础上利用TGF-β1 成功将其诱导为EMT模型,该方法具有简单、快速成型、条件可控等特点,并且发现三维培养肺癌细胞发生EMT及对顺铂抵抗可能是通过PI3K/AKT/mTOR 信号通路实现的。这一新型的体外肿瘤模型可为肿瘤转移和药敏研究提供有力工具。
