结直肠癌组织STAT3、Foxp3、IL-6表达与临床病理特征的相关性*
2021-02-05颜春辉于燕妮郭莉莉
颜春辉,于燕妮*,郭莉莉
(1.贵州医科大学 基础医学院 病理学教研室,贵州 贵阳 550004; 2.贵阳市第一人民医院 病理科,贵州 贵阳 550002)
结直肠癌(colorectal cancer,CRC)是临床上最常见的恶性肿瘤之一,有着不良的生存预后,晚期转移是其死亡的主要原因[1]。在疾病所有阶段的5年生存率约为50%[2]。近二十年来我国CRC的发病率和病死率一直在攀升,已跃居肿瘤总发病率第4位,总死亡率第5位[3]。尽管最近在外科手术治疗和化学疗法方面取得了进步,但在20%~25%的患者中仍有复发,治疗效果仍不理想。白细胞介素-6(interleukin-6,IL-6)是主要的促肿瘤细胞因子,信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)是STAT家族蛋白的成员,STAT3是主要的致癌转录因子,可以通过IL-6和IL-6受体的结合而被激活。此外,IL-6/STAT3途径可阻断树突状细胞(dendritic cells,DC)的成熟,抑制T细胞活化,并通过骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSC)和肿瘤相关巨噬细胞(tumour-associated macrophages,TAM)维持免疫抑制作用[4]。调节性T细胞(regulatory T cells,Tregs)参与维持免疫稳态和预防自身免疫。Treg细胞包括胸腺Treg细胞和外周Treg细胞,两者均可通过多种不同的机制抑制免疫应答,而叉头盒p3(forkhead box p3,Foxp3)转录因子是Treg细胞发育和抑制活性的主要调节剂[5]。STAT3信号通路、Foxp3和IL-6均与肿瘤的发生发展及免疫抑制有十分密切的关系。本研究回顾分析了44名CRC患者STAT3、Foxp3及IL-6的表达,旨在探讨CRC患者STAT3、Foxp3及IL-6免疫组化表达情况及其与临床病理特征的相关性。
1 材料和方法
1.1 材料
1.1.1标本 收集2015年3月—2018年12月就诊并经病理诊断确诊为CRC的患者44例作为实验组。患者相关资料完整,未并发其他恶性肿瘤和结直肠疾病,均接受手术治疗并取得CRC组织,同时收集患者临床病理资料。实验组中男性21例,女性23例;患者年龄23-79岁,中位年龄62岁,平均年龄61岁;有神经侵犯7例,无神经侵犯37例;有脉管侵犯9例,无脉管侵犯35例;高分化4例,中分化24例,低分化16例;溃疡型36例,隆起型8例;有转移32例,无转移12例。此外,选取其中20例癌旁组织作为对照组。
1.1.2主要试剂 Anti-STAT3抗体、Anti-Foxp3抗体、Anti-IL-6抗体由万类生物有限公司提供,免疫组化二抗Envsion由北京中杉金桥生物技术有限公司提供。
1.2 方法
用已知CRC阳性切片作为阳性对照,PBS代替一抗作为阴性对照,STAT3、Foxp3、IL-6抗体稀释度分别为1 ∶500、1 ∶400及1 ∶800,按照EnvsionTM步骤处理组织标本,5 μm连续切片,于60 ℃恒温烤箱中烘烤30 min,晾干备用,二甲苯脱蜡,梯度酒精水化,H2O2溶液水浴箱孵育10 min消除内源性过氧化物酶,放入盛有柠檬酸盐修复液的容器中,高温高压修复3 min,修复后冷却至室温,滴加山羊血清封闭20 min、滴加一抗,4 ℃冰箱中孵育过夜。孵育过夜的切片在水浴箱中复温30 min,滴加二抗后水浴箱中孵育30 min,二氨基联苯胺(diaminobenzidin,DAB)试剂显色,苏木精复染,乙醇脱水透明,中性树脂封片,光学显微镜下观察。
1.3 观察指标
每张切片随机取5个200倍视野,按着色强度及阳性细胞所占的百分比进行结果判定。着色强度评分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;按阳性细胞数占同类细胞数的百分比评分:阴性为0分,阳性细胞数1%~25%为1分,阳性细胞数26%~50%为2分,阳性细胞数51%~75%为3分,阳性细胞数76%~100%为4分;取两项评分的乘积作为最终分数,根据最终分数分成4个等级,0~1分为“-”,2~4分为“+”,5~8分为“++”,9~12分“+++”,将“++”和“+++”定义为阳性。
1.4 统计学方法
实验数据采用SPSS 25.0统计软件进行分析,率的比较采用χ2检验,相关性分析采用Spearman等级相关分析法,P<0.05认为差异有统计学意义。
2 结果
2.1 CRC中STAT3、Foxp3及IL-6蛋白的表达情况
结果显示,STAT3、Foxp3及IL-6三种蛋白的阳性细胞在CRC组织和癌旁组织的胞质中均有表达,但以CRC组织明显,癌旁组织表达较少(图1)。实验组STAT3、Foxp3及IL-6蛋白表达明显高于对照组,差异有统计学意义(P<0.05)。见图1和表1。
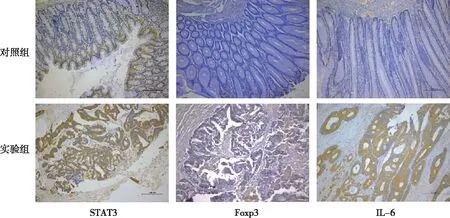
图1 两组组织标本中STAT3、Foxp3及IL-6表达(Envison,×200)
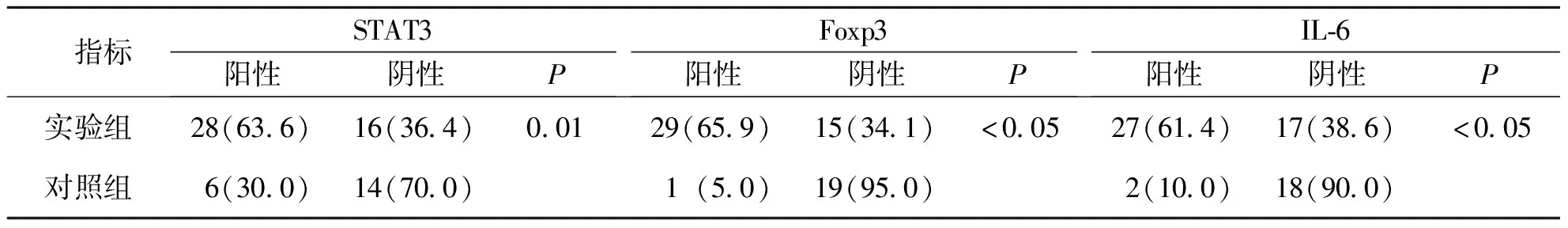
表1 两组组织标本中STAT3、Foxp3及IL-6表达[n(%)]
2.2 STAT3、Foxp3及IL-6蛋白表达与CRC患者临床病理参数的关系
CRC组织中STAT3、Foxp3及IL-6蛋白表达与患者性别、年龄、神经侵犯、脉管受累无关,差异无统计学意义(P>0.05);STAT3蛋白表达与肿瘤分化程度有关,差异有统计学意义(P<0.05);Foxp3与淋巴结转移有关,差异有统计学意义(P<0.05);IL-6与肿瘤分级有关,差异有统计学意义(P<0.05)。表2。
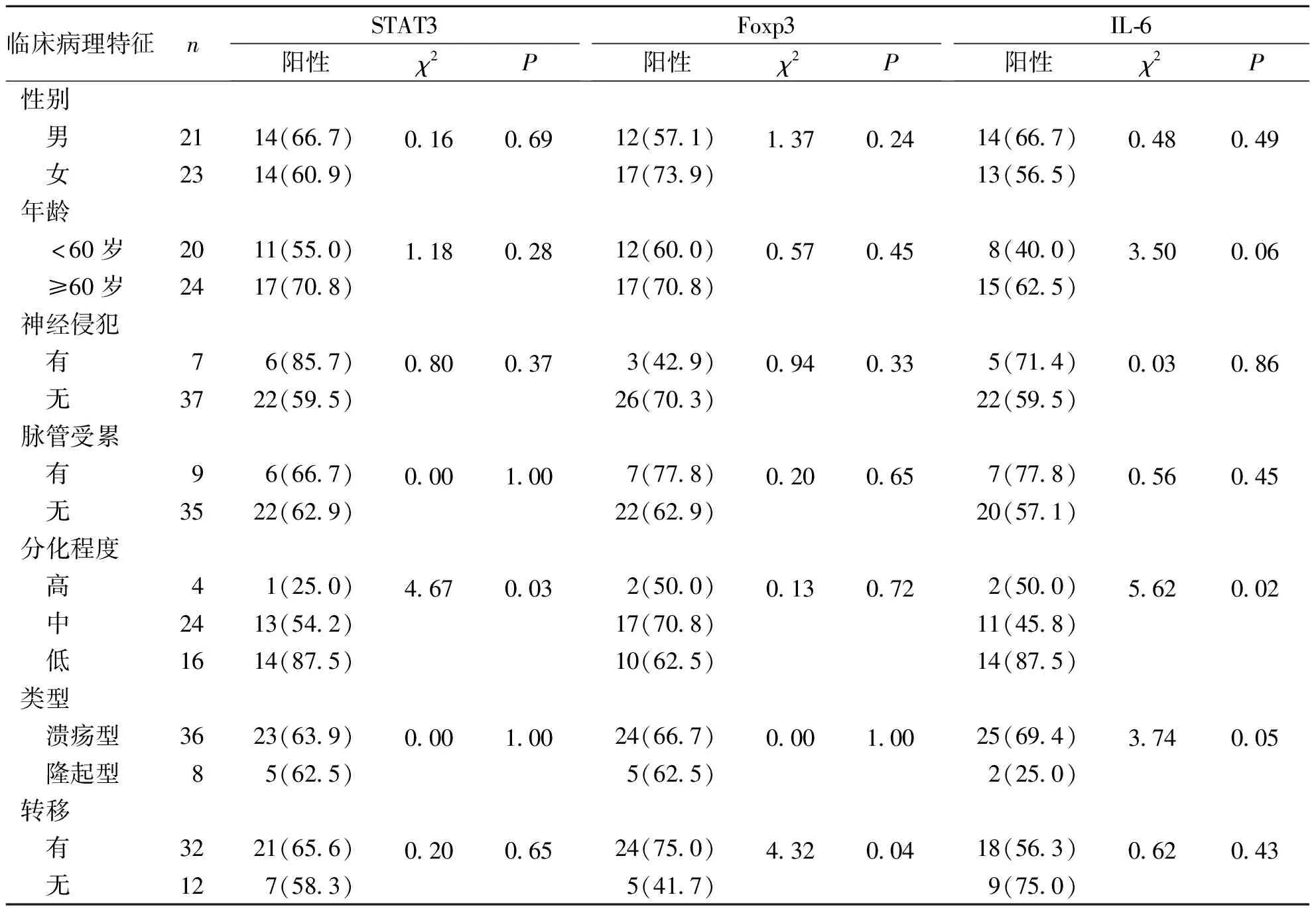
表2 STAT3、Foxp3及IL-6表达与CRC患者临床病理特征的关系[n(%)]
2.3 CRC中STAT3、Foxp3及IL-6蛋白表达的相关性
Spearman相关性分析结果显示,CRC组织中STAT3、Foxp3及IL-6蛋白表达间均无相关性,差异无统计学意义(P>0.05)。见表3。

表3 CRC患者STAT3、Foxp3及IL-6表达的相关性
3 讨论
CRC是临床上最常见的致命恶性肿瘤之一,预测到2030年,年龄在20至34岁之间的患者的结肠癌和直肠癌的发病率可能分别会增加90.0%和124.2%[6]。近几十年来,越来越多的发展中国家的CRC发病率急剧上升。随着生活条件的改善,中国CRC的发病率猛增,CRC是男性中第五大最常见的癌症,在女性中排第四位。尽管采用了放射疗法和化学疗法,并且手术效果显著改善,但大约一半的CRC患者在治疗五年内将再次复发。大多数CRC肿瘤是散发性的(70%~80%),其中约20%是遗传起源的。CRC患者中最常见的突变基因是APC,TP53,KRAS和PIK3CA[7]。CRC被认为是一种异质性疾病,并且已知其源于遗传和表观遗传学改变的积累。异质性疾病具有肿瘤间和肿瘤内异质性。理想的生物标志物应该在肿瘤组织内和肿瘤组织之间均具有均一的表达,以便在所有患者中用作敏感的和特异性的生物标志物。因此,由各种生物标志物组成的小组可能是解决肿瘤内和肿瘤内异质性的好方法。检测在CRC肿瘤组织中测试分子生物标记物,以协助疾病的预后,监测和治疗。
STAT3是信号转导和转录激活因子家族的一部分,也是一种多效性转录因子,并在促进肿瘤细胞增殖,肿瘤侵袭,血管发生和免疫抑制中发挥重要作用[8]。STAT3可以被多种细胞因子激活,包括CRC中经常出现的IL-6和IL-11[9-10]。已证明上皮STAT3的激活可调节肠内稳态并影响CRC的发展。STAT3可通过对细胞周期产生作用来促进结肠上皮中肿瘤的发生。对于结肠癌,这一发现得到了以下发现的支持:在结肠癌细胞系中,STAT3的异源过表达或细胞因子介导的内源性STAT3的激活会加速细胞增殖。STAT3激活除了在介导宿主免疫应答中发挥作用外,还在许多关键的肿瘤细胞途径中起着不可或缺的作用,包括增殖、上皮-间质转化(epithelial mesenchymal transitions,EMT)和促进癌细胞活性[11]。本研究中CRC组织中STAT3阳性表达率63.6%,显著高于癌旁组织(P<0.05)。此外本研究证实CRC组织中STAT3阳性表达率与患者性别、年龄、部位、神经侵犯、脉管侵犯、肿瘤类型无关,而与CRC组织的分化程度相关,差异有统计学意义(P<0.05),这与临床报道一致[12]。Jin等发现STAT3蛋白阳性CRC患者的3年和5年生存率低于STAT3蛋白阴性患者[13]。且STAT3的激活可以通过转化生长因子-β(transforming growth factor-β,TGF-β),血管内皮生长因子(vascular endothelial growth factor,VEGF),MDSC的扩增和抑制NK细胞功能,对于肿瘤细胞的免疫逃逸至关重要[14]。结合本实验发现可能会增加证据表明STAT3参与了CRC的进展。
Foxp3是叉头家族的成员,Foxp3基因位于X染色体的Xp11.23处。Treg细胞是CD+T细胞的独特子集,它们不触发适应性免疫,而是抑制免疫反应[15]。Treg细胞可以说是用途最广的免疫抑制细胞,并且可以像跨各种组织的免疫前哨一样发挥作用[16]。Treg细胞的功能和发育由Foxp3调节,Foxp3是Treg细胞最特异性生物标志物[17]。本研究结果表明Foxp3在CRC组织中的表达显著高于癌旁组织(P<0.05),阳性表达率65.9%。且随着癌症的进展,淋巴结转移,Foxp3在癌组织的表达进一步增加,这可能与肿瘤组织中Foxp3的表达将CD4+T辅助细胞转化为产生TGF-β的Treg细胞,该细胞通过释放抑制因子来抑制细胞介导的免疫[18]。这与肿瘤组织中Foxp3的高表达,淋巴结转移对于CRC的免疫抑制至关重要。
IL-6具有四螺旋结构是一种NF-κB调节的炎性细胞因子,可在肿瘤细胞中促进增殖和抗凋亡作用,也是参与肿瘤生长、侵袭和转移的人类恶性肿瘤多效细胞因子[19]。且在多种肿瘤的发生和发展中具有重要的作用,例如肺癌,食道癌,乳腺癌,卵巢癌和肾癌[20]。IL-6是早期CRC肿瘤发生过程中的关键肿瘤启动子[21]。相关研究表明在CRC的肿瘤细胞中,IL-6在癌症组织中的过表达与肿瘤分期,淋巴结转移和静脉浸润有关[22]。因此,IL-6癌细胞表达可能是癌症进展的相关标志。据报道,患者的血清样品中的IL-6的表达与结肠直肠腺瘤的风险增加相关[21]。在本研究结果发现IL-6在CRC组织中的表达显著高于癌旁组织(P<0.05),IL-6阳性表达率61.4%,与临床报道大致相符[23]。且CRC组织中IL-6的表达与肿瘤的分化程度有关,差异有统计学意义(P<0.05)。IL-6增强慢性炎症期,给肿瘤的生长提供了一个理想的环境。且有相关研究发现肿瘤细胞产生的IL-6作为生长因子与癌细胞表面膜上的特定受体相互作用,可以增强癌细胞的存活和增殖[24]。此外,IL-6/STAT3途径可阻断DC的成熟,抑制T细胞活化,并通过MDSC和TAM维持免疫抑制作用[4]。结合本研究结果,IL-6可能参与CRC的进展,随着疾病严重程度的增加而增加。
总之,CRC组织中STAT3、Foxp3和IL-6蛋白过量表达提示患者恶性程度高,转移可能性大,这可能与STAT3、Foxp3及IL-6蛋白的表达都能够抑制了肿瘤的免疫应答相关,可能与CRC的发生和进展有着密切的关联,可以作为判断CRC预后效果的重要参考指标之一,但三种分子在信号通路上的相互作用和联系的具体机制尚不清楚,还有待进一步的研究。
