超高效液相色谱法检测舒肝宁配伍含量的稳定性*
2021-02-05潘道苇向红霞陈舒雅付慧晓宛蕾
潘道苇,向红霞,陈舒雅,付慧晓,宛蕾
(1.贵州医科大学 基础医学院 药理学教研室,贵州 贵阳 550025;2.贵阳市第一人民医院,贵州 贵阳 550002)
舒肝宁注射液为贵州省本土企业自主研制的民族药品,对肝病的治疗作用得到广泛的认可,其衍生于传统名方张仲景之《茵陈蒿汤》,由茵陈、栀子、黄芩、板蓝根、灵芝等提取物和植物单体成分组合构成,提取物中含有多种有效成分,对降酶退黄有较好的临床疗效[1-3]。在临床使用过程中,舒肝宁注射液比较容易发生输液反应,轻者为皮疹、瘙痒、畏寒、发热,严重的可导致过敏性休克[4-5]。 舒肝宁注射液说明书中溶媒使用的是10%葡萄糖注射液,溶媒单一,难以满足临床的多元化要求需求,同时临床上在舒肝宁注射液溶媒的使用中出现越来越多的超说明现象[6-7]。本实验通过临床上使用的最大剂量和最小剂量的舒肝宁注射液与临床上常用的溶媒配伍后主要成分含量稳定性的考察,为舒肝宁注射液的稳定性和临床合理用药提供参考[8-11]。
1 材料与方法
1.1 材料
1.1.1仪器 Agilent 1290超高效液相色谱仪(Agilent公司)、FA1004N电子天平(上海菁海仪器有限公司)、GUTEL超声仪(上海冠特超声仪器有限公司)、WP-UP-IV-20微量无机除热源型超纯水机(四川沃特尔水处理设备有限公司)、DK-93-IIA电热恒温水浴锅(天津市泰斯特仪器有限公司)。
1.1.2试药 黄芩苷对照品(贵州迪大科技有限责任公司,批号为GZDD-0037,规格为20 mg,UPLC法测定纯度≥95.5%)、栀子苷对照品(贵州迪大科技有限责任公司,批号为GZDD-0061,规格为20 mg,UPLC法测定纯度≥98%)、0.9%氯化钠注射液(贵州科伦药业有限公司,批号为D18070409)、5%葡萄糖注射液(山东齐都药业有限公司,批号为4B18021105)、10%葡萄糖注射液(贵州天地药业有限责任公司,批号为H18012712),葡萄糖氯化钠注射液(贵州科伦药业有限公司,批号为D18051806)、舒肝宁注射液(贵州瑞和制药有限公司,批号为20180414)、甲醇(色谱纯,德国Merck公司)、磷酸(分析纯,重庆川东化工集团有限公司)、纯净水(屈臣氏集团有限公司)。
1.2 方法
1.2.1对照品溶液的制备 精密称定对照品栀子苷2.58 mg、黄芩苷20.00 mg置于10 mL的容量瓶中,分别加入甲醇溶解稀释至刻度,摇匀;精密吸取该溶液1.00 mL置于10 mL的容量瓶中,加入甲醇稀释定容,摇匀即得栀子苷、黄芩苷浓度分别为25.8 μg/L、200.00 μg/L混合浓度。
1.2.2成品输液的制备 舒肝宁注射液说明书用法用量规定每次10~20 mL,用10%葡萄糖注射液250~500 mL稀释后静脉滴注。根据临床剂量分为最高浓度和最低浓度,取舒肝宁注射液2.0 mL分别加入0.9%氯化钠注射液、5%葡萄糖注射液、10%葡萄糖注射液、葡萄糖氯化钠注射液等临床常用溶媒20 mL,即得最高浓度舒肝宁注射液成品输液。取舒肝宁注射液2.0 mL分别加入0.9%氯化钠注射液、5%葡萄糖注射液、10%葡萄糖注射液、葡萄糖氯化钠注射液(5%、0.9%)等临床常用溶媒100 mL,即得最低浓度舒肝宁注射液成品输液。
1.2.3阴性对照溶液的制备 取茵陈提取物、黄芩苷、板蓝根提取物、灵芝提取物适量,按其处方比例和工艺,缺少栀子苷的阴性对照溶液。取茵陈提取物、栀子提取物、板蓝根提取物、灵芝提取物适量,按其处方比例和工艺,缺少黄芩苷的阴性对照溶液。
1.3 舒肝宁注射液UPLC测定方法的建立
1.3.1色谱条件 采用ACE Excel 2 C18Amide柱(100 mm×2.1 mm,1.7 μm),流动相为0.1%磷酸溶液(A)-甲醇(B),梯度洗脱(0~1.33 min,20% B;1.33~3.33 min,20%~28% B;3.33~4.33 min,28%~35% B;4.33~5 min,35%~38%B;5~8 min,38%~43% B;8~16 min,43%~60% B;16~18 min,60%~20% B;18~20 min,16%~20%),流速为0.2 mL/min;检测波长为238 nm,柱温为40 ℃,进样量为1.0 μL。
1.3.2专属性试验 取阴性对照溶液按“1.3.1”项下色谱条件进样,考察阴性溶液时对栀子苷或黄芩苷测定是否存在干扰。
1.3.3标准曲线的制备 取“1.2.1”项下混合对照品溶液取样0.1、0.3、0.5、1.0、2.0、4.0 μL,将6个不同质量浓度的样品溶液,按“1.3.1”项下色谱条件进行检测,以对照品的进样量(X)对峰面积积分值(Y)进行线性回归,得到回归方程及相关系数。
1.3.4精密度试验 精密吸取“1.2.1”项下混合对照品溶液1.0 μL,按“1.3.1”项下色谱条件连续进样6次,测定峰面积,计算栀子苷、黄芩苷的RSD值,评估仪器的精密度。
1.3.5重复性试验 按“1.2.2”项成品输液配制方法配制低浓度舒肝宁注射液5%葡萄糖注射液成品输液,各6份,测定峰面积,计算栀子苷、黄芩苷的平均含量及RSD值,评估方法的重复性。
1.3.6回收率试验 分别精密量取已知含量舒肝宁注射液各1.0 mL(栀子苷546.44 μg/L,黄芩苷17.996 g/L)置于50 mL容量瓶中,各精密加入“1.2.1 ”项下混合对照品溶液2.0 mL,加实验用水至刻度,摇匀,用0.22 μm滤膜过滤,取续滤液,按“1.3.1”项下的色谱分析条件,测定其待测成分的含量,计算回收率。
1.3.7不同浓度配伍溶液中栀子苷、黄芩苷的含量测定 取“1.2.2”项下的成品输液,经0.22 μm滤膜过滤后,在上述色谱条件下,分别在0、3、6、9 h时自动进样1.0 μL,测定其峰面积。计算栀子苷、黄芩苷的含量。
2 结果
2.1 配伍溶液中的栀子苷、黄芩苷的稳定性考察
2.1.1色谱条件 舒肝宁注射液中栀子苷、黄芩苷色谱图见图1,其主峰分离度好,色谱条件良好,适用于栀子苷、黄芩苷的测定。
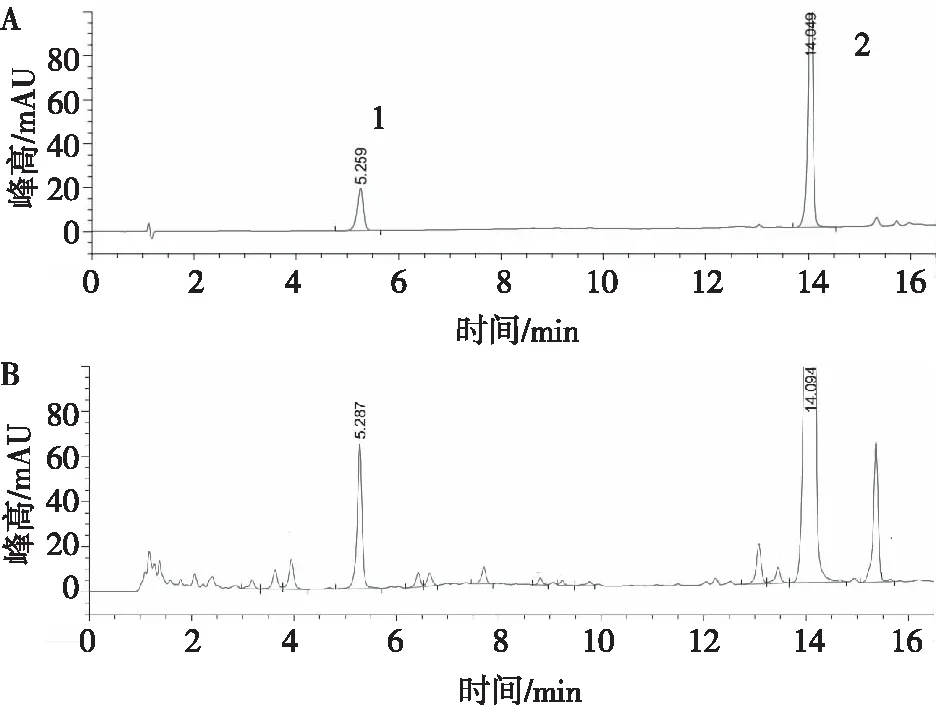
注:A为混合对照品,B为样品;1为栀子苷对照品,2为黄芩苷对照品。
2.1.2专属性试验 在栀子苷、黄芩苷对照品色谱相应的位置上无峰,表明阴性对照试验无干扰。见图2。
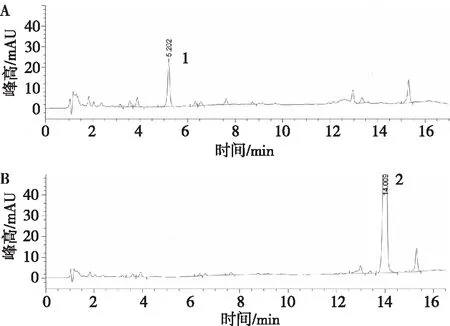
注:A为缺黄芩苷阴性样品;B为缺栀子苷阴性样品;1为栀子苷,2为黄芩苷。
2.1.3线性关系考察 以对照品的浓度X(mg/L)为横坐标、峰面积Y为纵坐标进行线性回归,得到栀子苷、黄芩苷回归线方程分别为Y=6 829.7X+5.029(r=0.999 4)、Y=6 822X-22.38(r=0.999 9),结果表明两种待测成分在各自线性范围内呈良好的线性关系,线性范围分别为2.58~103.20 mg/L、20.00~800.00 mg/L。
2.1.4精密度试验 以峰面积计算栀子苷、黄芩苷含量,RSD分别为1.82%和2.06%,表明仪器精密度良好。
2.1.5重复性试验 根据峰面积,测得栀子苷质量浓度RSD为1.32%,黄芩苷质量浓度RSD分别为1.68%。表明该方法重复性良好。
2.1.6回收率试验 栀子苷平均回收率为98.43%、RSD为1.48%。黄芩苷平均回收率为101.53%、RSD为2.88,均符合试验要求。
2.1.7不同浓度配伍溶液中栀子苷、黄芩苷的含量 舒肝宁注射液与0.9%氯化钠注射液、5%葡萄糖注射液、10%葡萄糖注射液、葡萄糖氯化钠注射液(5%、0.9%)根据临床用药最高用药浓度与最低用药浓度进行配伍,在室温、室内光条件下放置0、3、6、9 h,从表1可见,主要成分栀子苷、黄芩苷含量下降均不超过10%,所以舒肝宁注射液与0.9%氯化钠注射液、5%葡萄糖注射液、10%葡萄糖注射液、葡萄糖氯化钠注射液可以配伍,配伍较为稳定。
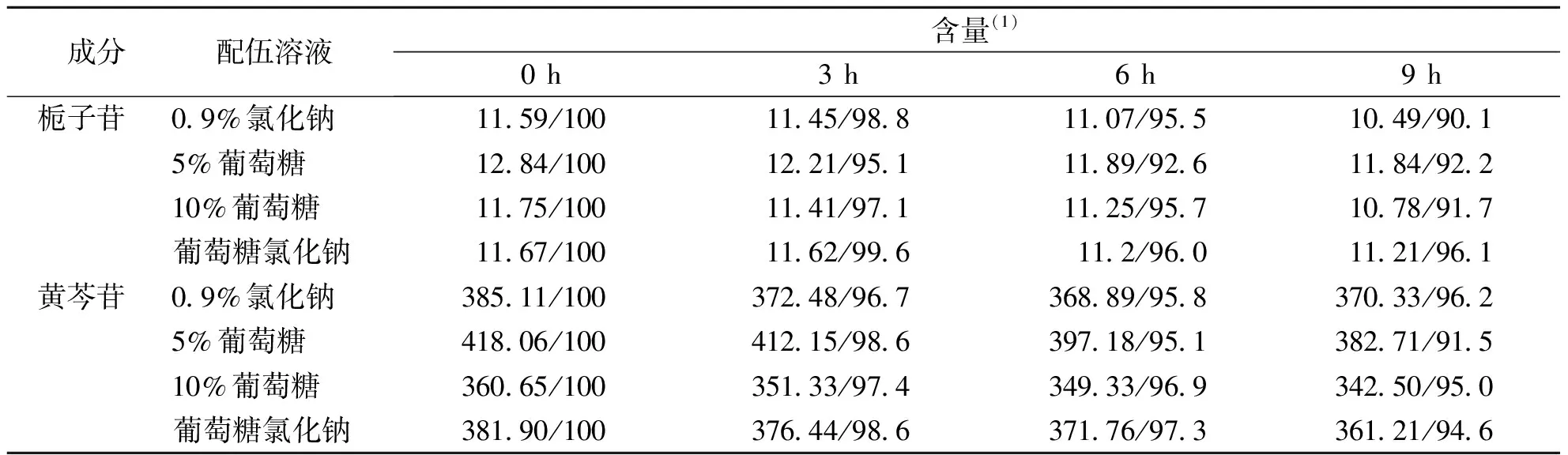
表1 低浓度成品液栀子苷、黄芩苷的含量变化(n=3)
3 讨论
本文利用UPLC测定舒肝宁注射液配伍液主要成分含量情况,参照相关文献,采用甲醇-0.4%磷酸溶液的流动相系统,对不同的梯度洗脱条件下待测成分色谱峰的分离度、对称性、拖尾因子、出峰时间以及色谱峰纯度等多方面进行了综合比较,最终选用文中所用的梯度洗脱程序,在该条件下,供试品溶液中各成分的分离获得较好效果。与传统高效液相色谱法(HPLC)相比[12-13],分析速度更快,灵敏度更高,更准确,且消耗的溶媒更少,能更好的节约资源及成本,具有较大的应用价值,为舒肝宁注射液的质量控制提供依据[14-16]。
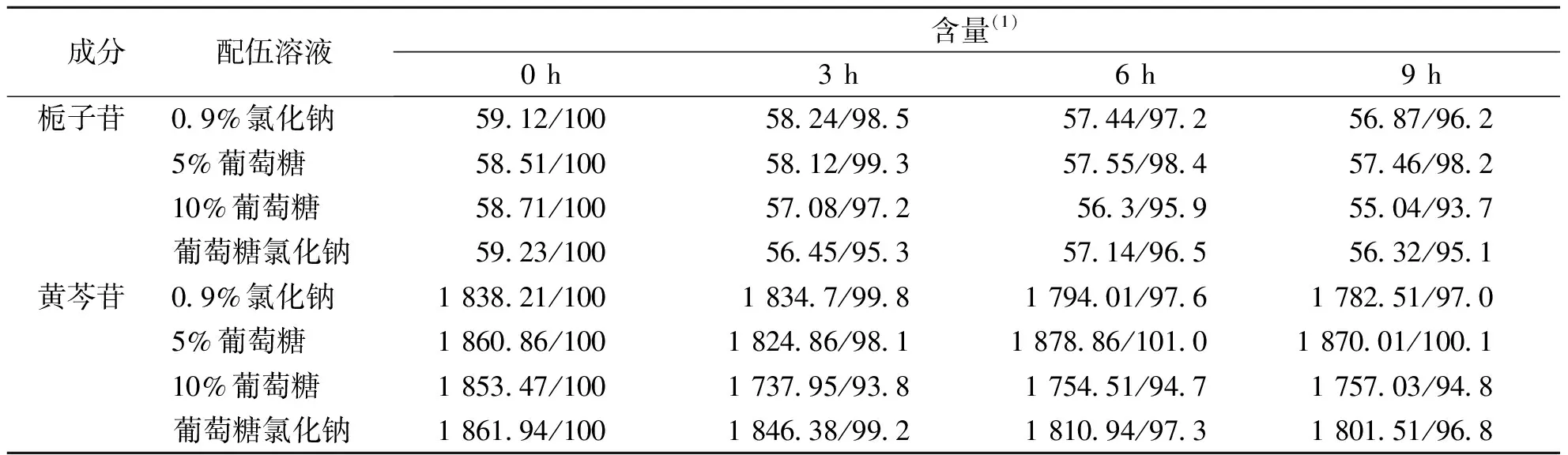
表2 高浓度成品液栀子苷、黄芩苷的含量变化(n=3)
舒肝宁注射液说明书中提及的溶媒仅为10%葡萄糖注射液,溶媒单一选择受限,特别是对于糖尿病患者,一般不推荐使用葡萄糖注射液,所以一定程度上会限制舒肝宁注射液品种的使用[17-20]。本论文通过超高效液相测定高浓度、低浓度舒肝宁注射液在不同溶媒中置放9 h内的黄芩苷、栀子苷的含量变化,并且对比成品液体的澄明液体,均表示有效成分含量、澄明度无明显差异。对于普通患者,舒肝宁注射液选择5%葡萄糖注射液、10%葡萄糖注射液、葡萄糖氯化钠注射液作为溶媒在9 h内均显示稳定状态,但是为了避免超说明书用药带来的医疗风险,还是建议尽可能的选择10%葡萄糖注射液。对于糖尿病患者在使用舒肝宁注射液溶媒需要慎重选择0.9%氯化钠注射液,即使本试验显示此剂量范围在4种溶媒中9 h内主要有效成分含量变化较小。
近年来,中成药注射液直接或者间接引起的药物不良事件频频出现,中成药注射液的静脉配置液稳定性的研究越来越成为热点[21-25]。本文试验通过对舒肝宁注射液配置液主要含量的稳定性研究,为该药的临床用药安全提供了一定的参考依据。
