基于三维可视化技术对巨块型肝癌肝动脉血管分布规律的分析与研究
2021-02-05赵剑强朱青峰刘晓鲁一桐刘东艳秦瑞平谢家馨
赵剑强,朱青峰,刘晓,鲁一桐,刘东艳,秦瑞平,谢家馨
前言
肝癌作为临床上较为常见的一种恶性肿瘤,具有较高的致死率,且病情进展快、易恶化。因此,探索肝癌肿瘤生长规律和精准外科治疗手段成为临床研究热点。近年来已有利用数字化技术对肝脏肿瘤与血管关系的相关研究:林科灿等[1]利用肝脏三维图像进行肝内血管分析并进行自动肝段划分及虚拟解剖性肝切除术,为虚拟肝脏技术在临床中的应用提供了一个平台;方驰华等[2]利用数字医学技术对巨块型肝脏肿瘤进行以血管为轴心的术前规划及诊疗,实现了巨块型肝脏肿瘤的外科手术诊治;倪国才等[3]对于MSCT 多平面重组和血管造影检查肝脏巨大型肿块的研究,对术前评估、手术方案的制定和预后诊断有重大价值。
巨块型肝癌肿瘤直径一般在10 cm 以上,有假包膜形成,常为单发性癌块,也可由多个结节汇集而成一大块,有时其邻近有小的散在癌结节[4]。肝癌治疗以手术切除为主,但巨块型肝癌大多已失去手术机会。对于此类肝癌,经肝动脉栓塞化疗是目前被认可的肝癌非手术治疗的最常用方法之一,也是治疗晚期原发性肝癌可获得的可靠治疗的方法[5-6]。但肝癌旁血管走形复杂,不同血管相互交错走形,尤其是肝癌经常发生继发性病变,干扰临床医生对肿瘤病症的判断,延误病变诊断与治疗。
肝癌的血液供应较复杂,主要包括肝动脉供血、门静脉供血、侧支血管供血及肝动脉门静脉双重供血。门静脉供血主要在早期,肝内病灶分化程度高;肝动脉供血主要在进展期,肿瘤分化程度降低[7-8]。本研究拟通过对比正常组与肝癌组的CT 扫描数据,基于三维可视化技术,对肝脏巨块型肝癌中肝动脉的管径、分支、新生血管等做了初步研究,以实现对肝脏巨块型肝癌供血动脉的精确定位,辅助临床医生判断肝脏巨块型肝癌的供血来源,为介入导航或手术精准预案提供有效依据。
1 资料与方法
1.1 资料
回顾性收集来自河北医科大学第二医院和河北医科大学第一医院在2019年6~12月检查的正常人腹部CT数据93例,其中,男52例,女41例,平均年龄(53.0±16.8)岁,经影像及病理检查未发现肝癌类疾病,设为正常组;回顾性收集河北医科大学与深圳旭东数字影像技术有限公司联合共建的智能医学影像实验室在2019年1~6月所处理的患者腹部巨块型肝癌CT 数据93 例,其中,男66 例,女27 例,平均年龄(52.3±13.4)岁,设为肝癌组。两组患者的一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 设备
1.2.1 实验所用CT 数据实验所用CT 数据层厚为2 mm。选用2 mm 层厚CT 进行实验原因如下:①比2 mm层厚更薄的CT数据需要存储空间更大,占用内存过多:②不同CT 机扫描层厚不同,出来的数据层厚不统一,但2 mm 层厚CT 薄建已统一,便于数据大规模收集和处理;③2 mm已符合临床需求。
1.2.2 实验所用机型及参数CT 扫描机型:GE Optima CT660,肝脏三期扫描参数:120 kV,300 mA,层厚5 mm,层间距5 mm,螺距0.984。三期时间:第一期32 s,第二期60 s,第三期180 s。造影剂:碘克沙醇320,剂量80 mL,速率2.8 mL/s。
1.2.3 分析、重建软件实验应用软件为河北医科大学智能医学影像实验室采用的三维重建软件Intelligent Precise Service(IPS,深圳市旭东数字医学影像技术有限公司研发)。
1.3 诊断
符合巨块型肝癌的标准:依据原发性肝癌诊疗规范(2017年版)判断为巨块型肝癌。
1.4 处理方法
使用IPS 进行三维重建,过程为:将DICOM 格式CT断层扫描图像数据进行分期处理,分出动脉期、门静脉期和平扫期,随后将数据导入IPS 软件并映射成为灰度不同的等级图像,对原始断层图像进行高斯平滑处理,便于血管的提取和肝癌范围的划定。根据阈值分割原理建立三维肝脏时,经软件自动分析给出阈值范围,选用:阈值上限100,阈值下限40,平均阈值70。在门静脉期重建三维肝脏,分别在不同期项进行多期观察,确定肝癌位置,在门静脉期调出肝脏肝癌部分图像,适当调节窗宽窗位,手工划分肝癌范围,利用面绘制的方法重建出肝癌在空间中的位置;应用面绘制的方法在动脉期重建肝动脉血管。将动脉期重建的肝动脉配准至门静脉期,达到重合,以动脉期重建的肝动脉与门静脉期重建的肝脏和肝癌进行组合,使肝动脉更丰富地与肝脏和肝癌进行相关位置间的观察;在动脉期进行肝动脉血管直径、分支数、新生血管的位置等改变的测量及观察,以保证数据的准确性。做出相应统计学分析,进而说明肝巨块型肝癌对肝动脉血管的影响。
1.4.1 肝动脉直径大小手动测量多处位置相同的正常组与肝癌组肝动脉直径。测量血管的横径和竖径,即以一个十字形式测量一处血管直径,取其平均值作为此处血管的直径。测量所有实验数据,计算平均值,对比判断肝癌对肝动脉直径的影响(为保证实验准确性,做人为误差校正)。通过IPS 软件所带有的测量工具分别测量每例数据的肝总动脉、肝固有动脉、肝固有动脉左支、肝固有动脉右支、肝中动脉、胆囊动脉及肿瘤血管的血管起始处直径(图1~图7),对比分析正常组与肝癌组肝动脉直径的差异。
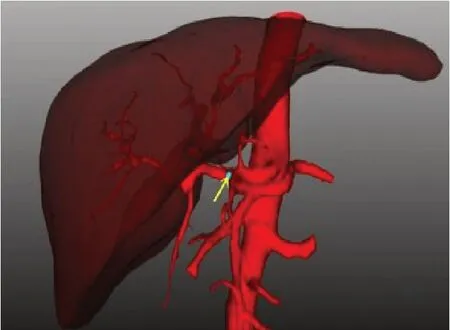
图1 肝总动脉起始处位置Fig.1 The beginning of common hepatic artery
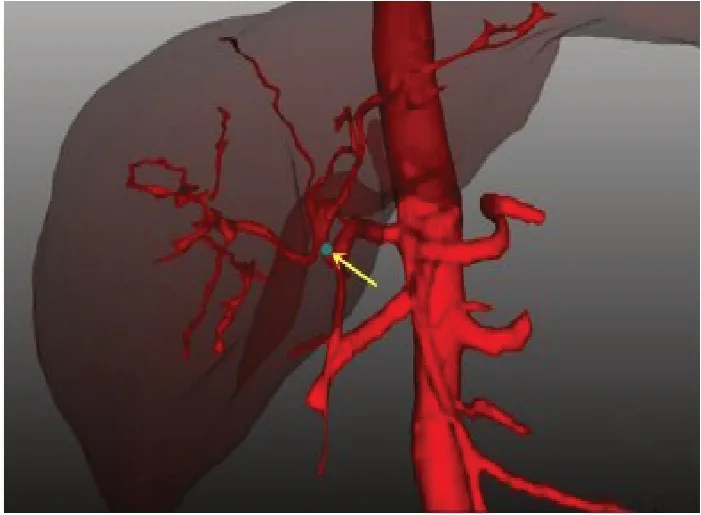
图2 肝固有动脉起始处位置Fig.2 The beginning of proper hepatic artery

图3 肝固有动脉左支起始处位置Fig.3 The beginning of left proper hepatic artery

图4 肝固有动脉右支起始处位置Fig.4 The beginning of right proper hepatic artery
1.4.2 肝动脉分支数量记录肝癌组和正常组各级肝动脉数目(图8),两者比较,判定肝癌对肝动脉数目影响。此项可较为直观地反映出肝动脉血管受肿瘤的影响而新生或闭塞数目的多少,但会有部分血管不显影(图9)。因此,采用大样本计数,以减小误差。

图5 肝中动脉起始处位置Fig.5 The beginning of middle hepatic artery
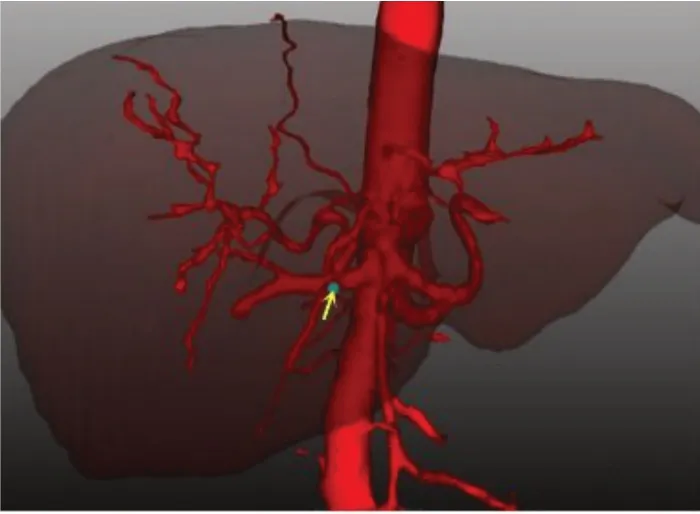
图6 胆囊动脉起始处位置Fig.6 The beginning of cystic artery
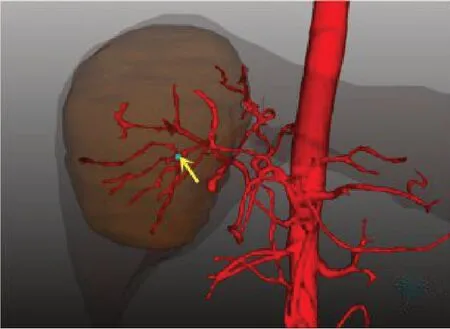
图7 肿瘤血管起始处位置Fig.7 The beginning of tumor vasculature
1.4.3 新生血管的位置将肝癌组分为肝右叶肝癌、肝左叶肝癌、肝中部肝癌3 组,统计分析不同部位新生血管与肝癌肿瘤的位置关系,判定肝癌对新生血管的影响。
1.5 误差
由于测量血管直径时由两人分别完成,存在人为误差。为减小误差,在此设计两组分别、多次测量相同部位血管直径的实验,取其算数平均值,然后进行统计学分析,即两独立样本t检验,使不同人测量的指标达成一致,同时排除单人测量时由于个人原因所导致的误差。经两独立样本t检验,统计无显著差异(P>0.05),可认为两组人测量的数据一致。

图8 计数肝动脉分支数(以肝动脉右支为例)Fig.8 Counting the number of hepatic artery branches(example for right hepatic artery)

图9 黑色箭头示为肝动脉显影末端,其后部分不显影Fig.9 The black arrows show the end of developing hepatic artery andthe parts after it do not develop
1.6 统计学方法
采用SPSS21.0 统计分析软件。计量资料用均数±标准差表示,组间采用配对样本t检验;计数资料采用卡方检验。P<0.05表示差异有统计学意义。
2 结果
2.1 肝动脉直径大小
经测量得到多处肝动脉血管起始处平均直径(肝总动脉、肝固有动脉、肝固有动脉左支、肝固有动脉右支、肝中动脉、胆囊动脉),见表1。经配对样本t检验,肝癌组肝固有动脉、肝固有动脉左支、肝固有动脉右支和肝中动脉起始处平均血管直径均比正常组相应部位血管管径增粗,差异有统计学意义(P<0.05)。
2.2 肝动脉分支数
正常组血管最多可见五级分支,以可见一级分支和二级分支者居多:肝固有动脉左支一级、二级分支分别占总数的47.31%和26.88%,肝固有动脉右支一级、二级分支分别占总数的23.66%和43.01%,其余多为不可见分支或可见三级分支;肝癌组血管可见六级分支,肝固有动脉左支以二级分支多见,占总数的36.56%,其后一级血管较多见,肝固有动脉右支以三级分支多见,占总数33.33%,其后二级血管较多见。经卡方检验,统计肝固有动脉左支正常组与肝癌组肝动脉分支数差异无统计学意义(P>0.05),肝固有动脉右支正常组与肝癌组肝动脉分支数差异有统计学意义(P<0.05),见表2和表3。
表1 正常组与肝癌组肝动脉起始处平均直径(mm,± s)Tab.1 Mean diameter at the beginning of the hepatic artery in matched control group and experimental group (mm,Mean±SD)
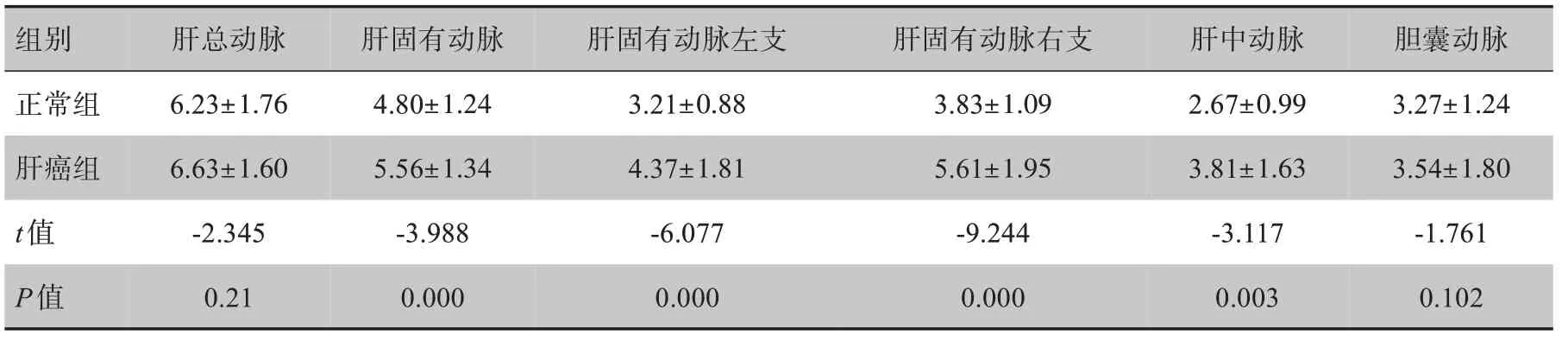
表1 正常组与肝癌组肝动脉起始处平均直径(mm,± s)Tab.1 Mean diameter at the beginning of the hepatic artery in matched control group and experimental group (mm,Mean±SD)
组别肝总动脉肝固有动脉肝固有动脉左支肝固有动脉右支肝中动脉胆囊动脉正常组肝癌组t值P值6.23±1.76 6.63±1.60-2.345 0.21 4.80±1.24 5.56±1.34-3.988 0.000 3.21±0.88 4.37±1.81-6.077 0.000 3.83±1.09 5.61±1.95-9.244 0.000 2.67±0.99 3.81±1.63-3.117 0.003 3.27±1.24 3.54±1.80-1.761 0.102

表2 肝固有动脉左支及其分支情况[例(%)]Tab.2 Left proper hepatic artery and its branches[case(%)]
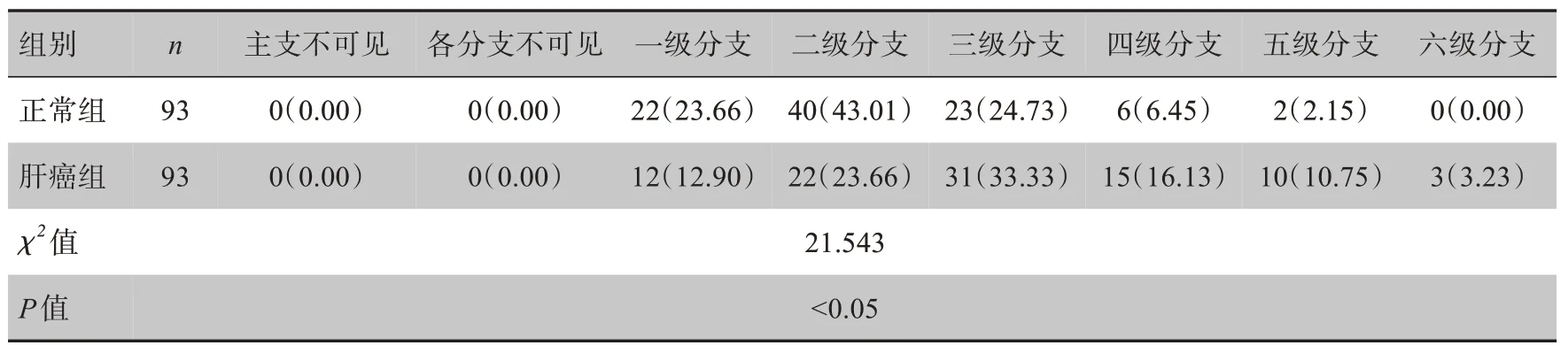
表3 肝固有动脉右支及其分支情况[例(%)]Tab.3 Right proper hepatic artery and its branches[case(%)]
2.3 新生血管的位置
93例肝癌数据中,65例为肝右叶肝癌,15例为肝中部肝癌,13例为肝左叶肝癌。肝左叶肝癌,新生血管包绕肿瘤,并可明显观察到膈动脉在走形过程中,发出分支包绕或嵌入肿瘤(10/13,76.9%),与正常组对比,可认为此为新生血管(图10);肝右叶肝癌新生血管常紧贴肝癌肿瘤走形,之后嵌入其中,大部分呈球状包裹占位(42/65,64.6%)(图11);肝中部肝癌因位置关系受影响较复杂,源自肝左及肝右的新生血管常包绕占位,可呈肝左叶肝癌、肝右叶肝癌或两者均有的表现(图12)。93例肝癌数据中显示,有75.3%(70/93)数据的肝癌肿瘤血管包绕占位,并有59.1%(55/93)数据的肿瘤血管嵌入肿瘤内,有24.7%(23/93)数据的肿瘤血管未显示与肿瘤的明显关系,可能与肿瘤血管过细而不显影或肝癌浸润破坏血管有关。
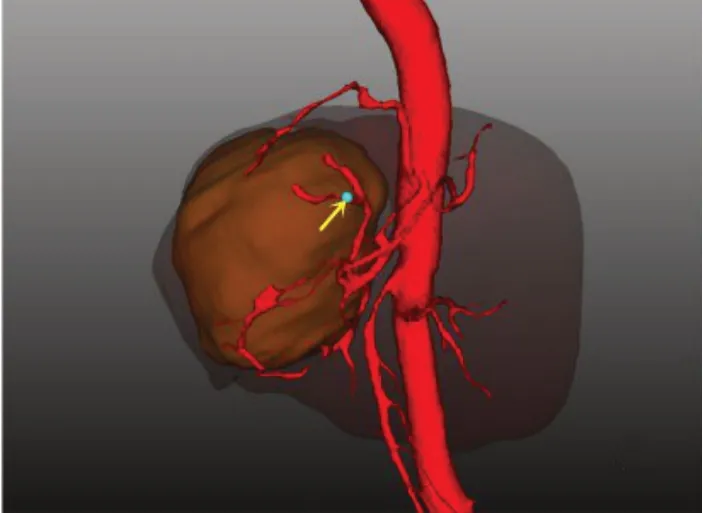
图10 膈动脉沿占位走形,并发出分支Fig.10 Trend of inferior phrenic artery and its branches
3 讨论
三维可视化技术作为近年来新兴的工具技术,通过在三维空间成像,反映物体的各种参数及细节。其在医学领域发展尤为迅猛,已有大量实验研究表明三维可视化技术在检查不同供血类型的肿瘤、显示肿瘤的供血动脉、进行模拟肝切除手术等方面有显著优势[9-10]。可在术前精确地反映肿瘤与血管的解剖关系,对患者进行个体化评估,优化手术方案,降低手术风险;在术中可使手术顺利进行,实现精准操作[11-13]。在三维可视化技术下,可以较好地评估肝脏肿瘤与供血动脉,为介入治疗提供重要参考[14]。
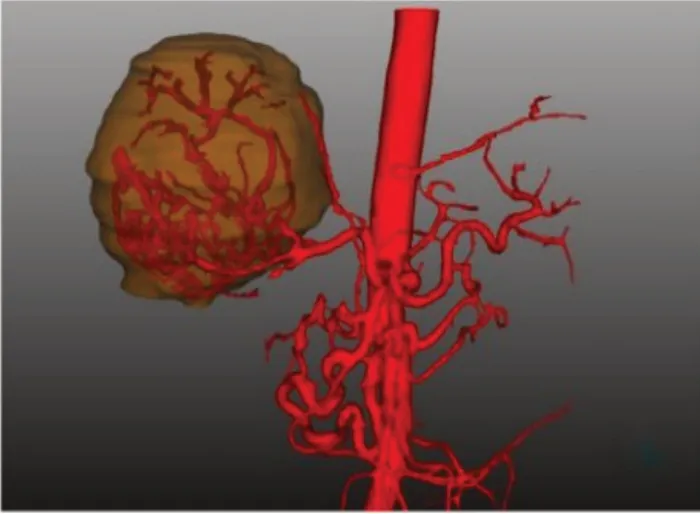
图11 肝右叶肝癌血管呈球状包绕、嵌入肿瘤内Fig.11 The globular right lobe liver cancer blood vessels embed and embed in tumor

图12 肝中部肝癌及血管分布Fig.12 The middle liver cancer and the distributionof vessels
肝癌分为巨块型、结节型和弥漫型。其中,巨块型肝癌约占33%,其内常因血供不足而发生坏死,出现不规则低密度区,且周围常有子灶[15]。巨块型肝癌体积较大,常侵犯多种血管,血供复杂多样,主要由肝动脉供血,其血供可达95%以上[16-17]。因此,在CT动脉期可明显见肝动脉强化及其走形分布。但根据陈信坚等[18]研究显示,有53.33%的肿瘤不能经CT显示其供血动脉,所以有部分动脉血管可能不会显示造影。考虑其原因可能与动脉血管太细或造影剂没有到达有关。巨块型肝癌常有假包膜形成,因此在CT 影像上多数图像边界较规则、清晰,容易辨认肿瘤大小及位置。本次实验观察中,边缘清晰者较少,边界不甚清晰者较多。
正常肝脏组织25%~30%由肝动脉供血,70%~75%由门静脉供血,而肝癌患者的血供则略有不同。对肝癌血供的研究自1923年由Segall 提出[19],经其后学者的研究探索,证实原发性肝癌的血供大部分来自肝动脉。肝癌的动脉供血分为规则性、变异性和寄生性供血。规则性供血为肝脏正常血管为肝癌肿瘤供血;变异性供血则包括腹腔干、肠系膜上动脉、胃十二指肠动脉等供养肝癌肿瘤,其中以肠系膜上动脉为肝癌最常见的变异供血血管;寄生性指除肝脏以外的其它器官的动脉参与营养肝癌肿瘤。另有研究表明,为肝癌供血的血管除肝动脉外,门静脉也参与肝癌肿瘤的供血。有研究者认为在肝脏肿瘤良性期时,以门静脉供血为主,肝动脉为辅;在肝脏肿瘤恶性期时,以肝动脉供血为主,门静脉为辅[20]。
实验统计分析显示,肝癌组肝固有动脉、肝固有动脉左支、肝固有动脉右支和肝中动脉起始处平均血管直径均比正常组相应部位血管管径增粗,差异有统计学意义。同时,由于受肝癌生长需要,肝动脉分支明显增多,出现大量肿瘤血管。其原因与肝癌肿瘤生长需要大量营养及运输代谢废物有关,肝癌肿瘤细胞分泌血管生长因子等物质刺激肿瘤组织产生新生动脉血管,新生血管呈球状包绕肝癌肿瘤,并嵌入肝癌肿瘤内部为其供血。有学者指出,肝动脉血管增粗和肝脏肿瘤血管增多与血管内皮生长因子和血管素2(Angiopoietin 2)的水平有关,当此类因子水平增高,肿瘤血管增生,血供增加,肿瘤生长迅速,肿瘤恶性程度高;反之,则肿瘤血管稀少,肿瘤生长缓慢[21]。
肝癌常侵犯肝脏正常血管,导致其受压变形或闭塞,多数仅可见少量分支,有些甚至不可见肝癌周围正常血管,只见大量血管球,使肝癌处肿瘤血管走形迂曲复杂,难以计数分析。除供应肝脏正常组织血管相对正常外,受肝癌位置、个人差异及其它因素影响,大多数血管位置、走形在空间上并不一致。即使肝癌肿瘤在患者相同部位,也有不同差异。如选取4 例在肝右叶相同位置肝癌肿瘤,通过比较,发现肝动脉有不同程度差异(图13)。肝癌组可见大量新生肿瘤血管呈球状包绕肝癌或嵌入肝癌内,肿瘤血管互相连接形成网状,分支较多且复杂,走形较不规则,除个别血管有其规律外,其余大部分肝癌处肿瘤血管都有不同差异。

图13 不同个体相同部位肿瘤,肿瘤血管分布不均Fig.13 The same position tumors have different tumor vasculature distribution in different patients
综上所述,通过三维可视化技术对肝脏CT 扫描数据的研究发现,肝脏巨块型肝癌可从血管直径、血管分支数及新生血管位置提示肝动脉的变异,为肝脏巨块型肝癌供血动脉的精确定位、判断血供来源提供有效指导,为临床介入导航或手术精准预案提供有效依据。为进一步研究巨块型肝癌动、静脉血管分布规律,以及血管分布与肿瘤进展的相关性,还需纳入更多样本深入研究。
