脱落酸对棉花体细胞胚胎发生的影响
2021-02-05刘佩佩魏喜陈艳丽王晔张桂寅李付广
刘佩佩,魏喜,陈艳丽,王晔,张桂寅,李付广*
(1.河北农业大学/ 棉花生物学国家重点实验室河北基地,河北 保定071001;2.中国农业科学院棉花研究所/ 棉花生物学国家重点实验室,河南 安阳455000)
棉花作为纤维和油料作物,集军需、民用于一体,是重要的经济作物之一[1]。传统育种技术存在优势品种筛选效率低、性状改良方向不可控和品种培育周期长等不足之处,转基因遗传育种成为棉花品种改良的重要工具。 棉花体细胞胚胎发生是棉花转基因育种的主要途径之一, 受基因型、外植体、植物生长调节剂、培养基组分等多种因素影响[2]。 棉花体细胞胚胎发生体系依然存在褐化、畸形、遗传转化率低等问题,因此,建立稳定高效的棉花体细胞胚胎发生体系十分重要。
植物激素的合理使用是植物体细胞胚胎发生发展中的一个里程碑,绝大多数植物体细胞胚胎发生过程中都需要添加一种或多种激素来促进体细胞胚胎发生获得再生植株,外源激素的浓度和类型对细胞命运的转变至关重要[3]。 目前研究最成功的是细胞分裂素和生长素,已广泛应用于多种植物体细胞胚胎发生体系中[4]。 脱落酸作为五大激素之一,主要功能集中在植物细胞形态建成、种子休眠与萌发、逆境胁迫应答方面,同时在体细胞胚胎发生的诱导和调控中也发挥重要作用。 Ge 等研究发现,棉花体细胞胚胎发生过程中,低于0.04 μmol·L-1ABA(Abscisic acid, 脱落酸) 能促进棉花球形胚生长, 高于0.2 μmol·L-1时抑制球形胚发育,0.04 μmol·L-1ABA 能显著增加正常子叶胚的数量, 外源ABA 处理诱导LEC1、LEC2、FUS3 和WUSCHEL 基 因 的 表 达,这些基因的表达调节ABA 和赤霉素的动态平衡促进棉花体细胞胚的产生及成熟[5]。 拟南芥体细胞胚胎发生过程中, 外源添加10 nmol·L-1ABA对拟南芥初级体细胞胚发生基本无影响,而100 nmol·L-1ABA 则明显抑制拟南芥初级和次级体细胞胚的产生; 外源添加10 nmol·L-1氟利酮(内源ABA 合成抑制剂)显著降低拟南芥体细胞胚再生率,1 μmol·L-1氟利酮则使愈伤组织褐化并完全抑制体细胞胚再生;ABA 通过介导生长素生物合成和极性运输,在愈伤组织中建立生长素应答模式,从而在体细胞胚发生启动过程中起作用[6]。 以火炬松合子胚为外植体诱导体细胞胚产生, 外源添加3.7 μmol·L-1ABA 显著提高体细胞胚的起始分化率, 并促进胚性组织生成[7]。ABA 预处理水稻愈伤组织,在合适的剂量范围内ABA 能影响愈伤组织结构,缩短愈伤组织生成再生芽的时间,提高后期植株再生率[8]。枣椰树离体悬浮培养中, 外源添加ABA 能增加糖和蛋白质的积累,提高体细胞胚的产量和成熟度[9]。胡萝卜胚状体发育期, 胚性细胞内源ABA 含量在10 d时达到最大值,13 d 时降至低水平; 非胚性细胞在13 d 时达到最大值,17 d 时降低到低水平,说明ABA 在胚性细胞和非胚性细胞的发育中均具有重要作用; 但胚性细胞内ABA 积累快于非胚性细胞, 胚性细胞中快速积累的ABA 保证了胚性细胞的生长活力高于非胚性细胞[10]。
体细胞胚胎发生过程十分复杂,涉及到差异基因表达、激活或抑制多种信号转导途径[11]。从体细胞转变为体细胞胚的过程中,有一些基因发挥着至关重要的作用,这些基因我们称之为标记基因。与野生型相比,拟南芥lbd16-2 突变体在愈伤组织形成中有749 个基因表达水平显著降低,且lbd16 突变体有显著的芽再生缺陷, 试验结果证明LBD16 通过促进细胞分裂及细胞多能性的获得促进愈伤的形成[12]。 愈伤转变成胚性愈伤的过程中,一些标记基因BBM、AGL15、LEC1、FUS3、ABI3 等有重要的调控作用。 BBM 基因属于AP2/ERF 家族,与分生组织中细胞发育及细胞增殖有关,BBM 异位表达能影响植物激素合成、增加细胞对激素的敏感性从而促进体细胞向胚性细胞的转变[13]。 BBM 通过调控LEC1、FUS3 和ABI3 的表达诱导体细胞胚胎发生[14]。 AGL15 属于MADS 转录因子家族, 能够促进拟南芥和大豆的体细胞胚胎发生[15]。棉花中过表达GhAGL15促进棉花胚性愈伤的形成[16]。 LEC1 能诱导体细胞向胚性细胞的转变, 拟南芥lec1 突变体对ABA 敏感性降低, 异位表达导致畸形胚产生[17]。具有高分化率的CIR24 棉花品种中GhLEC1 和GhFUS3 的表达量显著高于低分化率的棉花品种中两个基因的表达量, 证明LEC1 和FUS3 基因参与棉花体细胞胚胎发生的调控[18]。 体细胞胚发育过程中会伴随着特异蛋白的积累,例如晚期胚胎发生富集蛋白LEA, 研究表明LEA 基因的表达是受脱落酸诱导的,外源添加脱落酸处理后会显著增加LEA 的表达水平[19]。 FUS3 和ABI3 通过介导赤霉素和脱落酸的动态平衡影响体细胞胚胎发生[20],非胚性愈伤组织向胚性愈伤组织的转变过程中伴随着内源ABA 含量的快速升高,而ABI3 的高表达参与ABA 的快速合成。基于上述结果,推测棉花体细胞胚胎发生中,ABA 可能通过影响相关基因表达调控棉花愈伤组织脱分化和胚性愈伤组织分化。
目前,多数研究集中在对体细胞胚胎发生后期胚胎形成过程的调控,愈伤组织脱分化和再分化分子机制仍不明确[21]。 本研究通过外源添加ABA, 研究ABA 对棉花愈伤组织脱分化和胚性愈伤组织分化的影响,为深入研究激素对植物体细胞胚胎发生的影响、棉花愈伤组织脱分化和再分化分子机制,以及优化棉花体细胞胚胎发生体系提供实验基础。
1 材料与方法
1.1 试验材料
以易分化的陆地棉品种中棉所24 无菌苗下胚轴为外植体材料,棉花种子由中国农业科学院棉花研究所转基因研究与应用实验室提供。 浓硫酸脱绒后挑选成熟饱满的棉花种子,用3%(体积分数)的双氧水避光浸泡消毒10 h,灭菌蒸馏水冲洗4 次,接种于无菌苗培养基,暗培养5 d,光培养1 d。 在超净工作台中取棉花下胚轴切成5~7 mm切段,置于MSB 培养基中培养。 棉花无菌苗和下胚轴均置于恒温(28±2)℃恒湿培养室中培养。
棉花无菌苗培养基成分:大量元素MSⅠ[31]50 mL·L-1,蔗糖28 g·L-1,琼脂粉5.5 g·L-1,纯净水溶解。 培养基使用高压灭菌锅121 ℃灭菌14 min 后冷却备用。 MSB 培养基[31]成分:大量元素MSⅠ50 mL·L-1, 微量元素MSⅡ5 mL·L-1,B5维生素5 mL·L-1, 铁盐5 ml·L-1葡萄糖28 g·L-1,琼脂粉5.5 g·L-1,纯净水溶解,pH 调至6.0。 培养基使用高压灭菌锅121 ℃灭菌14 min,待培养基降温至45~50 ℃时按浓度需求添加过滤除菌后的ABA 溶液。
1.2 试验设计
设置0、0.02、0.04、0.06、0.08 μmol·L-1ABA(分别用A0、A1、A2、A3、A4 表示), 分别添加至MSB 培养基,以A0 为空白对照。 无菌条件下将下胚轴切段以每瓶6 段的数量均匀放置在培养基上,置于培养室同一区域培养,观察棉花下胚轴脱分化和再分化过程。 下胚轴接种至含ABA的MSB 培养基当天记为0 d,30 d 时继代1 次至相同培养基, 文中培养时间均为下胚轴培养时间。 每种浓度处理120 段下胚轴切段,以60 段为1 组,分为2 组重复。
1.3 形态观察
采用石蜡切片法观察下胚轴初始细胞脱分化。 下胚轴培养5 d 时取样制成纵切切片, 使用Olympus 荧光显微镜观察。 组织培养过程中,愈伤组织生长状态均使用体式显微镜观察[22]。
下胚轴培养20 d 时,将愈伤组织按以下标准分为3 种类型:大型(Large,L),切段两端均生成愈伤组织,含水量高,有少量霜状的愈伤细胞团存在;中型(Medium,M),切段一端生成愈伤组织,一端有少量愈伤组织或霜状组织,总体生长速度缓慢;小型(Small,S)型,切段两端均无愈伤组织生成,只有少量致密、霜状组织,下胚轴基本为未分化状态。
1.4 愈伤和胚性愈伤(脱)分化率、增殖率统计
愈伤脱分化率 (Callus dedifferentiation rate,CDR), 即已脱分化形成愈伤组织的外植体数量与初始外植体总数的比值。愈伤增殖率[23](Callus proliferation rate,CPR), 即培养一定时间后形成愈伤组织的外植体增加的重量与初始外植体鲜重的比值。 胚性愈伤分化率(Embryogenic callus differentiation rate,ECDR),即继代培养一定时间后分化形成胚性愈伤组织的愈伤组织块数量与继代愈伤组织块数量的比值。 胚性愈伤组织增殖率(Embryogenic callus proliferation rate,ECPR),即继代培养一定时间后形成胚性愈伤组织的外植体增加的重量与初始外植体鲜重的比值。 非胚性愈伤组织增殖率 (Non-embryogenic callus proliferation rate,N-ECPR),即继代培养一定时间后为非胚性愈伤组织的外植体增加的重量与初始外植体鲜重的比值。
1.5 基因表达分析
通过荧光定量PCR (Quantitative real-timepolymerase chain reaction,qRT-PCR) 分析LBD16(Gh_A11G1186)、LBD29 (Gh_D11G1344)、BBM(Gh_A08G2008)、LEC1(Gh_D05G1686)、AGL15(Gh_D08G162500)、FUS3 (Gh_A07G2123)、LEA(Gh_A10G1465)、ABI3(Gh_A07G2239)基 因 表达变化。反转录使用TaKaRa 公司的RT Reagent Kit with gDNA Eraser 试剂盒,Real-time PCR 使 用 SYBR Premix Ex Taq(DRR041A) 荧光定量试剂盒, 引物序列见表1,反应体系和反应程序均参考试剂盒说明书。 内参基因为GhHistone3,每个反应设置3 次重复。

表1 本研究中使用的引物Table1 Primers used in this study
1.6 数据处理与分析
试验统计数据使用DPS 软件进行处理与分析,以最小显著差数法(The least significant difference,LSD)进行显著性检验。 基因表达量使用2-△△Ct方法计算, 采用t 检验法进行显著性检验。试验作图使用GraphPad Prism 5 软件。
2 结果与分析
2.1 外源添加ABA 促进下胚轴初始细胞脱分化
以MSB 为基础培养基, 设置梯度浓度脱落酸, 研究脱落酸对下胚轴初始细胞脱分化的影响。 无菌苗生长过程主要为黑暗处理,棉花下胚轴呈现为白色,培养至5 d 时,外植体整体转为绿色, 体式显微镜下可观察到切段两端轻微膨起,在切段伤口处生成少量愈伤组织(图1A)。 通过石蜡切片可观察到初生形成层细胞快速分裂,愈伤组织细胞团由内向外涌出,A1、A2、A3、A4 处理下愈伤组织量均大于A0 处理,且ABA 浓度越高愈伤组织量越大(图1A)。取5 d 时下胚轴提取RNA, 对GhLBD16 和GhLBD29 进行qRT-PCR定量分析,结果显示,A1、A2、A3、A4 处理下两个基因表达量均极显著高于A0 处理(图1B)。综合该试验结果可以认为,棉花体细胞胚胎发生中外源ABA 通过显著上调GhLBD16 和GhLBD29的表达量促进下胚轴初始细胞脱分化。
2.2 外源添加ABA 促进棉花愈伤组织脱分化
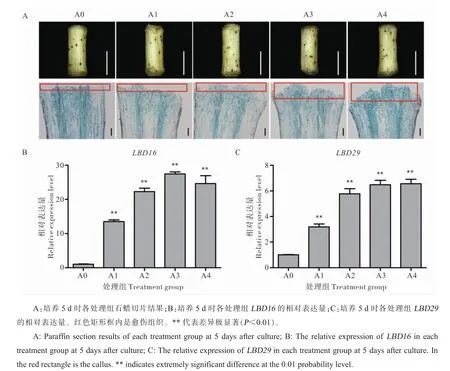
图1 ABA 对下胚轴初始细胞脱分化的影响Fig. 1 Effect of ABA on dedifferentiation of initial cellular in hypocotyl
培养下胚轴时,脱落酸显著促进愈伤组织脱分化。 培养20 d 时的愈伤组织按形态分为L、M、S 共3 种类型(图2A)。 由图2B 可以看出,A0 愈伤分化集中于速度较慢的M 型,A1、A2、A3、A4处理下则是集中于快速分化的L 型。 统计L、M、S 型愈伤组织所占比例(图2B),发现培养基中添加ABA 显著增加L 型愈伤比例,降低M 和S 型愈伤比例。以L 型愈伤为标准统计愈伤脱分化率(图2C),20 d 时,A0 处理CDR 为15.1%左右;与A0 相比,A1、A2、A3、A4 处理下CDR 为71.6%~84.3%,ABA 显著促进愈伤脱分化。A4 处理CDR显著高于A1、A2;A4 和A3 处理CDR 无显著差异,表明ABA 浓度越高促进效果越明显。结果表明, 外源添加脱落酸显著促进愈伤组织脱分化,显著提高愈伤组织脱分化率, 且高浓度ABA(A4)较低浓度ABA(A1、A2)对愈伤脱分化的促进效果更显著。
2.3 外源添加ABA 促进愈伤组织增殖
各组处理下, 培养至10 d、20 d 时愈伤组织颜色、质地等无显著差异(图3A)。 培养至30 d时,A0、A1、A2 处理下愈伤组织为绿色,A3 和A4处理下愈伤组织为较深的黄绿色,质地无明显差异(图3A)。 20 d 和30 d 时A1、A2、A3、A4 处理下愈伤体积明显大于A0 处理, 愈伤组织增殖率可以反映出愈伤组织生长速度,称量20 d 和30 d时L 型愈伤组织鲜重,计算CPR(图3B)。20 d 时A0 处 理 的CPR 为3.8,A1、A2、A3、A4 处 理 的CPR 较A0 分别提高2.4、2.4、3.2、2.5, 显著高于A0 处理。 30 d 时A0 处理的CPR 为10.2,A1、A2、A3、A4 处理的CPR 较A0 分别提高5.9、4.7、4.3、2.9,显著高于A0 处理。 A1、A2、A3、A4 处理在20 d 时无显著差异,30 d 时A1 处理的CPR 显著高于A4 处理的CPR, 表明低浓度ABA 对愈伤增殖更有利(图3B)。研究结果证明外源ABA 显著促进愈伤组织增殖,0.02~0.06 μmol·L-1ABA 促进愈伤组织增殖的效果优于0.08 μmol·L-1ABA。
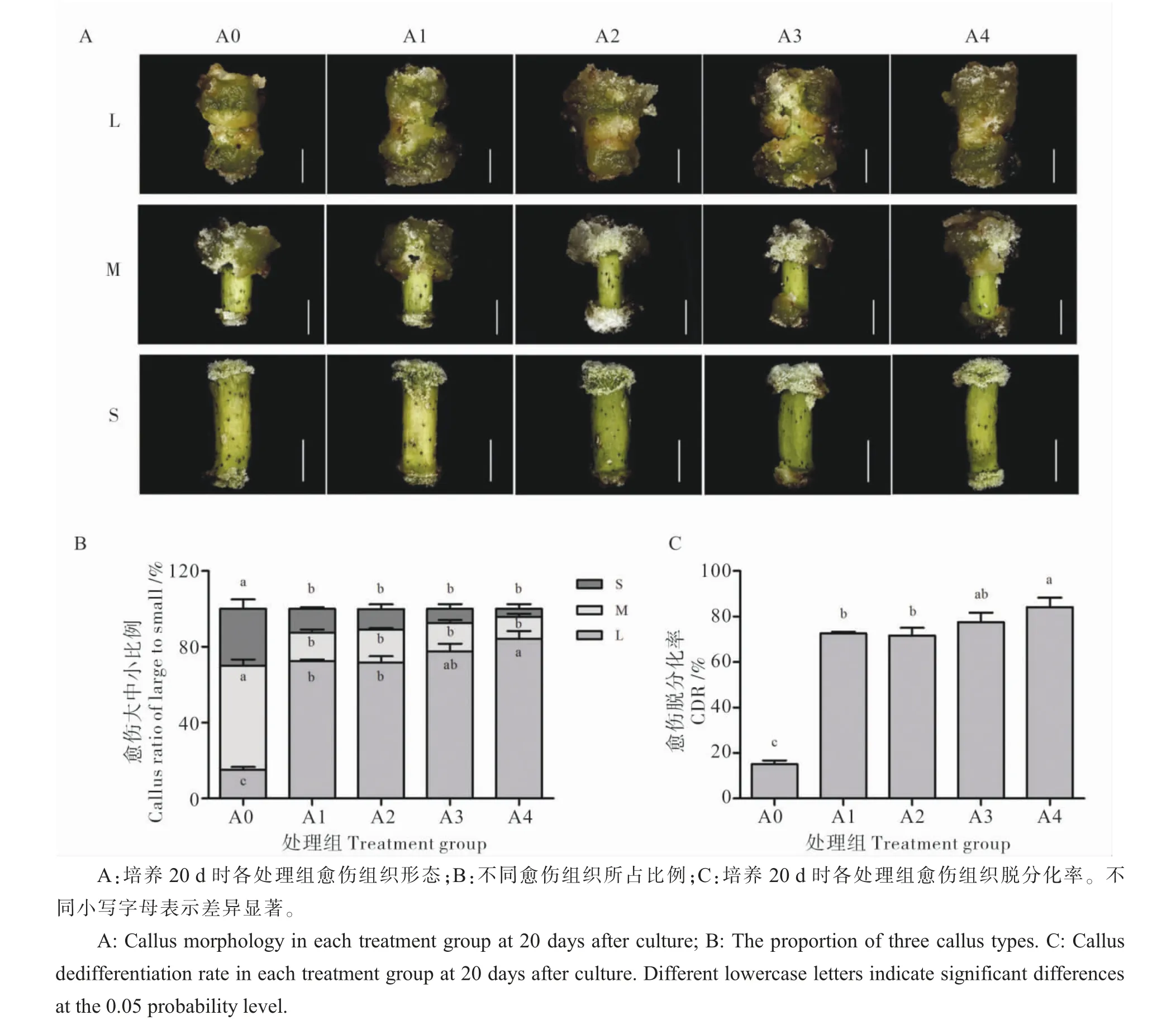
图2 ABA 对愈伤组织脱分化的影响Fig. 2 The effect of ABA on dedifferentiation of callus
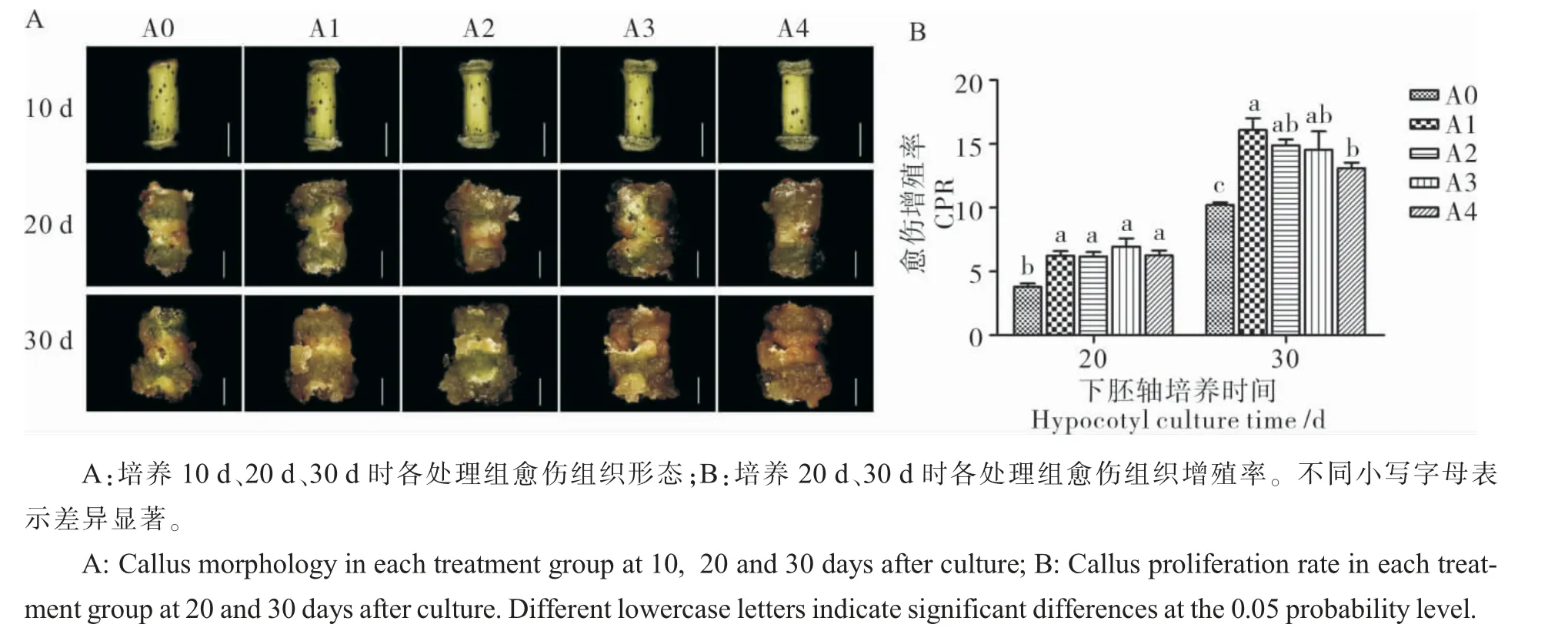
图3 ABA 对愈伤组织增殖的影响Fig. 3 The effect of ABA on proliferation of callus
2.4 外源ABA 对胚性愈伤组织分化和增殖的影响
试验证明,淡黄色、松散、米粒状胚性愈伤组织更容易在后期诱导培养中分化形成体细胞胚。培养55 d 时, 各处理下胚性愈伤组织在形态、颜色(图4A)和分化率(图4B)差异明显。A0 处理下胚性愈伤组织呈淡黄色、质地疏松、米粒状,愈伤组织颜色偏绿;A1、A2 处理下胚性愈伤组织同样质地疏松、呈淡黄色米粒状,但愈伤组织为淡黄色;A3、A4 处理下胚性愈伤组织整体呈稀软、灰白色颗粒,基础愈伤组织块小且颜色偏黑。 培养35 d、45 d、55 d 时胚性愈伤分化率统计结果显示,35 d 时A0 处理的ECDR 为7%,A1 处理显著高于A0 为19%,A2、A3 处理与A0 相比无显著差异,A4 处理显著低于A0 为3%;45 d 时A0处理ECDR 为28%,A1 处理为39%, 显著高于A0,A2、A3、A4 处理显著低于A0;55 d 时A0 处理为42%,A1 处理为43%, 与A0 相比无显著差异,A2、A3、A4 处理显著低于A0。 45 d 时统计胚性愈伤增殖率(ECPR),A0 处理为23.0,A1、A2、A3、A4 处理的ECPR 均显著高于A0, 其中最低是A2 处理,为28.2,最高是A1 处理,为36.5(图4C)。 结果表明,在愈伤分化阶段和胚性愈伤分化阶段持续添加外源ABA, 虽然0.02~0.08 μmol·L-1ABA 都促进胚性愈伤增殖,但低浓度(0.02 μmol·L-1)ABA 促进胚性愈伤分化,而高浓度(0.04~0.08 μmol·L-1)ABA 抑制胚性愈伤分化。
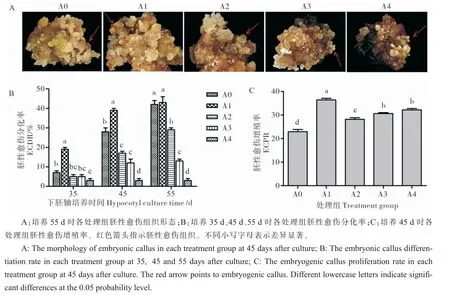
图4 ABA 对胚性愈伤组织的影响Fig. 4 The effect of ABA on embryonic callus
2.5 外源ABA 对非胚性愈伤组织的影响
外源ABA 处理对非胚性愈伤组织的颜色、质地、增殖率也产生了显著影响。 如图5A,培养45 d 时,A0 处理非胚性愈伤组织颜色偏绿、结构致密、质地较硬、少量霜状组织,A1 和A2 处理下非胚性愈伤为淡黄色、结构松散、质地较软、少量霜状组织,A2 处理颜色较A1 处理偏黄、A3 和A4 处理非胚性愈伤为褐色发黑,稀泥状、含水量较高, 随ABA 浓度升高非胚性愈伤组织颜色由黄绿色向黑色加深。与A1 相比,A2、A3、A4 处理造成的逆境胁迫大, 非胚性愈伤组织质地变差。统计45 d 时N-ECPR,A0 为26.1, 与A0 相比,A1、A2、A3、A4 处 理 的N-ECPR 提 高7.9~13.9(图F), 均显著高于A0 处理。 外源添加低浓度(0.02 μmol·L-1)ABA 显著促进非胚性愈伤组织的增殖,改善非胚性愈伤组织生长状态,高浓度ABA 则抑制非胚性愈伤分化, 进一步证明ABA对愈伤组织分化有重要作用。
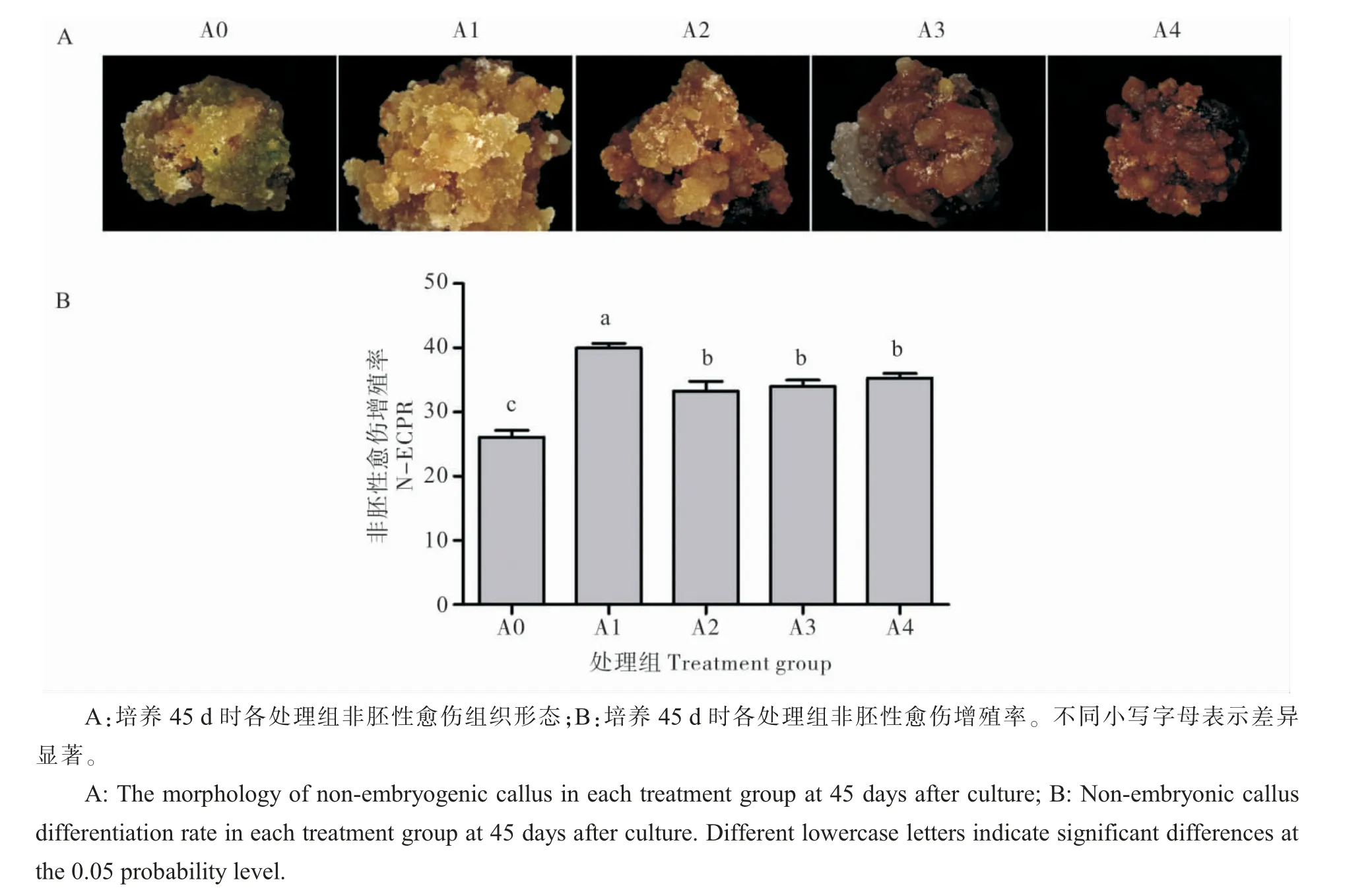
图5 ABA 对非胚性愈伤组织的影响Fig. 5 ABA effect on non-embryogenic callus
2.6 愈伤组织脱分化阶段体细胞胚胎发生相关标记基因表达分析
外源ABA 处理棉花下胚轴对愈伤脱分化和再分化有显著影响,推测脱落酸可能通过调控体细胞胚胎发生相关基因的表达来促进或抑制愈伤组织的脱分化和胚性愈伤组织的分化。 在愈伤组织诱导阶段和胚性愈伤组织诱导阶段,A1 处理对下胚轴的综合影响效果最优,因此,本研究针对A0 和A1 处理对一些体细胞胚胎发生相关的标记基因进行定量分析。 A0、A1 处理下培养15 d、20 d 和30 d 的下胚轴分别取样对AGL15、LEC1、BBM、FUS3、LEA、ABI3 进行荧光定量分析。15 d 和20 d 时,与A0 相比A1 处理均显著提高BBM 表达量,但20 d 时差异更显著(图6A)。LEC1 表达在15 d 时不受ABA 的影响,20 d 时被ABA 诱导显著上调表达(图6B)。 AGL15 表达在15 d 时被ABA 抑制,20 d 时被诱导显著上调表达(图6C)。 FUS3 表达在20 d 时不受ABA的影响,30 d 时被ABA 诱导显著上调表达 (图6D)。培养至20 d 和30 d 时,与A0 相比A1 均显著提高LEA 表达量, 但30 d 时差异更显著(图6E)。ABI3 表达在20 d 时不受ABA 的影响,30 d时被ABA 诱导显著上调表达(图6F)。 综上所述,ABA 诱导的体胚发生标记基因的表达有时空特异性,不同时间点诱导的基因不同,愈伤增殖早期和中期0.02 μmol·L-1ABA 诱导了BBM、LEC1 和AGL15 基因的表达,愈伤增殖后期激活FUS3、LEA 和ABI3 的表达, 这些体胚发生相关基因表达水平的增加是ABA 调控体细胞胚胎发生的基础。
3 讨论

图6 qRT-PCR 分析基因的表达量Fig. 6 Analysis of the gene expression by qRT-PCR
棉花体细胞胚胎发生普遍经历愈伤组织诱导、胚性愈伤组织诱导、体细胞胚诱导和再生苗诱导4 个阶段[24],在此过程中涉及到复杂的信号网络转导和以特定方式调控的相关基因表达模式的重新编程。 本研究通过外源添加ABA 处理外植体,研究ABA 对棉花体细胞胚胎发生的影响,以期对体细胞胚胎发生遗传机制的研究做出些许贡献。
3.1 ABA 对下胚轴初始细胞脱分化的影响
初始细胞脱分化伴随着表皮细胞的扩张,初始形成层细胞进入快速分裂期,初始细胞脱分化是体细胞命运转变的开始,对后期愈伤组织生长和胚性愈伤组织分化具有重要意义[25]。 在拟南芥中过表达AtLBDs 基因能够使外植体在不添加外源生长素的培养基上长出愈伤组织, 而LBD 基因表达被抑制后, 愈伤组织不能被诱导, 提示LBD 基因在愈伤组织形成过程中必不可少[26]。 本研究中,棉花下胚轴初始细胞脱分化阶段,新生的愈伤组织细胞团由内而外涌出, 随着ABA 浓度升高愈伤组织细胞数量显著增加。 同时,A1、A2、A3、A4 处理下GhLBD16 和GhLBD29 基因表达量极显著高于A0。结果表明,外源添加ABA显著上调GhLBD16 和GhLBD29 基因的表达,促进了愈伤组织形成。
3.2 ABA 对愈伤组织脱分化和增殖的影响
陈军营等研究显示,0.1 mg·L-1的脱落酸对小麦愈伤组织诱导效果最好[27],而周玲艳等认为一定量的脱落酸使水稻愈伤组织的分裂生长受到抑制[28]。研究结果表明,不同的植物愈伤诱导阶段对脱落酸的敏感性不同,作用也不唯一。 愈伤组织脱分化和愈伤组织增殖是紧密相关的,愈伤组织脱分化率高的同时,愈伤组织的适度增殖也有利于后期胚性愈伤组织的形成。本研究中,A1、A2、A3、A4 处理能显著提高愈伤组织分化率和增殖率,脱落酸对棉花愈伤组织的形成具有正向诱导的作用。 在玉米体细胞胚胎发生过程中,AGL15-like 和BBM 基因表达量在玉米幼胚到脱分化过程中显著上调,ZmLEC1 表达量显著下调[29]。 本研究中,愈伤脱分化和增殖过程中,A1处理下AGL15、BBM 和LEC1 表达量均显著高于A0, 外源ABA 可能通过诱导这些基因的表达从而促进愈伤脱分化和增殖。 玉米中LEC1表达量下调,棉花中LEC1 上调,可能是单子叶和双子叶植物中LEC1 的时空特异性表达模式不同。
3.3 ABA 对胚性愈伤组织分化的影响
胚性愈伤组织是愈伤组织进一步再分化形成的,细胞胚性能力的获得不具有普遍性,只有少量愈伤组织分化成胚性愈伤。 胚性愈伤组织的质量主要取决于前期愈伤组织的脱分化情况。 在胡萝卜细胞培养中, 愈伤组织中内源ABA 含量基本不变, 而在诱导产生胚性细胞时ABA 含量显著升高, 并在体细胞胚时期保持较高含量,说明ABA 含量的增加对愈伤组织细胞转变成胚性细胞有促进作用[30]。 试验结果显示,A1 处理下胚性愈伤组织分化率显著高于A0, 而A2、A3、A4处理下胚性愈伤组织分化率显著低于A0。4 个处理均显著促进愈伤组织增殖, 随着ABA 浓度的增加,愈伤增殖率提高,愈伤组织脱分化阶段过量细胞增殖不利于胚性愈伤组织的形成。 相似的研究也表明,棉花组织培养过程中,利用不同红蓝配比的光质控制愈伤增殖,发现愈伤组织适度增殖有利于胚性愈伤组织分化,过度增殖可能起相反作用[31]。 因此适宜浓度的ABA 能平衡愈伤组织增殖和胚性愈伤分化, 高浓度的ABA 造成愈伤组织过度增殖及后期胚性愈伤组织分化不理想。 本研究发现0.02 μmol·L-1ABA 对棉花下胚轴胚性愈伤分化有正向作用,本试验浓度之外的ABA 对棉花体细胞胚胎发生的作用有待进一步研究。
3.4 ABA 调控体细胞胚胎发生相关基因的表达
愈伤组织向胚性愈伤组织的转变过程中伴随着内源ABA 含量的快速升高, 进而通过调控FUS3 和ABI3 等基因的表达影响体细胞胚胎发生。 本研究结果表明,ABA 处理后,体细胞胚胎发生相关标记基因的表达发生变化,ABA 可能通过改变内源ABA 水平诱导体细胞胚胎发生相关基因表达,进而影响愈伤组织脱分化和胚性愈伤组织分化。 A1 处理, 培养20 d 时愈伤组织中LEC1 和BBM 表达量显著上调,30 d 时愈伤组织中FUS3、LEA 和ABI3 表达量显著上调,证明脱落酸通过时空特异性的调节上述基因的表达从而影响胚性愈伤组织的分化。 脱落酸处理下,体细胞胚胎发生相关基因表达量的变化及其具体涉及和作用的激素信号作用网络需进一步通过转录组分析等开展研究。 值得注意的是,在表型观察中发现A2、A3、A4 处理中胚性愈伤分化率降低、胚性愈伤组织质地变差,推测高浓度的ABA 可能产生较强的逆境, 大多细胞在这种逆境条件下死亡,只有少量胚性愈伤产生。 A1 处理体胚发生相关的标记基因表达量显著升高,胚性愈伤分化率显著高于A0, 其可能的原因是适度的逆境胁迫,加上体胚发生标记基因的激活,共同导致愈伤组织分化成胚性愈伤组织。 正如生长素多用于愈伤组织诱导阶段, 在胚性愈伤组织诱导阶段则需要降低生长素浓度; 脱落酸也是主要在愈伤诱导阶段发挥正调控作用, 胚性愈伤诱导阶段不添加脱落酸或者使用较低浓度的脱落酸是否能提高胚性愈伤获得率需要进一步的研究。
4 结论
棉花下胚轴初始细胞脱分化、愈伤组织和胚性愈伤组织诱导阶段对ABA 敏感性和响应机制不同。 在下胚轴初始细胞脱分化中,ABA 能诱导LBD16 和LBD29 基因高表达, 促进愈伤组织快速形成。 在棉花愈伤组织和胚性愈伤组织发育过程中,ABA 显著提高愈伤组织、胚性愈伤组织和非胚性愈伤组织增殖率,0.02 μmol·L-1ABA 处理诱导BBM、AGL15、LEC1、FUS3、ABI3、LEA 基因的表达,并显著提高胚性愈伤组织分化率,0.04~0.08 μmol·L-1ABA 抑制胚性愈伤组织分化。
