马早期流产相关功能基因挖掘的研究
2021-02-05吴海青马跃军苏少锋萨初拉付绍印高文渊李玉荣
吴海青,刘 威,马跃军,苏少锋,萨初拉,付绍印,高文渊,李玉荣
(1.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031;2.内蒙古自治区草原工作站,内蒙古 呼和浩特 010018)
流产是造成马繁殖率降低的重要原因。 据报道,舍饲马流产率约为10%,群牧马流产率更高,可达30%[1]。 马匹流产中早期流产占比最大,达到88%。 在相同饲养环境下,马群中总是存在少数配种后45 d 以内通过直肠检查胚胎正常发育,但在2~4 个月后出现流产的现象, 该现象也造成马匹发情观察延误,导致马匹空怀[2]。 早期流产的影响因素较多,包括营养水平、繁殖疾病、细菌病毒感染、激素水平变化、胚胎着床等[3]。 对马而言,营养水平、 繁殖疾病和细菌病毒感染等外源因素引起的流产,可以通过提高饲养管理水平、药物治疗和环境消毒等措施避免。但激素分泌、胚胎着床等内源性因素与相关基因的表达密切联系, 是较难解决的, 通常这部分马匹在调整马群结构过程中被逐步淘汰。
胚胎着床的分子机理较为复杂。 参与胚胎着床的相关因子包括细胞黏附分子、钙黏分子、免疫球蛋白超家族细胞因子、表皮生长因子、细胞集落刺激因子等[4]。 参与胚胎着床的信号通路有Wnt信 号 通 路[5-6]、整 合 素 信 号 通 路[4]、MAPK 信 号 通路[7]、昼 夜 节 律 信 号 通 路[8]、钙 离 子 信 号 通 路[9]、Notch 信 号 通 路[10]等。 王 健[11]研 究 发 现E4BP4、RGS2、ISP2、MNSFβ、EMO-1、EMO-2 等基因与小鼠胚胎着床显著相关。 促性腺激素释放激素(gonadotropin-releasing hormone,GnRH) 除了促进卵母细胞发育成熟,还对胚胎着床有重要作用。研究表明,GnRH 受体 (gonadotropin-releasing hormone receptor,GnRHR)被GnRH 激活后,会提高滋养层细胞分泌绒毛膜促性腺激素的水平, 从而促进胚胎着床;GnRH 也可以显著提高雌激素的分泌水平,同时提升黄体分泌孕酮的水平,从而促进胚胎发育[12]。
早期流产是制约马产业发展的重要因素。 目前关于马匹早期流产或胚胎着床的相关基因鲜有报道。 该研究通过对发生早期流产的母马和正常分娩的母马进行基因组测序分析, 以期挖掘与早期流产或胚胎着床相关的SNP 及功能基因, 为揭示引起马匹早期流产的原因提供生物信息学方面的参考数据。
1 材料与方法
1.1 试验用马选择与分组
2018 年6 月,在内蒙古可汗御马苑有限公司进口马纯繁群中选择配种后45 d 能够检查到胚胎, 但2~4 个月后发生流产的母马10 匹 (流产组),以及能正常分娩的母马10 匹(分娩组)。两组马匹的饲养管理条件一致。 所有母马年龄5~14岁,均为参配母马,无繁殖疾病,品种为走马和纯血马。 试验用马的基本信息见表1。
1.2 全基因组提取及测序
1.3 全基因组重测序数据处理
利用FastaQC(version 0.10.1)对数据质量进行评估,质控过滤后的测序reads 通过BWA 软件比对到马参考基因组(ftp://ftp.ensembl.org/pub/release-91/fasta/equus_caballus/dna/Equus_caballus.EquCab2.dna_sm.toplevel.fa.gz), 应用SAMtools 软件对比对结果进行排序; 然后用Picard 标记重复序列,使用GATK 和SAMtools 软件,分别将比对后得到的bam 文件在含有插入或缺失突变的区间进行区域内重新比对, 最后获得所有试验个体的单核苷酸多态位点(SNP)和短插入缺失(INDEL)数据集。 利用var 命令分别鉴定Germline SNV 和INDEL, 利用Manta 算法鉴别Germline SV, 利用Control-Freec 算法鉴别Germline CNV。

表1 试验用马的基本信息
1.4 选择信号检测
以不同的性状进行分组, 在全基因组范围内进行选择性消除分析。 在常染色体上使用100 kb大小的窗口进行扫描, 对每个窗口计算Fst 值;同时, 以相同大小的滑动窗口对2 个群体进行碱基多态性π 值的计算, 检测受选择的区域。 将通过Fst 值和π 值分析得到的区域进行联合分析。
1.5 选样区域的候选基因注释、GO 分析和通路分析
对鉴别出的被选择区域进行注释, 找出区域内的基因。进一步对基因进行功能注释,得到基因对应的GO term 及信号通路富集。
2 结果与分析
2.1 全基因组重测序
试验用马经基因组重测序共获得501 Gb 的有效数据, 以及3.64×109个reads,96%以上的reads 100%对应到参考基因组上;每匹马基因组的平均序列覆盖率为97%,GC 含量平均占比47.2%;单核苷酸多态性(SNPs)为每匹马4.2×106个(见表2)。
2.2 选择性消除与候选基因筛选
通过流产组和分娩组SNP 比对Fst 分析,共有1 381 个SNP 位点(见图1)。 π 分析共有1 614个SNP 位点(见图2)。 联合分析得到203 个SNP位点,过滤掉突变基因间区域、非编码区域、内含子和同义SNV 后得到82 个SNP 位点,定位于69个基因上(见图3)。 通过GO term、信号通路富集分析及参阅文献,筛选出其中的12 个基因为马早期流产和胚胎着床的重要候选基因,包括TGIF1、RORB、RICTOR、Pts、MAML3、LHCGR、GNRH1、Erc1、EIPR1、DHRS4、PRKACB 和BCO1(见表3)。
3 讨论
马匹早期流产多数是由于胚胎不能着床或发育停滞引起的。 着床是胎生哺乳动物的胚泡和母体子宫壁结合, 从而建立母子间结构上的联系以实现物质交换的过程。着床的条件包括:透明带消失;胚泡细胞滋养细胞分化出合体滋养细胞;胚泡和子宫内膜同步发育且功能协调; 有足够水平的孕酮,子宫有一个极短的敏感期允许受精卵着床。这些过程需要激素的精准调控, 以及相应信号通路的调节, 以保证胚泡和子宫内膜同步发育以及胎儿着床继续发育。
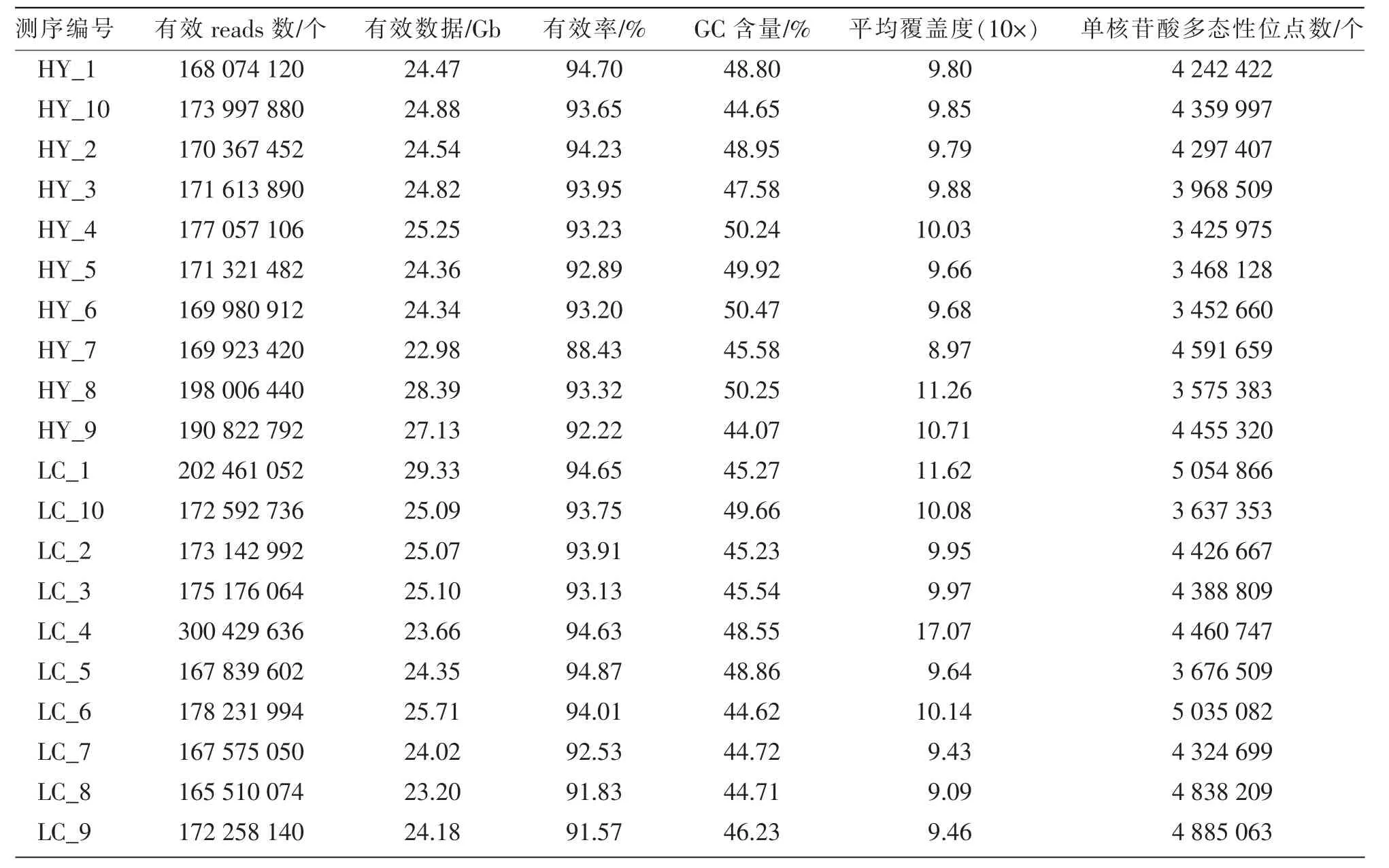
表2 试验用马基因组重测序数据
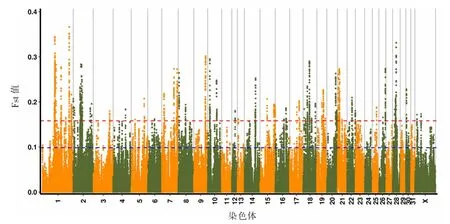
图1 流产组和分娩组比对Fst 分析
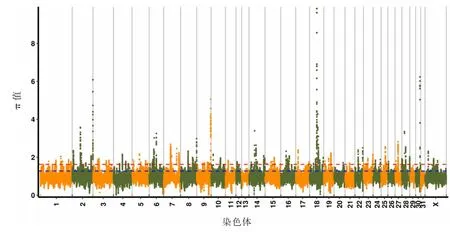
图2 流产组和分娩组比对π 分析
GnRH 是由下丘脑分泌的一种生殖激素,是由10 个氨基酸组成的肽段。 GnRH 在哺乳动物中有3 个亚型:GnRH1、GnRH2 和GnRH3。 GnRH1的主要作用是刺激绒毛膜促性腺激素的释放。GnRH 通过结合脑垂体上的GnRHR,促进黄体生成素和卵泡刺激素的分泌, 随后刺激性腺分泌相关的甾类激素。GnRHR 是有7 个跨膜域的G 蛋白偶联受体。 越来越多的研究证实,GnRHR 不仅在脑垂体表达,在雌性生殖器官中也有表达,如子宫肌层、子宫内膜、卵巢、胎盘、乳腺等[13]。 李颖等[12]报道,GnRH/GnRHR 系统参与胚胎着床和早期发育,具有调节子宫内膜、胎盘、卵巢功能以及支持黄体等作用。 子宫中雌激素和孕激素受体的表达受到昼夜节律调节。 孕酮与子宫内膜孕激素受体作用促使内膜细胞分化至分泌期, 利于胚胎的着床。 RORB 基因是RORs 基因家族的成员,该家族的转录具有节律性,可以控制昼夜节律基因Bmal的表达, 小鼠缺失RORB 基因导致生物钟节律异常。 昼夜节律相关基因直接或间接影响GnRH 的阵发性分泌, 从而调节下丘脑—垂体—卵巢轴的内分泌功能[14]。 由此可知,RORB 基因突变会影响内分泌轴功能,在胚胎着床调节中具有重要作用。因此, 该研究中筛选出的RORB 和GNRH1 基因可能是胚胎着床的重要候选基因。
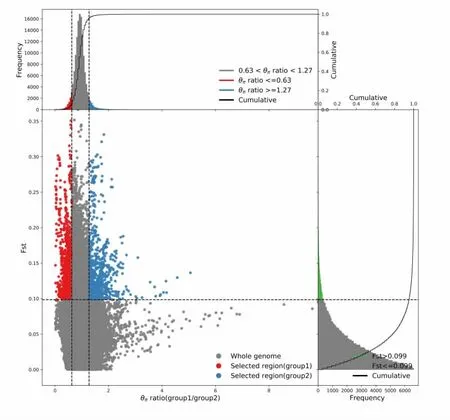
图3 流产组和分娩组比对Fst 和π 联合分析

表3 马早期流产候选基因
胚胎着床需要通过多条信号通路促进胚胎发育以及改善子宫内膜容受性来实现。 哺乳动物的雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR) 是一种进化上非常保守的丝氨酸/苏氨酸蛋白激酶, 属于磷脂酰肌醇激酶相关激酶(phosphatidylinositol kinase-related kinases,PIKKs)家族成员。 mTOR 结构复杂,有2 种形式的复合物,即mTORC1 和mTORC2。 mTORC1 含有底物募集的特异性正向调节因子raptor,mTORC2 含有特异性亚基rictor[15]。 文乙先等[16]研究发现,子宫内膜条件性敲除rictor 后,由于容受性降低导致胚胎的植入率明显下降。有研究表明,小鼠植入期子宫内膜组织的mTOR 呈现高表达,且具有时空特异性,孕鼠围植入期注射mTOR 抑制剂可导致胚胎丢失。研究人员对怀孕母猪子宫内膜mTOR 的下游效应物表达的测定结果显示,真核起始因子4E 蛋白表达水平在胚胎植入期(PD13)升高,在胎盘形成期(PD24) 子宫内膜与胎盘接触部位表达水平降低。多项动物研究结果提示,mTOR 信号通路在胚胎植入期的子宫组织表达水平升高, 并对维持成功植入以及胚胎早期发育至关重要[17]。
转化生长因子-β (transforming growth factorβ,TGF-β)是一类在结构上相对保守的生长因子,是细胞增殖、分化,细胞外基质合成和细胞凋亡的主要调节因子之一,参与胚胎着床过程。TGF-β 信号通路参与子宫内膜容受性的形成和黏附反应,有助于滋养层侵入[18]。裴琛琳等[19]研究表明TGFβ 与转化生长影响因子 (transforming growth interacting factor,TGIF)的异常表达可能导致子宫内膜异位症的发生。 MAML3 参与Notch 信号通路,通过细胞与细胞的接触而激活, 可调节细胞内多种生命进程,如增殖、分化、凋亡、侵袭、黏附等[20]。Notch 家族成员表达于子宫内膜、 胚泡和胎盘中,参与着床和胎盘形成,Notch 的表达异常与胎盘形成障碍和子痫前期的发生有关[21]。 赵明智等[10]研究发现, 原因不明的复发性自然流产患者的Notch1 信号通路和Foxp3 表达下调可能阻碍CD4+T 细胞转化为CD4+CD25+T 细胞,进而诱发免疫排斥, 诱导流产。 蛋白激酶A 催化亚单位β(PRKACB) 参与多条信号通路, 包括Wnt、Ras、MAPK、Hedgehog、钙离子、cAMP、间隙链接、紧密连接、卵巢甾类激素形成、胰岛素、催产素、GnRH、甲状腺素、雌激素等,极有可能与胚胎着床密切相关。Wnt 信号通路参与子宫接受态建立、囊胚激活、胚胎着床以及子宫基质蜕膜化,对胚胎的植入起着至关重要的作用[22]。安文仲[23]研究发现MAPK 信号通路通过调控细胞骨架控制胚胎滋养层分化及囊胚成腔。 ELKS/RAB6 -interacting/CAST family member 1(Erc1)参与NF-κB 信号通路。 NF-κB 信号通路参与胚胎着床、子宫内膜侵入[24]。翟洪波[25]研究发现,TLR2、TLR4/NF-κB 信号通路很可能是引发不明原因复发性流产的一个关键途径。
黄体化激素/绒膜促性腺素受体 (lutropinchoriogonadotropic hormone receptor,LHCGR)参与催乳素信号通路、 卵巢甾类激素形成和钙离子信号通路[26]。Bachelot[27]研究发现,卵巢LHCGR 表达减少、黄体形成和黄体酮分泌不足,可导致胚胎植入失败。同时,催乳素受体的缺乏可以导致处于排卵期的雌性小鼠不孕。 妊娠相关的催乳素家族成员包括垂体分泌的催乳素, 子宫蜕膜分泌的蜕膜催乳素, 以及胎盘分泌的催乳素样蛋白和催乳素相关蛋白。 典型的催乳素家族成员通过催乳素受体起作用。 非典型的催乳素家族成员作为生长因子、神经递质或免疫调节因子,以自分泌或旁分泌方式起作用。在哺乳动物妊娠过程中,催乳素家族成员发挥重要功能,它们参与母体对妊娠的适应,促进泌乳,维持黄体,促进胚胎着床和血管发生,促进细胞生长和分化,并在免疫调节中起作用[28]。
6-丙酮酰四氢蝶呤合成酶 (6-pyruvoyl tetrahydropterin synthase,Pts) 基因参与叶酸生物合成过程[29]。流行病学调查研究发现,叶酸缺乏会增加胎盘早剥的风险[30]。赵艳华等[31]研究发现,在由叶酸缺乏引起的孕鼠子宫内膜蜕膜化进程异常过程中,mTOR 信号通路发挥重要的调控作用。 VA及其活性代谢产物作为人类一种必需的营养物质,参与体内许多生理过程,包括视力、生殖、生长、细胞分化、免疫功能以及胚胎发育等。 自然存在或合成的具有与VA 类似结构的化合物称为VA 类物。 在正常的胚胎发育过程中维持恰当的VA 水平很重要,在孕期VA 缺乏或过多地应用均可导致胚胎发育异常[32]。
综上所述, 该研究发现的候选基因直接或间接参与胚胎着床,主要通过激素调节、胚胎侵入、维生素合成代谢等三方面发挥作用。 在今后的研究中,有望通过进一步的基因功能验证试验,揭示所选基因与早期流产相关, 从而为研究制定马匹早期流产的预防和治疗策略, 以及繁殖新技术的开发提供参考。
