番茄过氧化氢酶CRISPR/Cas9敲除突变体的构建
2021-02-05马铭悦
马铭悦, 韩 毅
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
0 引 言
番茄的种植较为广泛,营养丰富、口感独特,是大家喜爱的农作物,但是番茄极其容易染病,常见的细菌性病害主要有青枯病、溃疡病、细菌性斑疹、疮痂病、细菌性髓部坏死病、番茄软腐病、番茄假单孢果腐病等[1],其中丁香假单胞菌[2]是引起植物细菌性病害之首。在番茄种植过程中,利用大量喷洒农药杀死病原菌的传统方法会对人类造成伤害,因此基因改造已经成为植物抗病的主要手段[3]。
对植物而言,活性氧是一类有毒的化学物质逐渐被质疑,取而代之的是其在植物生长发育过程中发挥着重要的作用,例如根毛发育[4]、次生壁分化与发育[5]、柱头与花粉粒发育[6],甚至在植物面临各种非生物胁迫(如干旱[7]、炎热、土壤盐渍[8])和生物胁迫[9]时作为重要的信号分子在胁迫响应中发挥着作用。在植物中,活性氧能够调控寄主对病原体的抗病反应[10],这为植物抗病提供了思路。H2O2以比较稳定的一种活性氧形式[11]存在于植物体内。H2O2清除系统主要是非酶促反应清除系统和酶促清除系统,非酶促清除系统是通过抗坏血酸[12]、谷胱甘肽[13]、类胡萝卜素等抗氧化化学物质。酶促清除系统则是由过氧化氢酶(CAT)[14]、抗坏血酸过氧化物酶(APX)[15]、脱氢抗坏血酸还原酶(DHAR)[16]、谷胱甘肽还原酶(GR)[17]等组成,其中CAT是H2O2最直接最主要的清除酶。但是光呼吸产生的H2O2作为抗病信号[18],往往以模式植物为研究对象[19],相关番茄的H2O2突变体报道并不多,因此番茄H2O2突变体是否提高抗病性和产量还不是很清楚。
甲基磺酸乙酯和T-DNA插入是使用比较普遍的随机插入的基因突变技术,但是通过这些方法得到的遗传材料需要大量筛选,且不能定点突变[20]。锌指核酸酶(ZFNs)[21]、类转录激活因子效应核酸酶(TALENs)[22]虽然可以对基因进行定点编辑,但是构建DNA结构域的表达单位比较复杂、过程繁琐。成簇的规律间隔的短回文重复序列相关核酸酶9系统(CRISPR/Cas9)[23]由sgRNA(single guide RNA)和Cas9组成,sgRNA[24]根据靶点基因寻找到相匹配的DNA片段、Cas9蛋白切割序列[25],DNA 通过容易出错的非同源末端连接修复[26]后,基因发生改变。这样的定点基因编辑技术构建载体方便快捷高效且现在技术逐渐成熟,有更多有效的切割蛋白[27]出现,极大地提高了基因敲除效率。因此本文构建番茄的CAT基因多靶点敲除系统并筛选出阳性苗,为后期研究H2O2抗病提供了遗传材料。
1 材料与方法
1.1 材料
1.1.1 实验材料
实验室所用野生番茄(Solanumlycopersicum)野生型Ailsa Craig(AC)来自美国康奈尔大学THOMPSON植物研究所,由本实验繁殖育种。表达盒质粒pYLgRNA-AtU3b、pYLgRNA-AtU3d、pYLgRNA-AtU6-1、pYLgRNA-AtU6-29,质粒pYLCRISPR/Cas9P35s-N均来自华南农业大学刘耀光实验室[28]。
1.1.2 实验试剂与仪器
试剂主要有MS培养基、蔗糖、琼脂粉、酵母提取物、牛肉膏、无水乙醇、高乐氏(主要成分是次氯酸钠)、BsaⅠ限制性内切酶、高保真DNA聚合酶、T4连接酶、质粒提取纯化试剂盒等。
主要仪器有高温高压灭菌锅、离心机、恒温培养箱、超净工作台、一次性培养板等。
1.2 方法
1.2.1 目的基因与表达盒组合扩增
在华南农业大学刘耀光实验室设计的网站(http://skl.scau.edu.cn/home/)上输入基因信息,设计4个靶点引物后合成,稀释成100倍的母液,F与R 混合并稀释到1 mol/L。pYLgRNA-AtU3b、pYLgRNA-AtU3d、pYLgRNA-AtU6-1、pYLgRNA-AtU6-29质粒图[28]如图1所示,这4个质粒酶切后的产物分别与对应的混合引物在T4连接酶的作用下反应45~60 min。通过巢式聚合酶链式反应(polymerase chain reaction,PCR)对连接产物进行扩增。
1.2.2 目的基因双元载体构建
对扩增后的4个表达盒分别进行纯化,以减少后续不良反应影响。把纯化的产物与质粒pYLCRISPR/Cas9P35s-N按照一定摩尔比加入边切边连变温循环酶反应体系,pYLCRISPR/Cas9P35s-N质粒图[28]如图2所示。反应结束后把产物加入大肠感受态中,热击处理,涂布kana筛选培养基,12 h后挑单克隆并进行菌落PCR鉴定。确定阳性菌后提取质粒且送去测序并转农杆菌,保存甘油菌备用。
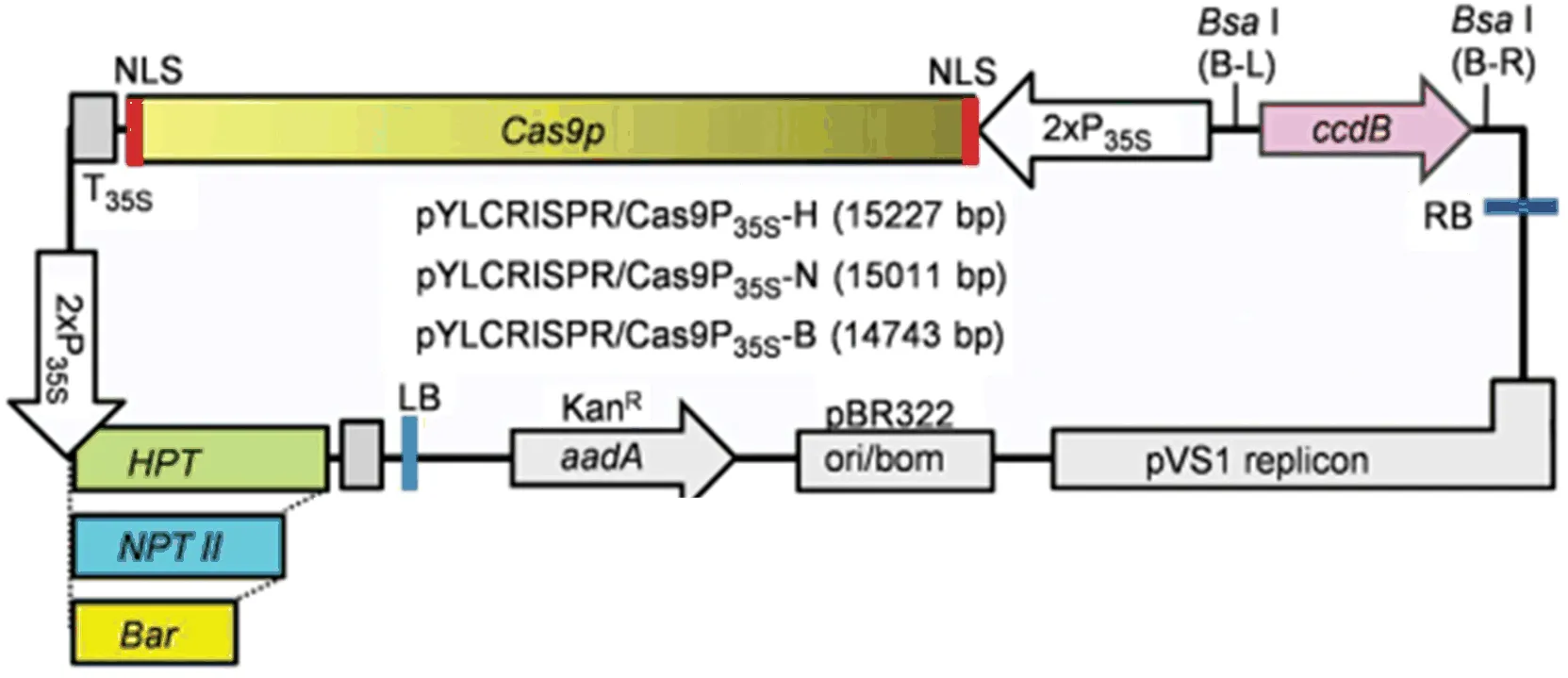
图2 CRISPR/Cas9载体
1.2.3 番茄愈伤组织的培养
在无菌操作台,将浸泡在无菌水约6 h的AC种子,75%乙醇消毒5 min,15%高乐氏15 min,无菌水5 min重复10次。在灭菌后的滤纸上晾干后移到1/2 MS培养基生长。待2对子叶伸展后,剪下子叶和茎(其中子叶需要戳孔)放入预培养约3 d,形成愈伤组织。
1.2.4 侵染番茄愈伤组织并筛选阳性苗
将构建的pYLCRISPR/Cas9P35s-N-CAT农杆菌摇菌至OD值约为1.0后配制成侵染液,对愈伤组织进行侵染并把侵染后的愈伤组织放入共培养培养基。2 d后及时移苗至含有kana的筛选培养基,此后每20 d更换1次筛选培养基以及kana浓度。约40 d后,把阳性苗移到生根培养基,待苗生根后再移到土里。
1.2.5 阳性苗Cas9鉴定
取样,用液氮充分研磨,加入400 mL的SDS提取液,10 000 r/min,4 ℃离心10 min,取200 mL上清与200 mL异丙醇混合,10 000 r/min,室温离心10 min,弃上清,加75% 乙醇,10 000 r/min,室温离心5 min。吹干后加入100 μL,无菌水。吸取2 μL DNA作为PCR的目的模板,35个PCR循环:95 ℃ 30 s,60 ℃ 30 s,72 ℃ 40 s。Cas9引物序列见表1所列。

表1 引物的序列
1.2.6 阳性苗酶活检测
取样,用液氮充分研磨,加入1 mL提取液,14 000 r/min 4 ℃离心,10 min,吸取上清放入冰上备用。反应体系为1 mL,970 μL0.1 mol/L NaH2PO4,1 mmol/L EDTA (pH值7.5),20 μL 2 mol/L H2O2, 10 μL提取液,检测在240 nm处的吸光值。
2 结果与分析
2.1 目的基因双元载体的构建
本文选择了4个靶点,设计了靶点接头引物,具体信息见表1所列。为了提高表达盒的效率,通过pYLgRNA-AtU3b与T1连接, pYLgRNA-AtU3d与T2连接,pYLgRNA-AtU6-1与T3连接,pYLgRNA-AtU6-29与T4连接,将酶切的表达盒质粒分别与对应靶点连接反应。
为了准确扩增含目的靶点的表达盒,选择巢式PCR,每个含有目的靶点扩增都有2轮PCR反应,巢式PCR鉴定跑胶图如图3所示。第1轮用表达盒左端引物UF与靶点接头R为一对引物即UF+TR的产物,如图3a所示的1号泳道,靶点接头F与表达盒右端引物gRNAR为一对引物即TF+gRNAR的产物,如图3a所示的2号泳道,分别扩增含目的靶点的表达盒。图3a中1和2只是1个靶点的2个PCR结果,剩下的3个靶点结果应该和图1保持一致。
第1轮PCR的2个产物稀释10倍,混合后作为第2轮PCR模板,与对应的10倍位置特异性引物反应做PCR,如图3b所示。图3b中的1、2、3、4分别对应4个靶点的第2轮PCR产物。

图3 巢式PCR鉴定跑胶图
为了保证PCR产物后续与载体正常高效地酶切和连接,需要对第2轮PCR产物进行纯化。4个表达盒与pYLCRISPR/Cas9P35s-N连接后,转化大肠,挑选单克隆,进行菌落PCR鉴定结果如图4所示。为了准确检测目的靶点在载体上,菌落PCR鉴定为5对引物,即CRISPR表达盒左端引物35sF与靶点1的接头R(产物为图4的1号泳道),靶点1的接头F与靶点2的接头R(产物为图4的2号泳道),靶点2的接头F与靶点3的接头R(产物为图4的3号泳道),靶点3的接头F与靶点4的接头R(产物为图4的4号泳道),靶点4的接头F与CRISPR表达盒右端引物35sR(产物为图4的5号泳道)。其中图4的左边空白对照的PCR模板为水。
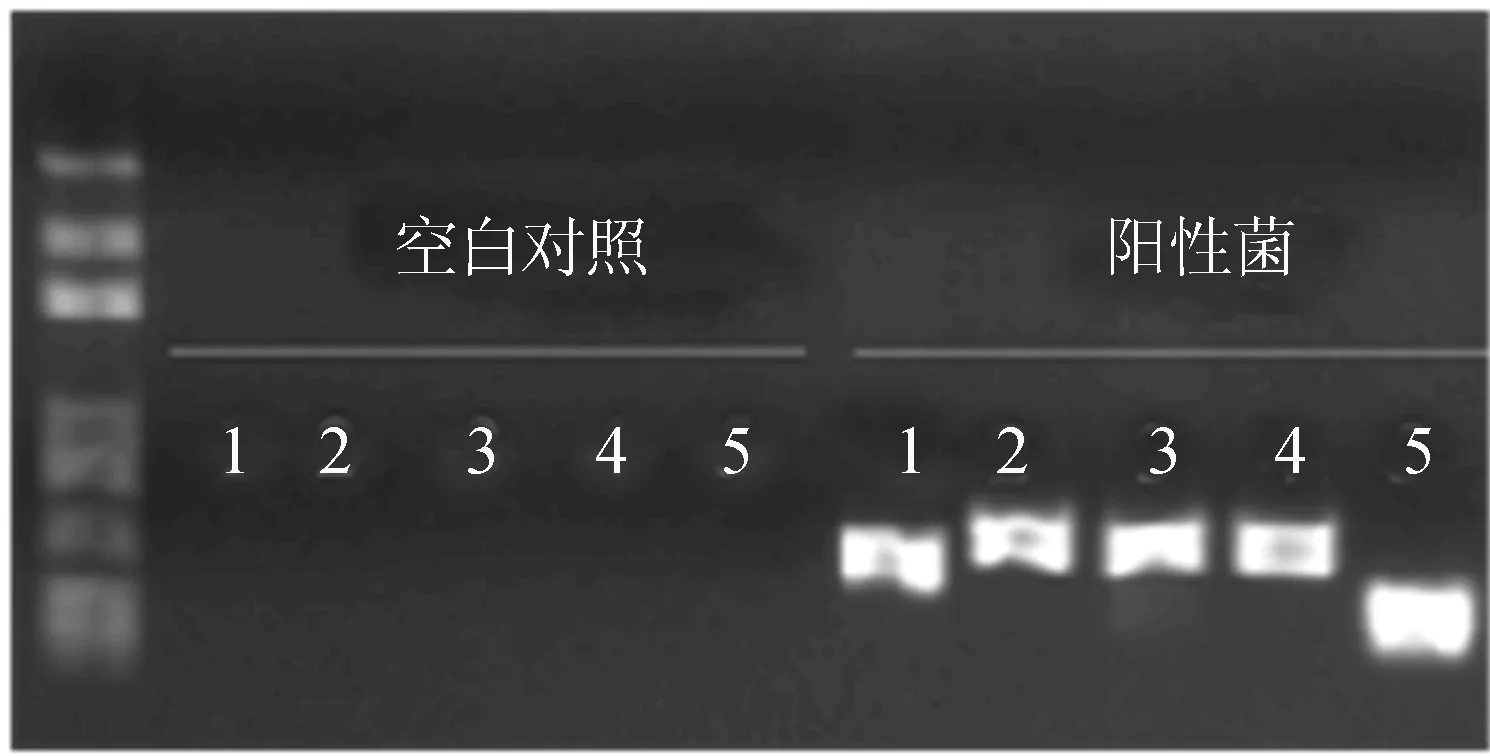
图4 阳性单克隆菌落PCR鉴定
挑选阳性菌落,提质粒送去测序,测序结果如图5所示,从图5可看出,4个靶点全部与构建的质粒序列相匹配,这个双元载体成功构建,转入农杆菌为后续的侵染番茄做准备。

图5 靶点与双元载体质粒序列对比图
2.2 番茄阳性苗筛选与鉴定
通过组织培养获得番茄的愈伤组织,并用阳性农杆菌侵染愈伤组织,经过多次抗生素浓度提高的培养基来筛选出7颗阳性苗。
把7棵阳性苗移到土里培养一段时间后,取样进行Cas9鉴定和酶活测量,Cas9鉴定结果如图6所示,图6中,空白对照的 PCR模板为野生型,其泳道上没有条带,但是1~7号泳道上的条带和构建成功的双元载体质粒为模板时的条带一样,因此Cas9基因成功转入阳性苗体内。

图6 阳性苗PCR鉴定Cas9
对其中7颗阳性苗进行酶活测定,结果如图7所示。由图7可知,所有的阳性苗CAT酶活显著性地低于野生型对照,表明CRISPR/Cas9成功地敲除番茄CAT相关基因。

图7 7颗阳性苗酶活测定
3 讨论与展望
目前CRISPR/Cas9基因编辑技术在动物、植物、微生物等领域都有一席之地,在植物上拟南芥、番茄、水稻、棉花、生菜、大豆等都能看到CRISPR/Cas9的身影[29-31]。
在CRISPR为载体的基因编辑系统中,sgRNA和Cas9甚至靶点序列的选择都会影响打靶效率。Cas9基因密码子、启动子、终止子会影响Cas9的表达水平和活性[28]。靶点目标带着sgRNA与DNA识别时,会有几个碱基的误差,会造成脱靶[32]。CRISPR/Cas9是通过DNA双链断裂[33],形成DNA损伤,DNA自身会进行修复,但是修复过程中容易出现碱基对缺失或者修复错误,其结果千差万别[26],从而导致遗传信息的改变。因此修复能力也决定了最终突变体的类型。这些原因就导致最后筛到的突变体各有不同。在今后构建载体时,需要对目的靶点多加筛选,提高sgRNA的特异性,改造Cas9蛋白酶都有利于减少脱靶频率[34]。
本实验最终筛选出7颗阳性苗,并对其进行CAT酶活测定。酶活有显著性的下降,但是所有的材料还具有部分CAT酶活,表明不是所有的CAT基因被敲除,暗示CRISPR/Cas9打靶敲除了其中若干基因,而不是全部。CRISPR/Cas9敲除会导致碱基对的增添、缺失、突变等情况;其次,CAT相关的基因有3个,CDS序列高度相似;而且,无法找到针对其中一个CAT基因的专一性靶点。因此在基因水平上确定每个CAT的精确突变情况会异常困难。PCR鉴定显示番茄体内存在Cas9,可能会对突变体内其他未突变的CAT继续敲除,因此期望在后续T1和T2代中可以获得纯合CAT基因全敲除的突变体。
以丁香假单胞菌为代表的病原菌是引发疫病、导致番茄减产的主要原因[2]。植物在遭受病原菌侵害时会出现一种程序性死亡且激活体内一系列抗病防御反应[35],而光呼吸途径代谢产生的H2O2能显著抑制丁香假单胞菌对植物的侵染以及提高植物体内免疫防御能力[36]。通过番茄CAT的CRISPR/Cas9双元敲除载体系统获得突变体,不管能否获得全敲除的CAT突变体,本文目前获得的CAT酶活缺失突变体为后续分析番茄的抗病性和产量提供了重要的遗传材料,同时分析这些番茄突变体的遗传稳定性,以期获得稳定的且抗病能力强的番茄新品种。
