高温和皮质醇对黄颡鱼性别分化的影响
2021-02-04齐飘飘常乐怡李亚宁王凌宇袁勇超樊启学沈志刚
齐飘飘 陈 敏 于 跃 常乐怡 李亚宁 王凌宇 袁勇超 樊启学 沈志刚
(华中农业大学水产学院,农业农村部淡水生物繁育重点实验室,教育部长江经济带大宗水生生物产业绿色发展工程研究中心,池塘健康养殖湖北省工程实验室,武汉 430070)
黄颡鱼(Tachysurus fulvidracoRichardson)隶属于鲶形目、鲿科、黄颡鱼属[1],广泛分布于我国长江、黄河和黑龙江等水域,是我国重要的淡水名优鱼类,因其肉质细嫩鲜美,无肌间刺,营养价值高,养殖周期短等优点,一直受到养殖者和消费者的青睐。黄颡鱼2018年全国总产量51.0×107kg,从2012年开始年平均增长16.4%,是我国淡水名优鱼类中增长速度最快、增长速率最稳定的养殖品种[2],2018年全国淡水鱼类养殖产量排名第9位,是我国名副其实的淡水名优第一鱼。黄颡鱼生长具有明显的性别二态性,前期研究我们发现,在相同养殖环境下,雄鱼生长速度比雌鱼快120%[3],达上市规格时雄鱼体重可达雌鱼的2—3倍[4]。
为了提高黄颡鱼养殖群体的生长速度与养殖效益,我国科研人员做了大量工作,培育出了2个黄颡鱼新品种,黄颡鱼“全雄1号”(2010年认定)和杂交黄颡鱼“黄优1号”(2019年认定),推动了黄颡鱼产业的稳步增长。在新品种的培育过程中,科研人员对黄颡鱼的性别决定与性别分化机制、性别特异分子标记、性别控制技术、两性生长异形进行了大量深入的研究,取得了较大的进展[3—14]。黄颡鱼遗传性别决定类型为雄性配子异形(XXXY),但是研究发现黄颡鱼性别分化易受到环境因素的影响。虽然黄颡鱼Y染色体上存在潜在性别决定基因pfpdz1[6],但本研究发现,在性别分化关键时期,短期的高温(33℃)处理能诱导部分XX个体发生性逆转。高温诱导遗传型雌鱼性逆转的机制尚不清楚。
研究发现,高温[4,15,22—25]、高密度[26,27]等应激条件下引起鱼苗雄性化的同时都伴随着皮质醇水平的升高,使鱼类的性腺都朝着雄性方向分化[20,28]。Hattori等[15]高温处理银汉鱼(Odontesthes bonariensis)幼鱼中有相当大比例的雌鱼逆转为雄鱼,与对照组相比,在高温饲养的幼鱼中检测到较高的皮质醇;Van den Hurk等[29]用皮质醇和皮质酮处理虹鳟(Oncorhynchus mykiss)仔鱼30d,虹鳟仔鱼出现明显的雄性化,未发生性逆转雌鱼卵巢发育受到抑制;Hayashi等[21]报道高温(33℃)处理青鳉(Oryzias latipes)仔鱼引起皮质醇水平升高,抑制原始生殖细胞分化和fshrmRNA表达,青鳉仔鱼高温处理过程中加入皮质醇合成酶抑制剂(美替拉酮,metyrapone),雄性化完全被药物所抵消。此外,XX青鳉孵化后暴露于高温和皮质醇中(0—5日龄)抑制雌性生殖细胞的增值和卵巢芳香化酶(cyp19a1)的表达,而这些影响在高温和皮质醇处理中加入雌二醇(17β-estradiol,E2)后雄性化被抵消[22]。高温[15—18,20,24,30]和皮质醇[15,26,29,31]处理对性别调控的作用在许多鱼类中得到证实,我们将这些证据总结如下:(1)环境应激条件在鱼类性别分化关键时期诱导雄性化过程中无一例外地导致皮质醇水平升高;(2)皮质醇处理也能诱导雄性化;(3)而皮质醇合成酶抑制剂能抵消高温等应激条件诱导的雄性化;(4)雌二醇处理能解救皮质醇或高温诱导的雄性化。这4个方面的证据表明,皮质醇很可能是环境应激诱导雄性化过程的关键因子。因此我们推测皮质醇参与环境诱导雄性化的过程。
本研究以我国重要经济鱼类黄颡鱼为研究对象,开展高温与皮质醇诱导黄颡鱼XX个体雄性化组织学进程研究,以期为解密环境应激诱导鱼类雄性化的遗传学与生理学机制提供基础资料,并为建立环境友好型全雄黄颡鱼的生产方法提供初步的实践支持。
1 材料与方法
1.1 实验材料与实验鱼养殖
实验鱼亲本均来自湖北省黄优源渔业发展有限公司,雌鱼亲本来源于江苏地区,雄性亲本来源于湖北本地。选取规格大体一致、无损伤和体质健壮的黄颡鱼亲本,进行人工催产,实验鱼苗经人工授精孵化所得,出膜后3d用丰年虫开口(天津丰年水产养殖有限公司),然后逐渐转食成微粒配合饲料(山东升索渔用饲料研究中心,主要成分:粗蛋白质≥50.0%,粗脂肪>8.0%,粗纤维≤3.0%,灰分≤16.5%,水分≤12.0%,钙≤5.0%,总磷≥1.0%,赖氨酸≥2.0%)。每100 g饲料拌30 mL 95%乙醇溶液,将皮质醇溶于乙醇溶液,浓度为300 mg每kg饲料,对照组和高温组不添加药物直接与乙醇混合,每100 g饲料伴入30 mL乙醇,均匀地喷洒在微粒配合饲料中,通风厨中过夜晾干,使酒精充分挥发,将配好的饲料置于4℃条件下备用。实验期间鱼苗饲养在60 L的水箱中,在12—35日龄每天投喂3次,36日龄后每天投喂2次,每天清理残饵粪便并及时换注清水。
1.2 实验设计
实验共3个组:对照组(CR)、高温组(HT)和皮质醇组(CS),每组3个平行,每个平行随机放入500尾鱼苗。本次实验在12—35日龄期间,皮质醇处理组投喂伴入皮质醇的饲料,对照组和高温组仅加入95%乙醇伴入的饲料,皮质醇和对照组平均水温为26℃,高温组平均水温为33℃。35日龄之后所有实验鱼转喂未经处理的颗粒饲料,水温全部设置为26℃(高温组水温每天降低1℃)。实验养殖阶段分别在22、32、42、62、122日龄设置取样点,每个平行随机捞取相同或相近数量的实验鱼,用MS-222麻醉后测量全长(精确到0.1 mm),取每尾鱼鳍条保存于95%乙醇中,取躯干部分(鳃盖后缘之后,肛门之前)或性腺组织于Bouin’s液中固定,48h后转入70%乙醇常温保存。
1.3 性别鉴定
采用通用型柱式基因组试剂盒提取鳍条DNA(康为世纪),利用Dan等[5]开发的黄颡鱼性别特异性分子标记(XY-F:5′-GATTGTAGAAGCCATC TCCTTAGCGTA-3′;XY-R:5′-CATGTAGATC ACTGTACAATCCCTG-3′),来鉴定每尾鱼的遗传型性别。PCR反应体系为10 μL:上下游引物各0.5 μL;模板DNA 1.0 μL;2×TaqPCR Master Mix 5.0 μL(康为世纪);ddH2O 3.0 μL。PCR反应程序为:95℃预变性3min,34个循环(95℃变性30s,59℃退火30s,72℃延伸40s),72℃延伸5min。扩增完成后,取PCR产物3 μL,以DL2000 Marker作为参照,利用凝胶成像系统依据片段长度鉴别出XY和XX,XY为2条带(826和955 bp),XX为一条带(955 bp)。
1.4 性腺组织学观察
性腺组织学样品通过梯度乙醇脱水、二甲苯透明、石蜡包埋后,连续切片(切片厚度5—6 μm),用于苏木精伊红染色(HE染色),中性树胶封片,组织切片在光学显微镜下用成像系统进行检查和拍照(Olympus DP73,Japan)。各阶段性腺中生殖细胞的鉴别参照前人对黄颡鱼性腺分化的组织学观察研究[31—33]。
1.5 数据分析
实验数据采用SPSS 软件(version 20.0)进行单因素方差分析(One-way ANOVA)差异显著性检验,方差分析前进行数据正态性和方差齐性检验,如不符合方差分析的条件,将数据进行对数或正弦转换。用Duncan’s多重比较来确定组间差异的显著性,P<0.05时视为显著性差异。文中的数据均以均值±标准差(Mean±SD)表示。
2 结果
2.1 性别鉴定
黄颡鱼遗传性别决定类型为雄性配子异形(XX-XY)。利用黄颡鱼性别特异性的分子标记,以黄颡鱼基因组为模板扩增出两段不同大小的片段(X-955 bp;Y-826 bp),电泳检测结果扩增出两条带(955和826 bp)的为雄鱼,只有一条带(955 bp)的为雌鱼。
图1A显示的是对照组62日龄利用黄颡鱼性别特异性分子标记的琼脂糖凝胶电泳图(部分),检测结果可以清楚地鉴定出每一尾鱼的遗传型性别,并无模糊条带,跟我们前期研究结果一致[3]。因此利用黄颡鱼性别特异性的分子标记可以100%准确鉴定遗传型性别。部分结果如下:62日龄取样组织学观察发现1、3、4、5、6、7、8、9为雌鱼,2、10、11、12、13、14为雄鱼,与图1A所表现的遗传型性别完全一致。
图1B显示的是高温组62日龄琼脂糖凝胶电泳图(部分),62日龄取样组织学观察发现5、8、9、11、14为雌性,1、2、3、4、6、7、10、12、13为雄性,说明4、12、13个体XX雌鱼性逆转为XX伪雄鱼,其中7是YY超雄鱼。

图1 黄颡鱼雌雄基因型鉴定电泳图(X-955 bp;Y-826 bp)Fig.1 Genotypic sex identification by using sex-linked markers in yellow catfish(X-955 bp;Y-826 bp)
我们统计了62日龄时各处理组的存活率,对照组存活率(79.4±3.2)%显著高于高温组(63.6±1.5)%,而高温组显著高于皮质醇处理组(59.0±0.6)%。
2.2 高温和皮质醇处理对黄颡鱼生长的影响
利用黄颡鱼性别特异分子标记和组织学结合的方法,我们分别在各处理组间和各处理组之内比较了XX伪雄鱼、XX雌鱼与XY雄鱼生长方面的差异(表1)。高温或皮质醇处理结束4周,即黄颡鱼幼鱼62日龄时,我们发现不论是高温组还是皮质醇组,XX伪雄鱼全长均显著大于XX雌鱼,也较XY雄鱼大。这种生长优势一直延续至122日龄,但这种优势没有统计学上的显著差异。

表1 高温和皮质醇处理对黄颡鱼幼鱼生长的影响Tab.1 The effects of high temperature and cortisol treatments on the growth of yellow catfish
2.3 高温和皮质醇对黄颡鱼性腺发育和性别分化的影响
我们将每一尾黄颡鱼个体通过性别特异性分子标记进行遗传性别鉴定,并对相应的性腺进行组织学观察,22日龄性腺组织学如图2所示。22日龄皮质醇和高温处理组均未发现XX个体发生性逆转。高温组、对照组和皮质醇组中的卵巢组织与精巢组织可明显区分,标志着卵巢解剖学上分化的开始。高温组卵巢组织由卵原细胞组成,精巢组织仍处在发育最初期(由少量原始生殖细胞及体细胞组成)。对照组卵巢(图2C、2c)和皮质醇组卵巢(图2E、2e),卵原细胞细胞核染色较浅,细胞质呈网状或丝状,卵圆形或椭圆形,细胞处于有丝分裂期,高温组卵巢(图2A、2a)发育比对照组(图2C、2c)和皮质醇组(图2E、2e)快。高温组(图2B、2b)、对照组(图2D、2d)和皮质醇组(图2F、2f)精巢由原始生殖细胞(Primordial germ cells)和性腺体细胞(Somatic gonadal cells)组成。

图2 黄颡鱼XX与XY遗传型幼鱼22日龄性腺组织学Fig.2 Representative gonadal histology at 22 days post-hatching(DPH)of XX and XY yellow catfish
黄颡鱼32日龄性腺组织学如图3所示,我们观察到,高温组、对照组和皮质醇组中的卵巢组织与精巢组织可明显区分。高温和皮质醇处理诱导了一部分XX遗传型雌鱼雄性化,并且这些XX雄鱼保留了原有的卵巢腔结构;而另一部分雌鱼保持了原有的卵巢结构和细胞。在对照组(图3D、3d)中观察到卵原细胞,在高温组(图3A、3a)部分XX雌鱼(未性逆转)中观察到较大的初级卵母细胞,初级卵母细胞的出现标志着卵巢细胞学上分化的开始,因此高温促进了卵巢发育。皮质醇组(图3F、3f)部分XX雌鱼(未性逆转)中也观察到卵原细胞和初级卵母细胞,在发生性逆转的XX个体性腺中(图3G、3g),性腺中充满大量原始生殖细胞。高温组(图3C、3c)与皮质醇组(图3H、3h)XY个体精巢与对照组(图3E、3e)XY个体相比,形态上无明显区别。
图4是黄颡鱼62日龄组织学,在结束处理4周之后(35日龄处理结束),高温组(图4B、4b)和皮质醇组(图4G、4g)性逆转的XX伪雄鱼精巢结构仍然保留32日龄时观察到的卵巢腔结构。对照组XY雄鱼(图4E、4e)精原细胞有丝分裂大量增值充满整个精巢,精小叶的形成标着着精巢解剖学水平上的分化。高温组(图4C、4c)、对照组(图4E、4e)和皮质醇组(图4H、4h)XY雄鱼精巢处于发育的第Ⅰ期,精巢中精原细胞细胞核较大,位于细胞中央。高温组(图4B、4b)和皮质醇组(图4G、4g)性逆转的XX伪雄鱼精巢组织较大,精巢组织充满大量无明显核仁的初级精母细胞,说明性逆转XX伪雄鱼精巢比正常XY雄鱼大。高温组(图4A、4a)和皮质醇组(图4F、4f)XX雌鱼与对照组XX雌鱼(图4D、4d)相比,初级卵母细胞的形态结构、大小等无明显差异。
图5是黄颡鱼122日龄组织学,在结束处理11周之后,高温组(图5B、5b)和皮质醇组(图5G、5g)性逆转的XX伪雄鱼并未观察到32日龄和62日龄时观察到的卵巢腔结构,而具有典型精小叶和精小囊结构。对照组XY雄鱼(图5E、5e)精巢处于发育第Ⅲ期,精原细胞和精母细胞有丝分裂大量增值充满整个精巢。高温组(图5C、5c)和皮质醇组(图5H、9h)XY雄鱼精巢处于发育的第Ⅳ期,精巢的精小囊内除了有精原细胞外,还有大量的精母细胞,并向腹壶腔内推进,腹壶腔中央充满大量精子细胞。高温组(图5B、5b)性逆转的XX伪雄鱼精巢处于发育的第Ⅳ期,精巢中充满大量的精子细胞。皮质醇组(图5G、5g)性逆转的XX伪雄鱼精巢处于发育第Ⅲ期,精细小管出现管腔,精细小管内充满大量精原细胞和精母细胞,细胞圆形或椭圆形,细胞质嗜碱性。高温组(图5A、5a)、对照组XX雌鱼(图5D、5d)和皮质醇组(图5F、5f)卵巢发育至第Ⅱ期,细胞呈圆形或椭圆形,处于初级卵母细胞小生长期细胞,细胞核中核仁数量增多,靠近核膜内侧分布,卵母细胞膜外包围一层由滤泡细胞构成的滤泡膜。

图3 黄颡鱼XX与XY遗传型幼鱼32日龄性腺组织学Fig.3 Representative gonadal histology at 32 days post-hatching(DPH)of XX and XY yellow catfish
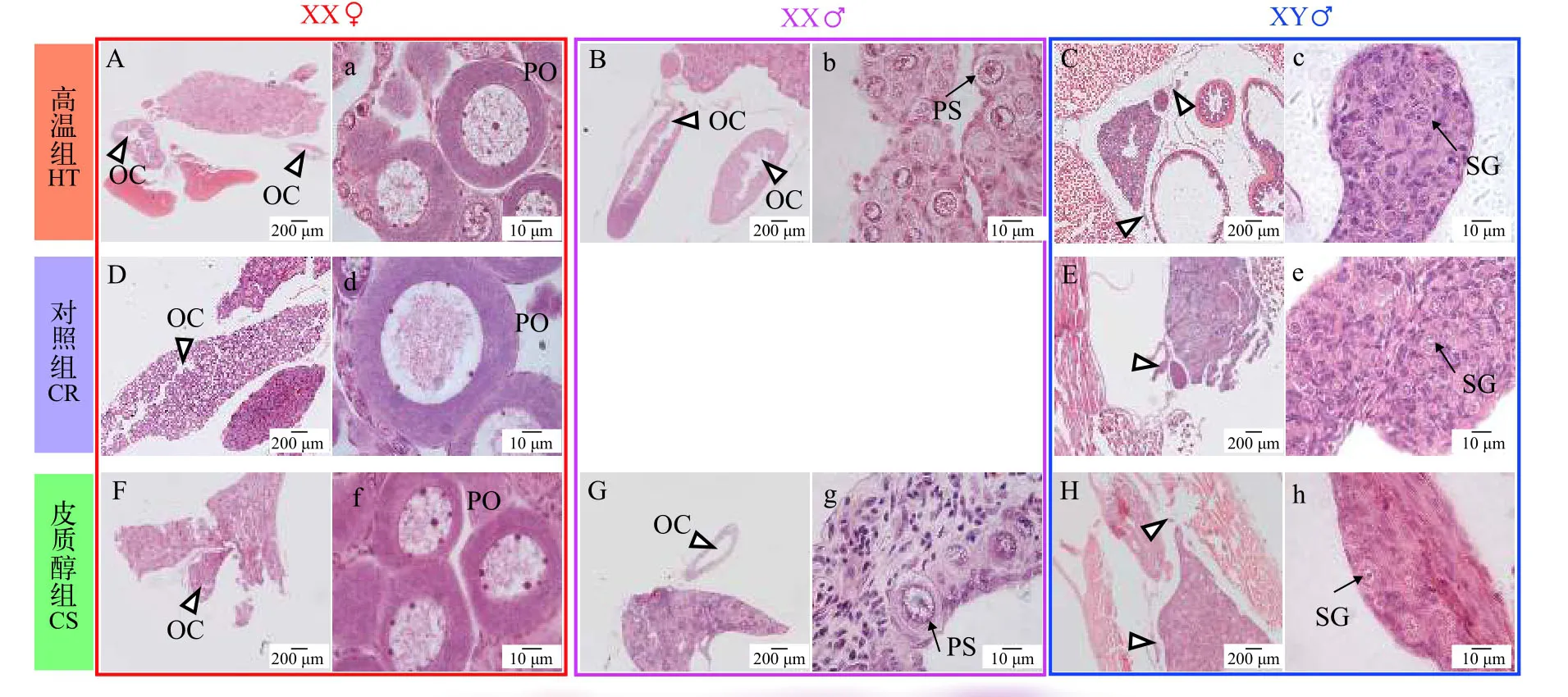
图4 黄颡鱼XX与XY遗传型幼鱼62日龄性腺组织学Fig.4 Representative gonadal histology at 62 days post-hatching(DPH)of XX and XY yellow catfish
此外,我们逐条检查了具有生殖突的个体21尾,利用性别特异分子标记鉴定发现,其中10尾鱼为XX基因型。表明XX伪雄鱼具有雄鱼特有的生殖突结构,可能具有正常的生殖能力。
2.4 温度和皮质醇处理对黄颡鱼性比的影响
黄颡鱼幼鱼发育至62和122日龄,通过组织学鉴定生理型性别,并统计各处理组雌雄性别比例。如图所示(图6A、6B)对照组没有个体发生性逆转,高温和皮质醇处理组中均有一定比例的XX雌鱼性逆转为XX伪雄鱼,62日龄高温组中幼鱼雄性率为63.3%,其中XX雌性个体中有26.7%发生性逆转,皮质醇组中幼鱼的雌、雄比例为1﹕29,其中皮质醇组XX雌性个体中有96.7%发生性逆转。122日龄高温组中幼鱼的雌、雄比例为1﹕5.3,其中XX雌性个体中有62.5%发生性逆转,皮质醇组中幼鱼的雄性率为77.8%,其中皮质醇组XX雌性个体中有55.6%发生性逆转。

图5 黄颡鱼XX与XY遗传型幼鱼122日龄性腺组织学Fig.5 Representative gonadal histology at 122 days post-hatching(DPH)of XX and XY yellow catfish
3 讨论
3.1 皮质醇可能在高温诱导XX遗传型雌鱼性逆转中起关键作用
高等脊椎动物,性别通常由基因决定,而在鱼类中,性别由基因或环境或它们共同决定[35]。鱼类的性别分化极易受到环境因素的影响,包括温度、密度[26,27,41]、pH[42,43]、饵料丰度、环境背景色[31]、溶氧水平[44]和盐度[45]等,因此,对于很多鱼类来说,性别最终是遗传基因和环境因素相互作用的结果[46]。研究表明,几乎在所有的应激条件下,鱼类的性腺都朝着雄性方向分化[47]。应激条件主要通过以下三个方面引起鱼类雄性化[8,9]:(1)提高雄激素水平及相关基因表达;(2)抑制卵巢分化通路;(3)抑制原始生殖细胞的增值。研究发现,高温和皮质醇处理会导致鱼类芳香化酶活性升高,抑制生殖细胞的增殖和卵母细胞的发育,同时导致体内皮质醇、11-甲基睾酮(11-KT)和睾酮(Testosterone,T)水平升高,使鱼类雄性化[15,21,24,29,30]。通过4个方面的证据:(1)环境应激条件在鱼类性别分化关键时期诱导雄性化过程中无一例外地导致皮质醇水平升高[47];(2)皮质醇处理也能诱导雄性化[15];(3)而皮质醇合成酶抑制剂能抵消高温等应激条件诱导的雄性化[22],(4)雌二醇处理能解救皮质醇或高温诱导的雄性化[23],我们推测皮质醇很有可能是环境应激诱导雄性化过程中的关键因子。同时,从单细胞动物偶尔通过有性生殖来抵御不良环境,到水生甲壳类通过无性生殖转变为有性生殖来渡过环境压力[48],再到环境应激普遍性诱导鱼类与爬行动物雄性化[47],这些证据将个体抵御环境应激的通路与性起源与维持联系在一起,而皮质醇作为个体最主要的抗应激激素,在其中可能起到关键作用。
本实验高温和皮质醇处理黄颡鱼幼鱼有部分XX遗传型雌鱼性逆转为XX伪雄鱼,皮质醇组雌性个体中85.7%发生性逆转,高温组中有39.2%发生雄性化,说明部分XX遗传型雌鱼个体对皮质醇与高温处理并不敏感。这种同样基因型个体存在温度敏感性差异现象,在斑马鱼(Danio rerio)[26]和罗非鱼(Oreochromis niloticus)[49]中有报道,但是这其中的机制却不得而知。我们发现,对照组32日龄雌性性腺中观察到卵原细胞,而此时高温组未发生性逆转的XX雌性个体中观察到较大的初级卵母细胞,且高温处理组的细胞数量较对照组更多。刘菲菲[50]将孵化后5d的尼罗罗非鱼(Nile Tilapia)高温(36±1)℃处理12d,25日龄高温组未发生性逆转的个体也同样观察到较大的卵母细胞,与本实验结果相似,说明高温对未发生性逆转个体的生殖细胞的发育具有促进作用,使卵巢发育比对照温度提前。同样是XX基因型个体,同样在高温处理下,一部分个体卵巢发育加快,而另一部分卵巢发育受到抑制继而发育成精巢,这背后的机制需要我们进一步挖掘。温度型性别决定两大问题还未知:(1)温度型性别决定的遗传机制;(2)温度如何进行信号传递从而决定性别或者引起性逆转。而遗传-环境共同性别决定的鱼类如黄颡鱼、罗非鱼等是研究这一问题的最好材料。我们推测,相同基因型的XX个体对温度处理表现出完全相反的表型,是因为它们在遗传上存在差异,因此寻找这些差异是我们应当重点关注的研究方向,是解开性别决定进化与性别决定机制转换的重要途径。

图6 高温与皮质醇处理对黄颡鱼性别比例的影响Fig.6 Effects of high temperature and cortisol treatments on sex ratios of yellow catfish
3.2 XX遗传型个体中存在温度敏感型与温度不敏感型
目前,温度对于黄颡鱼性别分化的报道存在分歧,游鑫等[33]发现32℃处理黄颡鱼受精卵至60日龄能显著提高雄鱼比例,而Zhang等[51]报道称,用高温32℃和34℃处理黄颡鱼幼鱼45d对性比没有显著影响;而Xiong等[52]报道称32℃和34℃能导致XX全雌种群(芳香化酶抑制剂诱导的XX雄鱼与XX雌鱼的后代)的雄性化,并且在Zhang等[51]研究结果的基础上,推测人工诱导性逆转可能导致黄颡鱼从GSD转变成了TSD。我们的研究结果与这种推测不相符。同一种鱼类不同地理种群对温度的敏感性具有较大的差异[53,54],可能是造成实验不同结果的原因,后续实验我们也将关注这方面的问题,区分不同种群对于温度处理的敏感性。在本研究中,通过对每尾实验鱼进行遗传型性别鉴定(性别特异分子标记)和生理型性别鉴定(组织学切片),明确在我们实验种群中,一定比例的XX遗传型个体性腺发育为精巢样结构。并且在122日龄时可明显观察到高温组(图5B、5b)和皮质醇组(图5G、5g)性逆转的XX伪雄鱼具有雄性特有的生殖突,组织学显示其具有典型精小叶和精小囊结构,精巢的精小囊内除了有精原细胞外,还有大量的精母细胞和精子细胞。因此,我们用确切的证据证明,高温处理能导致XX遗传型个体性逆转为生理型雄鱼,并且推测XX伪雄鱼可能具有生殖能力,这些XX伪雄鱼生殖能力有待进一步研究确认。
在之前的报道中,经皮质醇(26℃)和高温(33℃)处理XX青鳉仔鱼,皮质醇处理组中48%的XX雌性个体性逆转为XX伪雄鱼,而高温组中只有25%雌性发生性逆转,皮质醇处理过的青鳉仔鱼皮质醇水平明显高温处理组[22]。此外,用不同浓度的皮质醇(0、100、300 mg/kg)处理Southern flounder(Paralichthys lethostigma)幼鱼,性逆转的比例具有明显的浓度依赖性[27]。血浆中皮质醇激素的清除依赖于结合蛋白、靶组织受体等,外源激素在体内消除相对较慢[28,55],因此,外源皮质醇激素比鱼体内应激而导致皮质醇激素具有更明显的性逆转作用,这可能是外源皮质醇处理黄颡鱼比高温更能引起鱼类雄性化的原因之一。青鳉仔鱼用皮质醇和高温处理均可引起雌鱼向雄鱼的性别逆转,组织学观察表明性逆转的XX雄鱼具有典型的精巢[21]。黄颡鱼62日龄组织学,高温组和皮质醇组性逆转的XX伪雄鱼精巢结构仍然保留32日龄时观察到的卵巢腔结构,说明高温和皮质醇处理对黄颡鱼性腺分化具有持续性。在高温和皮质醇处理组中,62日龄时XX伪雄鱼的精巢与对照组XY雄鱼相比性腺较大,精巢中充满着无明显核仁的初级精母细胞,但细胞排列疏松,存在较多的体细胞,而此时对照组XY雄鱼精巢组织充满大量的精原细胞。122日龄时,精巢中并未观察到之前32日龄和62日龄时观察到的卵巢腔结构。我们对比发现,62日龄时,XX伪雄鱼的卵巢腔较32日龄时明显缩减,精巢结构朝卵巢腔内延展,开始出现黄颡鱼精巢典型的分枝状结构,这可能是122日龄时卵巢巢消失的主要原因。Kitano等[23]在早期报道中表示高温和皮质醇处理能使XX青鳉发生性逆转,性逆转的XX伪雄鱼精巢生殖细胞数目少于正常XY雄鱼,高温和皮质醇诱导鱼类雄性化,性逆转的个体性腺细胞发育比对照组快,说明XX伪雄鱼精巢发育比正常XY雄鱼快,但性逆转性腺中体细胞较多而生殖细胞较少。
3.3 个体生长取决于生理型性别而非遗传型性别
本实验中高温和皮质醇组性逆转XX伪雄鱼全长高于XX雌鱼和XY雄鱼,表明高温或皮质醇诱导的XX伪雄鱼生长比正常XY雄鱼快。在此之前的报道中虹鳟仔鱼用皮质醇处理,性逆转的XX虹鳟伪雄鱼的平均体重和平均性腺重明显增加[29],在尼罗罗非鱼也发现高温处理XX雄鱼比正常XY雄鱼生长快[50],说明高温和皮质醇的作用并不局限性腺,对鱼类的生长也有一定的促进作用。研究发现,高温处理抑制cyp19a1 mRNA表达,导致雄激素和皮质醇水平显著升高[16],外源皮质醇和皮质酮激素可以转化为雄激素[15,29],精巢分泌雄激素对鱼类的生长有促进作用[56]。此外,皮质醇作为一种糖皮质激素可以直接作用于肾上腺,加强肾上腺皮质细胞类固醇合成能力[57],这些可能是导致XX雄鱼比正常XY雄鱼生长快的原因。另一方面,我们发现,62日龄时XX伪雄鱼精巢组织远比正常XY雄鱼大(图4),可能产生更多的雄激素和生长激素,表明性腺大小也可能是决定同一性别个体大小的重要因素。在罗非鱼的研究中发现,性腺切除显著抑制雌雄个体生长,而这种抑制作用可以通过性腺植入而获得挽救[58],表明性腺在生长中的重要作用。
鱼类的性腺发育有2种类型:一种是性腺直接发育为卵巢或精巢;另一种性腺最初是雌性同体,但随后发育为卵巢或者精巢[59]。斑马鱼属于第二种类型,性腺最初发育为卵巢,随后一部分个体卵巢组织退化,卵母细胞凋亡,最终发育为雄性,卵母细胞凋亡是斑马鱼卵巢-精巢转化的重要原因[60]。本实验黄颡鱼32日龄性腺组织学我们观察到高温和皮质醇处理诱导了一部分XX遗传型雌鱼雄性化,一部分未发生性逆转的XX雌鱼正常发育为生理型雌鱼,有趣的是另一部分性逆转的XX伪雄鱼保留了原有的卵巢腔结构,内部结构却是雄性生殖细胞。32日龄组织学观察皮质醇组未发生性逆转的个体中也观察到卵原细胞和部分初级卵母细胞,其中有部分未发生性逆转的XX雌鱼性腺中,卵巢含有空泡化组织,细胞边缘皱缩,无论从大小还是形状上,似乎是卵原细胞退化而形成的,可能是退化的卵巢向精巢分化的过渡阶段。在性别分化时期将青鳉仔鱼暴露在高温(33℃)下,通过提高皮质醇水平,抑制雌性生殖细胞的增值和fshrmRNA的表达,从而导致XX雌性发生性逆转[22]。研究发现,高温导致雌性斑马鱼雄性化是由于抑制芳香化酶表达[19],从而诱导早期卵母细胞凋亡。高温处理尼罗罗非鱼性腺具有很强的凋亡信号[50],孵化后的青鳉暴露于高温和皮质醇下会抑制雌性生殖细胞的增值和cyp19ala表达,此结果也在Olive flounder(Paralichthys olivaceus)[21,30]、虹鳟[29]有相应报道。因此,抑制雌性性别分化相关通路,抑制原始生殖细胞发育或诱导其凋亡,在应激条件诱导雄性化过程中起关键作用。
本实验主要研究高温和皮质醇处理对黄颡鱼性别分化的影响,研究表明高温和皮质醇处理通过抑制卵母细胞发育,导致性腺细胞发生凋亡,启动精巢发育通路,从而诱导XX遗传型个体雄性化。XX遗传型个体受到高温处理后,一部分个体性腺发育进程加快,一部分个体原始生殖细胞受到抑制甚至凋亡继而发育成生理型雄鱼,它们之间的遗传差异值得我们进一步研究。环境友好型应激条件(如高温、高密度等)诱导鱼类雄性化的研究,将为建立鱼类环境友好型单性种群生产提供重要的理论与生产实践意义。
