配合饲料和鲢鱼肉对大鲵生长的比较试验
2021-02-04张皓迪冯麒凤陈小川黎学练雷登华
张皓迪 王 双 李 虹 冯麒凤 陈小川 黎学练 雷登华 罗 莉
(1.西南大学水产学院,淡水鱼类资源与生殖发育教育部重点实验室,重庆 400715;2.重庆市水产技术推广总站,重庆 400000;3.重庆市开州区水产技术推广站,重庆 405400)
大鲵(Andrias davidianus)俗称“娃娃鱼”,隶属两栖纲(Amphibia)、有尾目(Urodela)、隐鳃鲵科(Cryptobranchidae)、大鲵属(Andrias)[1]。大鲵肉质鲜美、营养丰富,具有极高的食用和药用价值。在大鲵的人工育种和养殖技术已经成熟的背景下[2],其主要饲喂方式依然是鲜活饵料(鱼块、小型水生昆虫、鲜活小杂鱼虾、小型贝类等)[3—5],鲜活饵料经济成本较高、易携带病菌,运输储存困难,饲喂步骤复杂[6,7]。此外,目前市场上没有大鲵配合饲料流通,其饲料研发也处于滞后状态。基于此,本课题组结合大鲵饵料的诱食性、口径等要求,评定了大鲵相关营养需求参数,通过设计大鲵蛋白质需求对比试验,得出了大鲵人工配合饲料的最适蛋白质干基含量(55.7%)[8],并配制出相应的大鲵人工配合饲料。本试验则通过比较人工配合饲料和鲢鱼肉对大鲵生长、常规营养成分、消化和抗氧化能力的差异影响,以期为大鲵人工配合饲料的开发应用提供理论依据和数据支持。
1 材料与方法
1.1 实验饲料
实验用鲜活饵料为鲢,购自重庆北碚天生农贸市场,用绞肉机粉碎后投喂。人工配合饲料以鱼粉、肉粉、血球蛋白粉、酪蛋白和明胶为蛋白源,大豆油为脂肪源设计而成,试验饲料配方及基本营养组成见表1,饲料原料均过40目筛,混合机混匀,挤压制成直径2.0 mm左右的饲料,风干分装,-20°C保存备用,每次投喂前30min取出解冻。
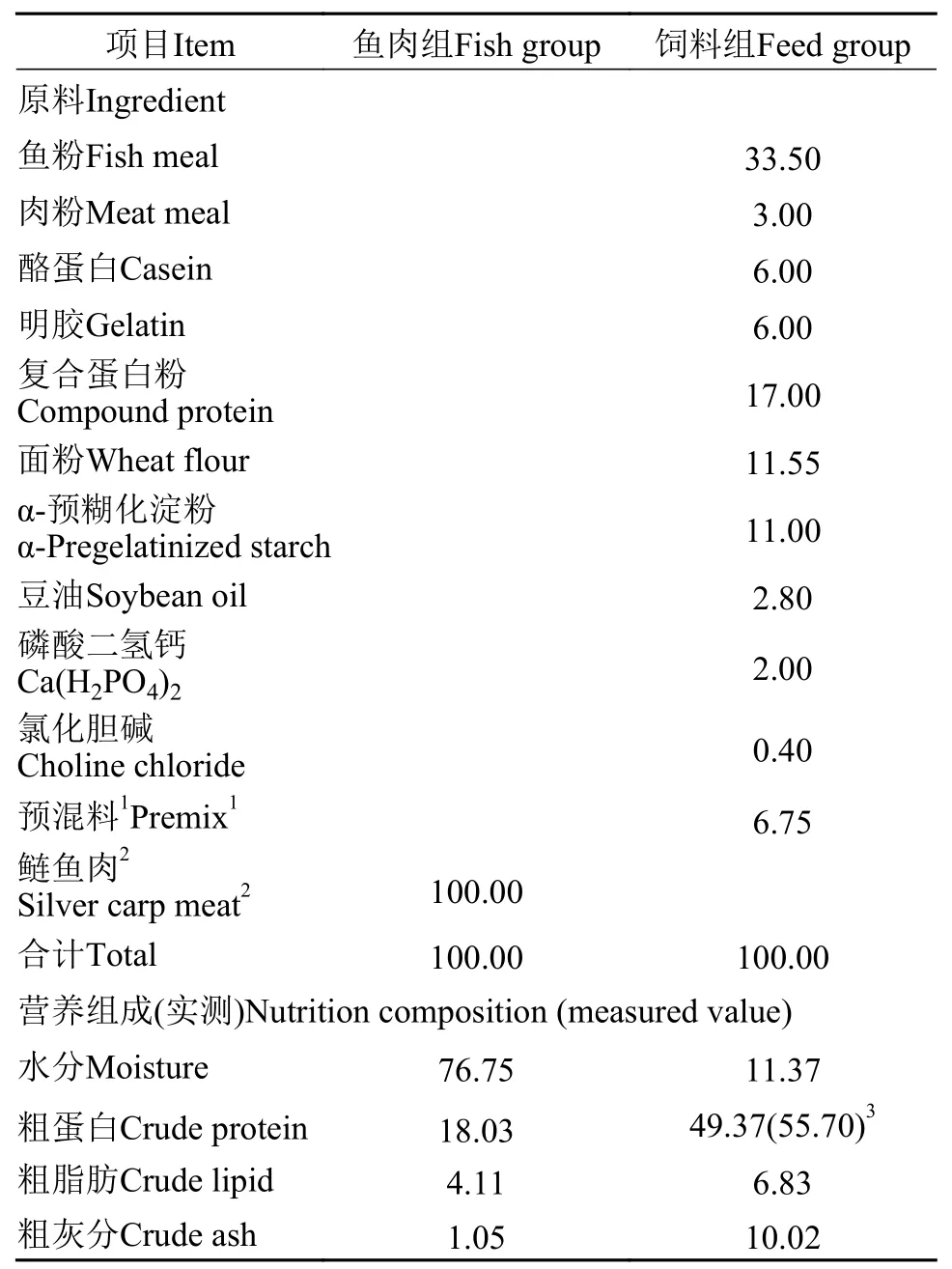
表1 试验饲料配方及主要营养物质(风干基础)Tab.1 Diet feed formula and major nutrients(air-dry basis,%)
1.2 饲养管理
试验用大鲵为陕西省汉中市绿源大鲵养殖场的子二代人工繁殖个体。在正式试验前,先将大鲵经浓度1%的食盐溶液消毒后,在室内的养鱼池驯化两周。随机选择体格健壮、规格一致(20.99±0.15)g的大鲵,分成2组,每组设3个重复,每个重复8尾。试验大鲵饲养于西南大学动物科技学院国家示范中心循环水养殖系统中的塑料方形箱内(规格为:70 cm×45 cm×17.5 cm,水深5 cm),水源为曝气自来水。每天17:00投喂1次,2h后去除剩余饲料,每隔2周对试验大鲵进行称重一次,然后根据试验大鲵的增重情况调整投喂量,正式试验时间92d。因大鲵消化食物时间较长,故连续投喂3d后停食2d。每天早晚换水一次。饲养期间无光照,水温22—25℃,溶解氧>6.0 mg/L,氨氮含量<0.10 mg/L,亚硝酸盐含量<0.10 mg/L,pH在6.5—7.5。
1.3 样品采集
饲养实验结束,大鲵停食3d后对每个重复的重量和尾数进行记录,用于生长数据的统计;每个重复随机选取3尾大鲵用0.01% Ms-222麻醉,测量体长、体高和体质量;然后在冰盘中解剖,剥离肠道和肝脏,滤纸沥干并称重,取背部组织分离出肌肉和皮肤,将所有分离出的组织迅速转入液氮速冻,随后分别置于-80℃冰箱中保存。
在指标测定前,参照谢中国等[9]的方法剪取保存备用的肝脏和肠部并匀浆。按1﹕9(g/mL)加入生理盐水,迅速转入高速分散器匀浆(匀浆过程在冰水浴中进行),后将匀浆液离心(4℃,4000 r/min,10min),取上清液,-80℃保存备用。
1.4 指标测定
生长及形体指标测定:养殖实验结束后,停食3d,准确称量各组大鲵体质量和饲料重,计算其生长指标,计算公式如下:
增重率(Weight growth rate,WGR,%)=(Wt-W0)/W0×100;
特定生长率(Specific growth rate,SGR,%/d)=100×(lnWt-lnW0)/t
尾均摄食量(Feed intake,FI,g/尾)=Wf/N
饲料系数(Feed conversion rate,FCR)=Wf/(Wt-W0);
蛋白质沉积率(Protein retention ratio,PRR,%)=100×(Wt×BP2-W0×BP1)/(F×P);
成活率(Survival rate,SR,%)=Nt/N0×100
式中,Wt为终末均重(g);W0为起始均重(g);t为养殖试验天数;Wf为总摄食饲料的干重(g);N为鱼尾数;BP1、BP2分别为试验鱼初始体粗蛋白质含量和终末体粗蛋白质含量(%);F为饲料摄入量(g);P为饲料粗蛋白质含量(%);N0为初始尾数(尾);Nt为终末尾数(尾)。
常规营养成分测定:试验大鲵饲料、全鲵和肌肉的常规营养成分采用AOAC(1995)[10]方法检测。其中粗蛋白质采用蛋白质测定仪(GB/T 6432-1994)检测,粗脂肪采用索氏抽提仪(GB/T 6433-1994)测定,水分采用105℃恒温烘干法(GB/T 6435-2006)测定,粗灰分采用马弗炉(GB/T 6438-1992)550℃灼烧法测定。
肌肉蛋白质合成能力和皮肤胶原蛋白的测定:采用王桂芹等[11]的方法测定取样肌肉中DNA、RNA含量,并计算RNA/DNA。胶原蛋白含量通过检测羟脯氨酸含量(GB/T 9695.23-2008)再乘以系数11.0计算而得。
组织生化指标的测定:胃蛋白酶和H+-K+-ATP酶,肠道胰蛋白酶、脂肪酶和淀粉酶活性,总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)和丙二醛(MDA)均采用南京建成生物工程研究所生产的试剂盒及其使用方法测定。
1.5 数据处理与分析
试验数据均采用统计软件SPSS 22.0分析。经过单因素方差分析(One-way ANOVA)之后,采用Duncan’s多重比较,P<0.05表示差异显著。除成活率外,数据均以平均值±标准差(Mean±SD)表示。
2 结果
2.1 大鲵生长性能与饲料效率
人工配合饲料和鲢鱼肉会显著影响大鲵的生长性能(表2)。饲料组的大鲵WGR、SGR和PRR显著高于鱼肉组(P<0.05),而两个试验组的FCR无显著差异(P>0.05)。各实验组大鲵成活率均为100%。

表2 大鲵饲喂配合饲料和鲢鱼肉的生长和饲料利用率Tab.2 Growth and feed utilization of giant salamander fed with formula feed and silver carp meat
2.2 大鲵常规营养成分
饲喂人工配合饲料的大鲵的全鲵粗灰分、皮肤胶原蛋白显著高于鱼肉组(P<0.05),而全鲵粗脂肪、肌肉水分和肌肉粗蛋白显著低于鱼肉组(P<0.05),两个试验组的全鲵水分和粗蛋白、肌肉粗脂肪则无显著差异(P>0.05,表3)。

表3 大鲵饲喂配合饲料和鲢鱼肉的全鲵和肌肉组成Tab.3 Whole body and muscle composition of giant salamander fed with formula feed and silver carp meat(%)
2.3 大鲵消化酶活性
投喂鲢鱼肉的大鲵胃蛋白酶显著高于饲料组,而两个试验组的大鲵胃H+-K+-ATP酶活性和肠道的胰蛋白酶活性、脂肪酶活性和淀粉酶活性都无显著差异(P>0.05,表4)。

表4 大鲵饲喂配合饲料和鲢鱼肉的胃肠道消化酶活性Tab.4 Gastrointestinal digestive enzymes activity of giant salamander fed with formula feed and silver carp meat
2.4 大鲵肌肉蛋白质合成能力
饲料组的大鲵肌肉中RNA、DNA和RNA/DNA比值显著高于鱼肉组的大鲵(P<0.05,图1和图2)。

图1 大鲵饲喂配合饲料和鲢鱼肉的肌肉中RNA、DNA含量Fig.1 Muscle RNA and DNA levels of giant salamander fed with formula feed and silver carp meat
2.5 大鲵肝脏和肠道抗氧化能力
饲料组的大鲵肝脏T-AOC和SOD活性显著高于鱼肉组(P<0.05);饲料组的大鲵肝脏MDA含量则显著低于鱼肉组(P<0.05);而2个试验组大鲵的肠道T-AOC、SOD活性和MDA含量无显著差异(P>0.05,表5)。

图2 大鲵饲喂配合饲料和鲢鱼肉的肌肉中RNA/DNA比值Fig.2 Muscle RNA/DNA ratio of giant salamander fed with formula feed and silver carp meat
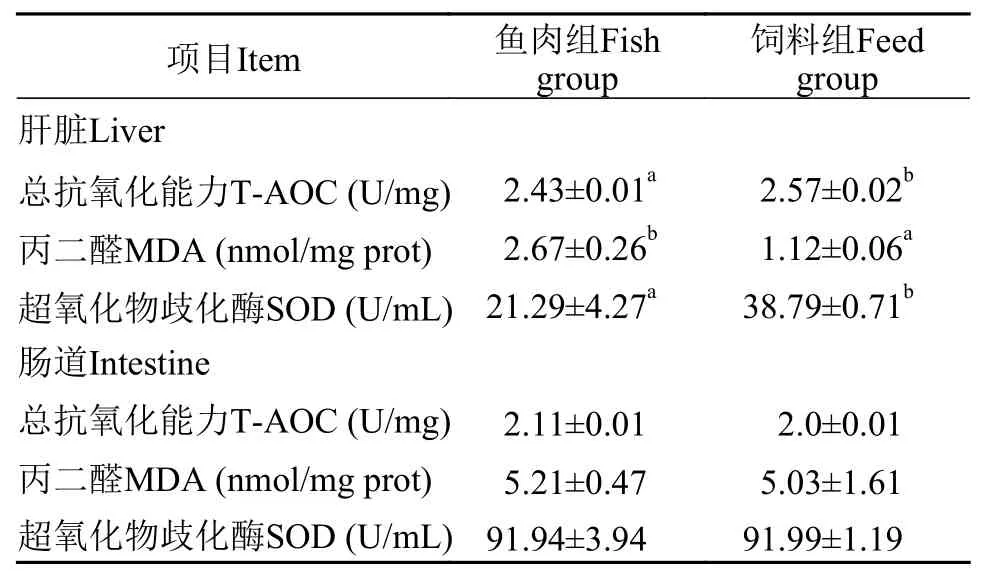
表5 大鲵饲喂配合饲料和鲢鱼肉的抗氧化能力Tab.5 Antioxidant capacity of giant salamander fed with formula feed and silver carp meat
3 讨论
3.1 配合饲料和鲢鱼肉对大鲵生长性能与饲料效率的比较
研究发现,野生大鲵主要以动物性饵料为食,幼鲵时期喜食小型无脊椎动物,如水蚯蚓(Sludge worms)、水蚤(Water fleas)、水生昆虫幼虫等;成鲵阶段则以小鱼、小虾及贝类等为食[7]。然而长期以来,人工养殖大鲵均没有相应的配合饲料,加上大鲵视觉退化,惧光、声,捕食方式为“守株待兔”,在生产上其饲喂饵料通常是鲜活和冰鲜鱼肉。为解决这种困境,本课题组在尝试多种肉食性鱼类配合饲料投喂大鲵开口失败的基础上,使用4种昆虫饵料黑水虻(Hermetia illucens)、蝇蛆(Fly maggots)、家蚕(Bombyx moris)和黄粉虫(Tenebrio molitors))进行饲喂试验,发现大鲵尤其喜食黄粉虫。于是我们在按照大鲵营养需求配制的人工配合饲料中加入适量黄粉虫及其他诱食性氨基酸组成复合蛋白粉诱导大鲵摄食。在本试验中投喂饲料的大鲵WGR、SGR和PER显著高于投喂鲢鱼肉的大鲵,且饲料组增重率较鱼肉组提高了53.5%,说明人工配合饲料符合大鲵幼体快速生长的营养需求,可大幅度提升大鲵的蛋白质沉积。该结果与大口黑鲈(Micropterus salmoides)[12]、大菱鲆(Scophthalmus maximus)[13]、鳜(Siniperca chuatsi♀×Siniperca scherzeri♂)[14]等养殖肉食性鱼类的研究结果存在差异。这可能与鱼的不同种类有关,分析其他原因还有:(1)相比鲢鱼肉,人工配合饲料颗粒小、水分含量低、大鲵幼体需要摄入更多干物质基础的人工配合饲料才有饱感;(2)摄食人工配合饲料的大鲵幼体抗氧化能力较好,进而体质好,摄食量更高。此外,两个实验组的FCR无显著差异,且FCR低于一般养殖鱼类(表2),这可能与大鲵喜静不喜动,活动水平低,摄食饵料中大部分能量用于生长消耗相关,也说明人工配合饲料可以达到鲜活鲢鱼肉相同的饵料转化水平。
3.2 配合饲料和鲢鱼肉对大鲵营养组成的比较
养殖鱼类的品质与其饲料的营养组成有着密切的关系,高蛋白质低脂肪含量鱼类的肉质和营养价值更高[15,16]。在本试验中投喂饲料的大鲵全鲵粗脂肪显著低于投喂鲢鱼肉的大鲵,这可能是因为饲料中含有多种矿物质元素,有利于大鲵生长过程中的脂肪消耗,达到降脂的效果。此外,饲料组的全鲵粗灰分显著高于鱼肉组,说明摄食人工配合饲料的大鲵含有较多的矿物质及微量元素等营养物质。本实验还发现,鱼肉组的大鲵肌肉中的水分和粗蛋白含量显著高于饲料组,而粗脂肪含量无显著差异,与稀有逗鲫(Gobiocypris rarus)[17]、褐牙鲆(Paralichthys olivaceus)[18]研究结果相似。该结果产生的原因可能是一方面鲢鱼肉水分含量高,促进大鲵摄取较多的水分,另一方面鲜活饵料可能直接为大鲵提供有助于消化饵料中脂肪和蛋白的未知酶及肠道有益微生物[19]。综合来看,人工配合饲料能有效改善大鲵的肉体品质。
人工养殖大鲵皮中的胶原蛋白占鲵皮干质量的60.66%,这些胶原蛋白可能具有一些陆生动物胶原蛋白没有的特殊功能[20]。而且研究表明大鲵皮中的活性胶原蛋白COLLAGEN具有嫩白容颜、祛皱等美容功效[21]。本实验发现,饲料组的大鲵皮肤胶原蛋白含量高于鱼肉组,可能是因为饲料蛋白水平高且富含大量作为胶原蛋白水解产物的明胶,提供较多的脯氨酸和赖氨酸。此外,人工配合饲料营养组成完全,含有许多与维生素C类似的辅助因子,促进机体羟基化反应,使脯氨酸和赖氨酸转化为构成胶原蛋白的羟脯氨酸和羟赖氨酸,从而促进大鲵皮肤胶原蛋白的生成[22]。
3.3 配合饲料和鲢鱼肉对大鲵消化能力的比较
有胃鱼对食物的消化过程分为胃部的蛋白质变性和胃蛋白酶作用,之后肠道内胰蛋白酶等为酶原激活并进行消化,包括对蛋白质、肽、糖、脂肪等的消化与吸收,整个过程主要依靠胃肠道消化酶催化作用进行化学性消化,而消化酶活性会受鱼类食性和食物组成成分的影响[23]。本实验发现,饲料的蛋白水平高于鲢鱼肉(表1),但鱼肉组的大鲵胃蛋白酶显著高于饲料组。分析这可能与大鲵摄食人工配合饲料和鱼肉在胃部的消化行为存在差异性有关,包括鲜活饵料可以通过自溶或作为酶原来激活鱼体内源性消化酶,或者通过含有肠道神经肽或营养“生长”因子促进鱼类消化,而人工配合饲料缺乏这类物质并含有少量抗营养因子,在一定程度上影响胃蛋白酶的分泌[24,25]。本实验还发现,投喂饲料和鲢鱼肉的大鲵的肠道消化酶活性无显著差异,说明饲喂人工配合饲料和鲢鱼肉的大鲵肠道分解蛋白质、脂肪和碳水化合物的酶活性相当,反映了人工配合饲料对类似鲢鱼肉鲜活饵料的可替代性。此外,2个试验组的淀粉酶活性都较一般养殖鱼类低,这可能与大鲵作为肉食性两栖动物,消化道较短,对淀粉等碳水化合物的利用能力较弱有关。
3.4 配合饲料和鲢鱼肉对大鲵蛋白质合成能力的比较
鱼类生长的实质是体内蛋白质的合成,表观上是鱼体积和体重的增加,内在表现是组织体积的增加、细胞数量的增多以及物质和能量的积累。相关研究表明,肌肉中DNA含量反映细胞的有丝分裂速率,RNA含量反映蛋白质合成速率,而RNA/DNA比值则与细胞效率,即单个细胞合成蛋白质的速率成正相关,其在水产动物中作为短期内反映机体代谢活动的生长指标[26,27]。Buckley[28]对大西洋鳕的研究中发现肌肉RNA/DNA比值与饵料营养水平和生长速率有高度的正相关关系。本实验结果显示饲料组的大鲵DNA、RNA、RNA/DNA比值显著高于鱼肉组,说明人工配合饲料可以加快肌肉细胞分裂速率,提高肌肉蛋白质合成能力,明显提升大鲵生长性能。
3.5 配合饲料和鲢鱼肉对大鲵抗氧化能力的比较
由于正常的细胞功能,鱼体内会不断产生自由基和活性氧,而T-AOC体现了酶系统和非酶系统对抗这些自由基的抗氧化防御能力,SOD作为其中主要的抗氧化酶之一,可以将超氧自由基分解为分子氧和过氧化氢。MDA是脂质过氧化反应的主要代谢产物,其含量高低可以反映机体细胞受到自由基攻击的严重程度[29]。在本实验中,2种饵料对大鲵肝脏抗氧化效果有显著差异,对肠道的抗氧化效果差异不显著,这可能是由于肝脏是鱼体的主要抗氧化场所,具体原因还有待进一步探究。本实验还发现饲料组的SOD和T-AOC活性显著高于鱼肉组,而MDA含量则相反,说明投喂人工配合饲料的大鲵肝脏抗氧化酶活性升高,机体清除自由基的能力增强,投喂鲢鱼肉的大鲵可能因为鲢鱼肉中脂肪氧化腐败或肝脏脂肪代谢发生障碍,使大鲵肝脏抗氧化酶活性降低,MDA含量增加。
4 结论
综上所述,在本实验条件下,大鲵可主动摄食人工配合饲料,而且从大鲵的生长性能、常规营养成分、消化酶活性和抗氧化能力等方面综合考虑,人工配合饲料可以替代新鲜饵料成为大鲵的主要饵料。
