某院新生儿重症监护病房早产儿肠外营养处方分析
2021-02-04孙静秦侃
孙静,秦侃
(安徽医科大学第三附属医院药学部,合肥 230061)
新生儿重症监护病房(neonatal intensive care unit,NICU)收治的多是病情严重的患儿如脓毒血症、呼吸窘迫综合征或者早产儿、超低出生体质量儿,出生后存在喂养不耐受、肠内营养无法满足营养需求或者存在新生儿坏死性小肠结肠炎等胃肠道疾病需要禁食的情况,这时需要通过肠外营养(parenteral nutrition,PN)补充能量以满足机体需求。肠外营养常被视为一种短期过渡手段,在可实施完全肠内营养之前提供营养支持。但肠内营养仍是推荐的营养方式,在患儿条件许可的情况下,要尽早开始肠内营养,当肠内营养可以满足患儿需求时,应尽快停用肠外营养。
根据出生时胎龄分类,将胎龄(gestational age,GA)<37周的新生儿称为早产儿。早产儿尤其是低出生体质量儿,胃肠道发育不健全,消化吸收能力较差,可能存在喂养不耐受,肠内营养不能满足需求;早产儿进行追赶性生长,如果能量需求得不到满足,可能导致宫外生长迟缓,尤其对神经系统等产生较大影响,如认知、行为能力受损;相反,如果营养摄入过多,也会增加患儿器官负担,导致过度喂养,造成高血糖等[1]。对于早产儿即使饥饿1 d,损伤也是巨大的,且早产儿胃肠道功能弱,肠内营养不能很好耐受,因此国内外指南均指出早产儿出生后应及时建立肠外营养[2-3]。笔者通过分析我院NICU早产儿营养处方,了解存在的问题,以期反馈给临床,促进NICU早产儿肠外营养的合理使用。
1 资料与方法
1.1研究对象 选取2017年8月1日—2018年8月1日入住我院NICU并使用肠外营养的早产儿,对其肠外营养方案进行收集和回顾性分析,纳入标准:①出生后即入住NICU;②早产儿,即出生胎龄<37周;③入院期间使用肠外营养;排除入院时间<3 d的患儿。
1.2研究方法 采用回顾性调查,按照出生时胎龄进行分类,收集其性别、是否双胎、分娩方式、母亲是否有合并症、出生体质量、出院体质量、肠外营养维持时间、氨基酸起始采用时刻、氨基酸起始剂量、脂肪乳起始采用时刻、脂肪乳起始剂量、体质量平均增长速度、住院时间、肠外营养组方等数据,按照《中国新生儿营养支持临床应用指南》[2]以及国外新生儿营养相关指南和文献进行评估分析。
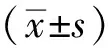
2 结果
2.1出生时基本资料 符合纳入标准的早产儿共65例,总共统计肠外营养处方600张。按GA不同分为GA>34周和GA<34周两组,分别为32和33例。
2.1.1早产儿出生时基本信息 符合纳入标准的早产儿共65例,男41例(63.1%),女24例(36.9%);双胎11例(16.9%),单胎54例(83.1%);剖宫产31例(47.7%),顺产34例(52.3%);母亲有并发症者34例(52.3%),母亲无并发症者31例(47.7%);出生体质量(1.9±0.3) kg,出生身长(43.1±2.9) cm,出生头围(29.6±2.8) cm,出生胸围(28.6±2.7) cm。65例使用肠外营养的患儿中,使用脐静脉置管2例(3.1%),未用脐静脉置管63例(96.9%)。
2.1.2GA>34周和GA<34周两组早产儿出生时基本信息 两组在性别、双胎比例、分娩方式、母亲合并症比例比较差异无统计学意义;两组在出生体质量、出生身长、出生头围和出生胸围比较均差异有统计学意义(均P<0.05)。见表1。
2.2早产儿住院期间肠外营养使用情况 两组早产儿在氨基酸起始采用时间、氨基酸起始剂量、脂肪乳起始采用时间、脂肪乳起始剂量的比较均差异无统计学意义(P>0.05)。见表2。
2.3两组住院期间体质量增长速度、出院体质量、肠外营养维持时间、住院时间差异 两组早产儿出院体质量差异无统计学意义,但体质量增长速度、肠外营养维持时间以及住院时间比较均差异有统计学意义(均P<0.05)。见表3。
2.4肠外营养处方的合理性 我院肠外营养的输注途径包括外周静脉、经外周插入的中心静脉导管(peripherally inserted central venous catheters,PICC)和脐静脉,使用处方数分别为510,64,26张,早产儿常用的TPN处方药品种类主要有如下几种,①葡萄糖类:5%葡萄糖注射液、10%葡萄糖注射液、50%葡萄糖注射液;②脂肪乳类:20%中/长链脂肪乳注射液(C6-24);③氨基酸类:小儿复方氨基氨酸注射液(18AA- I);④电解质类:10%氯化钠注射液、0.9%氯化钠注射液、10%氯化钾注射液;⑤维生素类:注射用维生素C 、脂溶性维生素注射液(Ⅱ)、注射用水溶性维生素、核黄素磷酸钠。PN使用合理情况见表4。

表1 GA>34周和GA<34周两组早产儿出生时基本信息比较

表2 GA>34周和GA<34周两组早产儿肠外营养使用情况的比较

表3 两组早产儿住院期间体质量增长速度、出院体质量、肠外营养维持时间以及住院天数的比较

表4 PN营养素使用情况
3 讨论
3.1肠外营养输注途径及渗透压 常用的肠外营养输注途径有两种:外周静脉营养(peripheral parenteral nutrition,PPN)和中心静脉营养(central parenteral nutrition,CPN)。PPN可用于短期需要肠外营养支持的患儿,通常首选中心静脉导管,因为相比于经外周静脉导管给予肠外营养,中心静脉导管如PICC可给予渗透压更高的肠外营养溶液。使用中心静脉导管还可增加营养素摄入量,降低更换导管的需求。PICC通常不需要全身麻醉就可以插入,并已证明对新生儿和儿童是安全的,尽管有少量和级别较弱的证据证明使用PICC置管超过14~21 d增加导管相关性血流感染[4]。
脐静脉置管(umbilical vein catheter,UVC)是新生儿相较于婴幼儿和成人特有的,新生儿出生3~5 d内,静脉导管尚未闭合,经脐静脉的插管一般可进入下腔静脉建立静脉通道。一项在出生体质量<1251 g的早产儿比较长期和短期使用脐静脉置管的随机研究中[5],长期组(脐静脉置管28 d)104例与短期组(脐静脉置管7~10 d后,换用PICC)106例,感染发生率、感染持续时间和其他相关并发症均无明显差异;有限的证据表明长期组脐静脉置管14 d后,导管感染发生风险增加,具有潜在的临床意义。一项关于极低出生体质量儿脐静脉置管导致静脉血栓发生的高危因素包括:出生的第1周,红细胞压积>55%是唯一显著的、独立相关的因素;对于极低出生体质量儿,胎龄较大的血栓发生率比胎龄小的高;脐静脉置管时间越长,血栓的发生率越高[6]。综上所述,脐静脉置管多用于极低出生体质量儿,置管时间最好少于14 d。本研究65例患儿中有2例患儿使用脐静脉置管给予肠外营养,均为极低出生体质量儿(体质量<1500 g),1例患儿脐静脉置管14 d后改用外周静脉,1例患儿脐静脉置管14 d后改用中心静脉,因此使用脐静脉置管的人群及使用时间均是适宜的。
外周静脉肠外营养适用于接受较低渗透浓度(通常建议≤900 mOsm·L-1)营养液的短期治疗[2],高渗营养液易引起血栓性静脉炎,对于肠外营养时间超过14 d且为高渗营养液的患者,建议使用中心静脉置管[7]。文献报道[8]新生儿外周静脉导管局部并发症发生率较高(63.15%),危险因素是感染、穿刺日体质量、气管插管、输注基础计划、使用TPN、输血和输注其他药物,穿刺后48 h内发生并发症的风险较高。对于新生儿,PPNs≤900 mOsm·L-1线性相关事件的发生率为50/每百人天数,PPNs> 900 mOsm·L-1线性相关事件的发生率为52/每百人天数[RR=1.02,95%CI(0.88,1.18)];PPN的最终渗透压不影响线性相关事件的发生率[9]。PPN的渗透压> 1000 mOsm·L-1比≤1000 mOsm·L-1显著增加浸润(17%和7%,P=0.01)和静脉炎或浸润的复合研究终点(45%和34%,P=0.02);多因素分析显示,渗透压> 1000 mOsm·L-1是发生并发症的独立危险因素[OR=1.67,95%CI(1.08,2.52),P=0.02][10]。当使用外周静脉输注肠外营养时,渗透压应低于900 mOsm·L-1以降低静脉血栓的发生风险[11]。600张肠外营养处方中,PICC和脐静脉置管的肠外营养渗透压均在合理范围(1300~1800 mOsm·L-1)[12]之内。
综上所述,建议使用PPN时,渗透压应低于900 mOsm·L-1,对于新生儿如有必要应控制在1000 mOsm·L-1内,并且PPN只能在获得中心静脉置管或过渡至肠内喂养前暂时短期使用(<2周)。510张使用外周静脉给予肠外营养处方中渗透压>900 mOsm·L-1的处方298张,占49.7%。对于使用PPN处方渗透压>900 mOsm·L-1尤其是渗透压>1000 mOsm·L-1患儿,应密切监测,如果患儿出现静脉炎的风险,且评估仍需继续使用肠外营养,应建议医生启用CPN。
3.2氨基酸的启动和起始剂量 因为生长发育所需,儿童比成人需要更多的必需氨基酸[12],尤其是新生儿,其肝功能不成熟,推荐选用小儿专用氨基酸注射液[12]。我院NICU使用小儿复方氨基酸注射液(18AA- I),规格为20 mL:1.348 g总氨基酸。
新生儿出生后24 h内即可应用(肾功能不全者例外),从1.5~2 g·kg-1·d-1起始[2],对于早产儿[13]应在出生后第1天开始供应氨基酸,每天至少1.5 g·kg-1,以达到合成代谢状态,避免因子宫内连续喂养中断而引起的代谢性休克。提供最佳的氨基酸摄入量与较低的高血糖风险有关,这可能是由于刺激胰岛素分泌[14-15]。
早期给予氨基酸可增加早产儿的合成代谢和短期生长发育,但对于早产儿的长期生长发育以及神经发育的影响结果很少[13]。有文献报道在早期或大剂量氨基酸补充后生长或发病率差异无统计学意义,在出生后24 h内开始给予氨基酸似乎是安全的,并具有良好的耐受性,可更快地达到正氮平衡[16]。
GA>34周和GA<34周两组早产儿氨基酸的起始时间和起始剂量的差异无统计学意义,65例患儿氨基酸平均起始剂量为(1.07±0.41) g·kg-1·d-1,小于早产儿氨基酸推荐起始剂量1.5 g·kg-1·d-1(P<0.01)。在以后的临床工作中,对于早产儿的肠外营养,除肾功能不全者,建议医生起始剂量尽量从1.5 g·kg-1·d-1,以使患儿尽早达到正氮平衡。
3.3脂肪乳的启动和起始剂量 脂肪乳对静脉无刺激,可提高能量的摄入和体内氮储存,提供必需脂肪酸。脂肪乳剂在出生后24 h内即可应用,推荐剂量从1 g·kg-1·d-1开始[2],早产儿建议采用20%中长链混合型脂肪乳剂。我院NICU使用中长链脂肪乳注射液(C6-24),规格为20%:250 mL。
文献指出,对于极早早产儿(GA<28周),出生后2 d内使用脂肪乳耐受性好,并未出现呼吸困难、慢性肺部疾病、败血症、动脉导管未闭、坏死性小肠结肠炎、脑室出血、早产儿视网膜病变或者死亡[17]。早产儿早期给予脂质对氮平衡具有积极影响[17]。由于葡萄糖输注速度不应超过儿童最大葡萄糖氧化率17.3 g·kg-1·d-1(12 mg·kg-1·min-1),使用脂质作为能量来源可以降低葡萄糖输注速度,从而满足总能量需求。
GA>34周和GA<34周两组早产儿脂肪乳起始时间和起始剂量差异无统计学意义,65例患儿脂肪乳起始剂量(1.17±0.34) g·kg-1·d-1,大于早产儿脂肪乳推荐的起始剂量1 g·kg-1·d-1。对于极低出生体质量儿过高的脂肪乳(出生后即给予脂肪乳2~3 g·kg-1·d-1)可能导致高三酰甘油和高血糖,甚至需要使用胰岛素进行治疗[18]。因此对于新生儿尤其是早产儿的脂肪乳起始剂量最好是按照指南推荐的1 g·kg-1·d-1,最大不应超过2 g·kg-1·d-1。
3.4住院期间体质量增长速度、出院体质量、肠外营养维持时间、住院时间差异 GA>34周和GA<34周两组患儿出生时基本情况差异无统计学意义,在体质量增长速度、肠外营养维持时间以及住院时间等方面均差异有统计学意义(P<0.05),出院体质量差异无统计学意义。这可能是因为胎龄越小,胃肠道等代谢功能越差,对于胎龄较小的新生儿需要更长的肠外营养时间和住院时间,以达到追赶式生长。GA<34周患儿肠外营养维持时间及住院时间均高于GA>34周的患儿,因此尽管两组出生体质量比较差异有统计学意义,但最终两组出院体质量比较差异无统计学意义。
早产儿在住院期间的生长参照正常胎儿在宫内的生长速率,平均体质量增长15 g·kg-1·d-1 [19]。GA>34周早产儿体质量增长速度(11.91±5.16) g·kg-1·d-1,GA<34周早产儿(15.96±5.8)g·kg-1·d-1,胎龄越大增长速度越慢。由于研究中很多早产儿存在混合喂养,无法获得母乳和配方奶的准确摄入量,因此无法计算早产儿每天获得的总能量。考虑出现这种结果可能与早产儿每天获取能量的差异相关。另外有文献报道妊娠期和婴儿早期的生长速度并不是一成不变的,上述生长速度似乎仅对某些时间段是准确的[20]。通常还存在感染或喂养不耐受导致的生长缓慢时期,需要在其他时间加速生长来代偿[21]。综上所述,针对NICU的早产儿,不仅要加强GA<34周早产儿的营养,更要关注GA>34周早产儿的营养;不仅要关注早产儿在NICU中的营养管理,也要关注早产儿出院以后的营养管理,对于出院前体质量增长不满意(<15 g·kg-1·d-1)的患儿出院后应强化营养[19]。
3.5肠外营养组方 我院肠外营养的组方种类基本符合要求,但在维生素制剂的补充上存在不规范现象。新生儿肠外营养时需补充13种维生素[2],包括4种脂溶性维生素和9种水溶性维生素,目前国内尚无小儿专用维生素制剂,临床上一般应用成人维生素混合制剂。《维生素制剂临床应用专家共识》[22]指出市场上脂溶性维生素注射液(I)供11岁以下儿童使用,脂溶性维生素注射液(Ⅱ)供成人和>11岁儿童使用。我院使用的脂溶性维生素注射液(Ⅱ)说明书中也指出适用于成人和>11岁儿童使用,新生儿使用属于用药不适宜。
62.5%患儿未使用脂溶性维生素,33.5%患儿未使用水溶性维生素。对于接受肠外营养的婴幼儿应当肠外给予水溶性维生素和脂溶性维生素[23],由于脂溶性维生素在母体胎儿中的转运有限,尤其是低出生体质量儿在出生时体内维生素的储存量低,早产儿出现脂溶性维生素缺乏的风险较高,因此建议早产儿从出生的第1天起就给他们提供足够的脂溶性维生素。也应当定时给予水溶性维生素,因为婴幼儿体内除了维生素B12,其他水溶性维生素储存不足,另外水溶性维生素过量后由肾脏排出,毒性较小[23]。因此我院NICU早产儿的营养处方中维生素制剂的添加存在很大问题,需要后期改进。
外周静脉通道输注的肠外营养,所能耐受的最高糖浓度仅12.5%,本研究中经外周静脉输注的510张处方中,10.2%存在糖浓度超过12.5%,糖浓度增高有产生静脉炎的风险。
脂肪乳剂作为一种静脉营养制剂,可提供热量及必需脂肪酸,且无氨基酸及糖类溶液升高渗透压的缺点。目前还不能确定早产儿安全摄入的最大脂质量,大多数研究将脂质的摄入量控制在3~4 g·kg-1·d-1 [2,17]。研究表明[17],对于婴幼儿注入脂质量应该与脂质氧化能力相适应,儿童最大脂质氧化率为3 g·kg-1·d-1,超过代谢利用率的脂质将储存在脂肪中,增加发生脂肪超载的风险,从而可能损伤免疫功能。在肠外营养的非蛋白热量中通常葡萄糖供能占50%~70%,而脂肪乳供能占30%~50%,一般情况下脂肪乳供能不应超过60%[7],即糖脂比为(1~2):1。我院600张处方中糖脂比<1:1的处方80份,提示肠外营养中主要由脂肪供能,可能存在脂肪超载的风险;糖脂比>2:1的处方175张,提示肠外营养主要由糖供能,可能存在患儿能量不足或者糖浓度过高的风险。
补充氨基酸的目的是为患儿提供必需氨基酸,而不是提供能量,指南指出氮:非蛋白热卡=1 g:(100~200)[2],热氮比指非蛋白热卡与氮量的比值。我院600张肠外营养处方中56张热氮比<100:1,48张处方热氮比>200:1。我院肠外营养处方中仍存在热氮比不符合标准的情况。
一般要求[24]肠外营养液中一价阳离子应<150 mmol·L-1,二价阳离子应<5 mmol·L-1,本研究处方一价、二价阳离子浓度均符合要求。
肠外营养提供葡萄糖量应追求满足能量需求与过量葡萄糖负荷风险之间的平衡,应避免摄入过多葡萄糖,因为它可能导致血糖升高、脂肪堆积和血脂升高,新生儿血糖>8 mmol·L-1会增加发病率和死亡率[25]。早产儿葡萄糖起始可以给予4~8 mg·kg-1·min-1,最大剂量不超过11~14 mg·kg-1·min-1,我院早产儿肠外营养处方糖速均低于14 mg·kg-1·min-1。
600张处方中,有9张处方使用维生素C,50张处方使用核黄素磷酸钠。不推荐在全营养混合液(total nutrient admixture,TNA)中额外补充维生素C注射液,以免生成草酸钙沉淀[24]。我院NICU补充葡萄糖酸钙不通过肠外营养,而是外周静脉单独输入,因此不存在维生素C和葡萄糖酸钙发生配伍的情况,但由于新生儿肠外营养需补充多种维生素,不建议单纯补充一种或两种维生素。
我院NICU早产儿肠外营养处方仍存在一定的问题,需要与医生进一步沟通加以解决。早产儿大多数需要进行肠外营养支持治疗,作为参与NICU患儿治疗的临床药师,需要了解肠外营养相关知识,尝试利用信息化手段提高效率[26],审核肠外营养处方并对患儿进行监护,同时对患儿家长进行宣教,避免患儿出院后发生生长迟缓。
