一测多评法测定板蓝根中6种化学成分的含量
2021-02-03董福越李楚源王德勤
黄 远,董福越,李楚源,王德勤
广州白云山和记黄埔中药有限公司,广东 广州 510515
板蓝根为十字花科植物菘蓝Isatis in digoticaFortune 的干燥根,主要含有木脂素类、生物碱类、核苷类等活性成分,具有清热解毒、凉血利咽的功效[1]。现代药理学研究表明,木脂素(lignan)具有抗病毒、抗炎、抗氧化、抗肿瘤和保肝等多种药理活性和重要的应用价值[2-9]。核苷(nucleoside)是中成药抗病毒的活性成分[10-13],在板蓝根药材中含量较高且易溶于水,对板蓝根及其制剂的疗效和质量影响较大;板蓝根的生物碱类(alkaloids)成分能够抗炎、抗病毒、解热[14]。然而,现行《中国药典》板蓝根的含量测定项下仅采用HPLC 测定水提液中的(R,S)-告依春的含量作为质量控制指标,对板蓝根尚未建立完善的质量控制方法[15-16]。因此,多成分、多指标的控制方法对评价功效多样、成分复杂的板蓝根的质量研究有重要意义[17-21]。本研究采用一测多评(QAMS)技术,选取价廉易得的生物碱类化合物(R,S)-告依春作为参照物,建立其与木脂素类化合物直铁线莲宁B 以及核苷类化合物胞苷、尿苷、鸟苷、腺苷的相对校正因子,实现通过只测定板蓝根的(R,S)-告依春的含量,用校正因子计算出另外5 种木脂素类和核苷类成分的含量,从而简便快捷、全面准确地对板蓝根进行多指标的质量评价,有助于保证该产品的质量可控和疗效稳定,同时节约检测成本和时间。
1 仪器与试药
1.1 仪器
Agilent 1260 高效液相色谱仪(美国安捷伦公司);UltiMate 3000 系列高效液相色谱仪(美国Thermo Scientific Technologies 公司);Waters 2695高效液相色谱仪(美国Waters 公司);色谱柱Agilent ZORBAX-C18(250 mm×4.6 mm,5 µm);色谱柱Waters Xbridge-C18(250 mm×4.6 mm,5µm);色谱柱Phenomenex Kinetex-C18(250 mm×4.6 mm,5 µm);BT 214D 型电子分析天平(北京赛多利斯仪器系统有限公司);CP225D 型电子分析天平(Sartorius AG 公司)

图2 混合对照品 (A) 与板蓝根样品 (B) 的HPLC 色谱图Fig.2 HPLC chromatograms of mixed references (A) and sample (B)
1.2 试药
对照品(R,S)-告依春(批号111753-201706,质量分数为99.9%)、尿苷(批号110887-201803,质量分数为99.5%)、鸟苷(批号111977-201501,质量分数为93.6%)、腺苷(批号110879-201703,质量分数为99.7%)均由中国食品药品检定研究院提供,胞苷(批号B20073,质量分数为98%)由源叶生物有限公司提供,直铁线莲宁B(批号hysC201811,质量分数为99%)由广州呼研所制药有限公司提供。甲醇(色谱纯,美国Tedia 公司),甲醇(分析纯,广州化学试剂厂),水为超纯水。
板蓝根(批号1807003、1805015、1808008、1805011、1805012、1805013、18wdct、18bjz、18nm、18dtly、18mLsb、18gjwzc、1805010、1806004、18nxgy、2017dq、1805014、18dtxh、18mLxt、18esyc、18dsc、18ftkfq、18gfc)由广州白云山和记黄埔中药有限公司提供。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent ZORBAX SB-C18(250 mm×4.6 mm,5 µm);流动相为水(A)-甲醇(B),梯度洗脱:0~3 min,3% B;3~20 min,3%~8%B;20~25 min,8%~22% B;25~35 min,22%B;35~36 min,22%~25% B;36~48 min,25%B;48~50 min,25%~90% B;50~60 min,90%B;体积流量0.8 mL/min;柱温30 ℃;检测波长254、230 nm;进样体积10 µL。色谱图见图1。
2.2 混合对照品溶液的制备
精密称取 (R,S)-告依春、直铁线莲宁B、胞苷、尿苷、鸟苷和腺苷对照品适量,加甲醇溶解并稀释至刻度,摇匀,制成含(R,S)-告依春质量浓度为 28.96、57.92、115.8、289.60、579.20 μg/mL,直铁线莲宁 B 质量浓度为 3.2、6.4、12.7、25.4、63.6 μg/mL、胞苷质量浓度为2.2、4.3、8.6、17.3、43.2 μg/mL,尿苷质量浓度为3.8、7.7、15.4、30.7、76.8 μg/mL,鸟苷质量浓度为3.8、7.8、15.5、31.0、77.6 μg/mL 和腺苷质量浓度为2.8、5.6、11.2、22.4、56.0 μg/mL的混合对照品溶液,并于 4 ℃冰箱中避光保存,备用。
2.3 供试品溶液的制备
取板蓝根药材1 g(过60 目筛),精密称定,置具塞锥形瓶中,精密加入5%甲醇溶液25 mL,称定质量,超声提取(40~50 ℃,250 W,80 kHz)1 h,放冷,称定质量,用5%甲醇补足超声过程减失的质量,滤过,取续滤液,过0.22 µm 微孔滤膜,即得供试品溶液。
2.4 方法学验证
2.4.1 线性关系考察 分别精密吸取6 个系列浓度的混合对照品溶液,各 10 μL,注入高效液相色谱仪,按上述色谱条件测定,测定各对照品的峰面积,取平均值。以各溶液质量浓度(X)对峰面积积分值(Y)进行回归处理,得(R,S)-告依春、直铁线莲宁 B、胞苷、尿苷、鸟苷和腺苷的线性方程和相关系数(R2)。结果表明,各对照品的进样量与峰面积均呈良好的线性关系(表1)。

表1 6 种成分的线性回归方程Table 1 Linear regression equations of six components
2.4.2 精密度试验 精密吸取“2.2”项下的混合对照品溶液10 µL,按“2.1”项下条件,连续进样6 次。结果显示在230 nm 下,(R,S)-告依春、直铁线莲宁B 的RSD 分别为0.33%、0.58%;在254 nm下(R,S)-告依春、胞苷、尿苷、鸟苷和腺苷的RSD分别为0.35%、0.58%、0.45%、0.41%、0.45%。
2.4.3 重复性试验 取批号为1808008 的板蓝根药材,按照“2.3”项平行制备供试品溶液6 份,按“2.1”项下条件,进行测定,在254 nm 下(R,S)-告依春、胞苷、尿苷、鸟苷和腺苷的RSD 分别为0.81%、1.56%、1.96%、1.65%、3.15%;在230 nm下(R,S)-告依春、直铁线莲宁B 的RSD 分别为1.04%,1.79%。
2.4.4 稳定性试验 取批号为1808008 的板蓝根药材,按“2.3”项下方法制备供试品溶液,室温放置,于0、8、12、16、20、24 h,按“2.1”项下条件进样测定,在254 nm 下(R,S)-告依春、胞苷、尿苷、鸟苷、腺苷的RSD 分别为0.85%、1.88%、1.36%、0.87%、6.84%;在230 nm 下,(R,S)-告依春、直铁线莲宁B 的RSD 分别为0.5%、1.72%。腺苷的峰面积在不同时间段波动较大,说明板蓝根供试品溶液中(R,S)-告依春、直铁线莲宁B、胞苷、尿苷、鸟苷在室温放置24 h 内稳定性良好,但是腺苷不稳定。
2.4.5 加样回收试验 取已测定的样品(批号1808008)9 份,精密称定,分别精密加入相当于供试品中待测成分含量的50%、100%、150%的混合对照品溶液,按照“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,计算得到(R,S)-告依春、直铁线莲宁B、胞苷、尿苷和鸟苷的平均加样回收率分别为 98.25%、99.57%、100.53%、102.29%、102.59%、99.30%,RSD 分别为 2.25%、2.45%、3.35%、1.62%、2.96%、2.79%。结果见2。
2.5 相对校正因子(fk/m)的建立
精密吸取混合对照品溶液5、10、15、20、30 μL,按“2.1”项下色谱条件测定,每个浓度分别进样3 次,取平均值,记录各对照品的色谱峰面积,根据fk/m计算公式[2-3]。计算待评价成分直铁线莲宁B、胞苷、尿苷、鸟苷、腺苷的相对校正因子(表2)。
fk/m=fk/fm=(Wk×Am)/(Wm×Ak)
Wk为(R,S)-告依春内标物的含量,Ak为(R,S)-告依春内标物的峰面积,Wm为被测指标组分m的含量,Am为被测成分m的峰面积
2.6 fk/m 的耐用性评价
2.6.1 不同色谱柱对fk/m的影响 取“2.2”项下的混合对照品溶液,分别精密吸取10 μL,采用Agilent C18色谱柱,分别在Agilent 1260、Agilent 1100、Waters2695-2996 高效液相色谱仪上进样检测,求算以(R,S)-告依春作为参照成分时,5 种成分的fk/m,结果说明fk/m在使用不同仪器时的耐用性良好,结果见表3。
考察了Agilent ZORBAX C18(250 mm×4.6 mm,5 μm)、Waters Xbridge C18(250 mm×4.6 mm,5 μm)、Phenomenex Kinetex C18(250 mm×4.6 mm,5 μm)共3 种色谱柱对各成分fk/m的影响。使用以上色谱柱各成分均能达到较好的分离效果,结果胞苷、尿苷、鸟苷、腺苷、直铁线莲宁 B 的 RSD 依次为 2.69%、3.41%、3.15%、3.09%、2.60%。表明色谱柱的更换对各成分fk/m无显著影响(表3)。

表2 5 种成分的fk/mTable 2 Relative correction factors (fk/m) of five components

表3 不同色谱柱对fk/m 的影响Table 3 fk/m of different columns
2.6.2 不同流动相体积流量对fk/m的影响 考察了不同体积流量(1.0、1.1、1.2 mL/min)对各成分fk/m的影响。结果表明(表4),各成分的RSD 依次为1.30%、0.33%、0.79%、1.00%、2.16%。表明体积流量的波动对各成分fk/m无明显影响。
2.6.3 不同仪器对fk/m的影响 考察了不同仪器(安捷伦1260、戴安U-3000、沃特世2695)对各成分fk/m的影响,结果(表5)各成分的RSD%依次为2.91%、3.11%、3.32%、4.16%、3.09%。表明仪器的更换对各成分fk/m无显著影响。
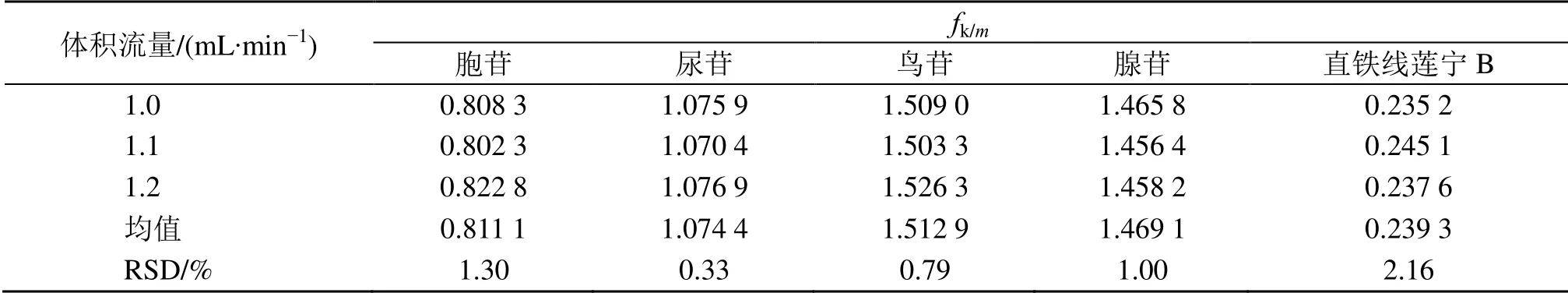
表4 不同体积流量对fk/m 的影响Table 4 fk/m factor of different flow rates
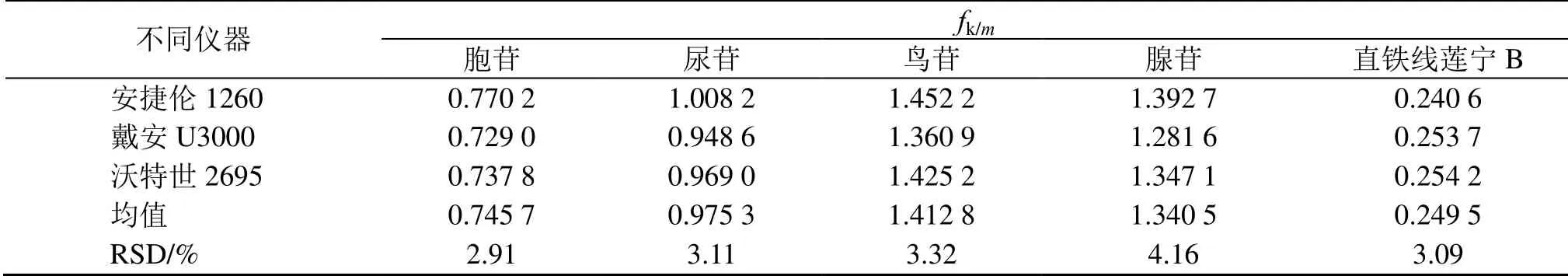
表5 不同仪器对fk/m 的影响Table 5 fk/m of different instruments
2.7 色谱峰定位参数考察
为了在仅采用(R,S)-告依春为对照品时,能够确认直铁线莲宁B、胞苷、尿苷、鸟苷、腺苷色谱峰的位置,从而通过获得的相对校正因子同时计算另外5 种成分的含量,达到一测多评的目的,考察了采用不同仪器、不同色谱柱和不同实验人员时直铁线莲宁B、胞苷、尿苷、鸟苷、腺苷和 (R,S)-告依春色谱峰之间的保留时间差和相对保留时间2 个参数。考察结果发现,另外5 种成分和参照物 (R,S)-告依春之间的保留时间差波动较大,而相对保留时间波动较小,RSD 均小于5%(表6、7)。因此,可利用相对保留时间进行定位。
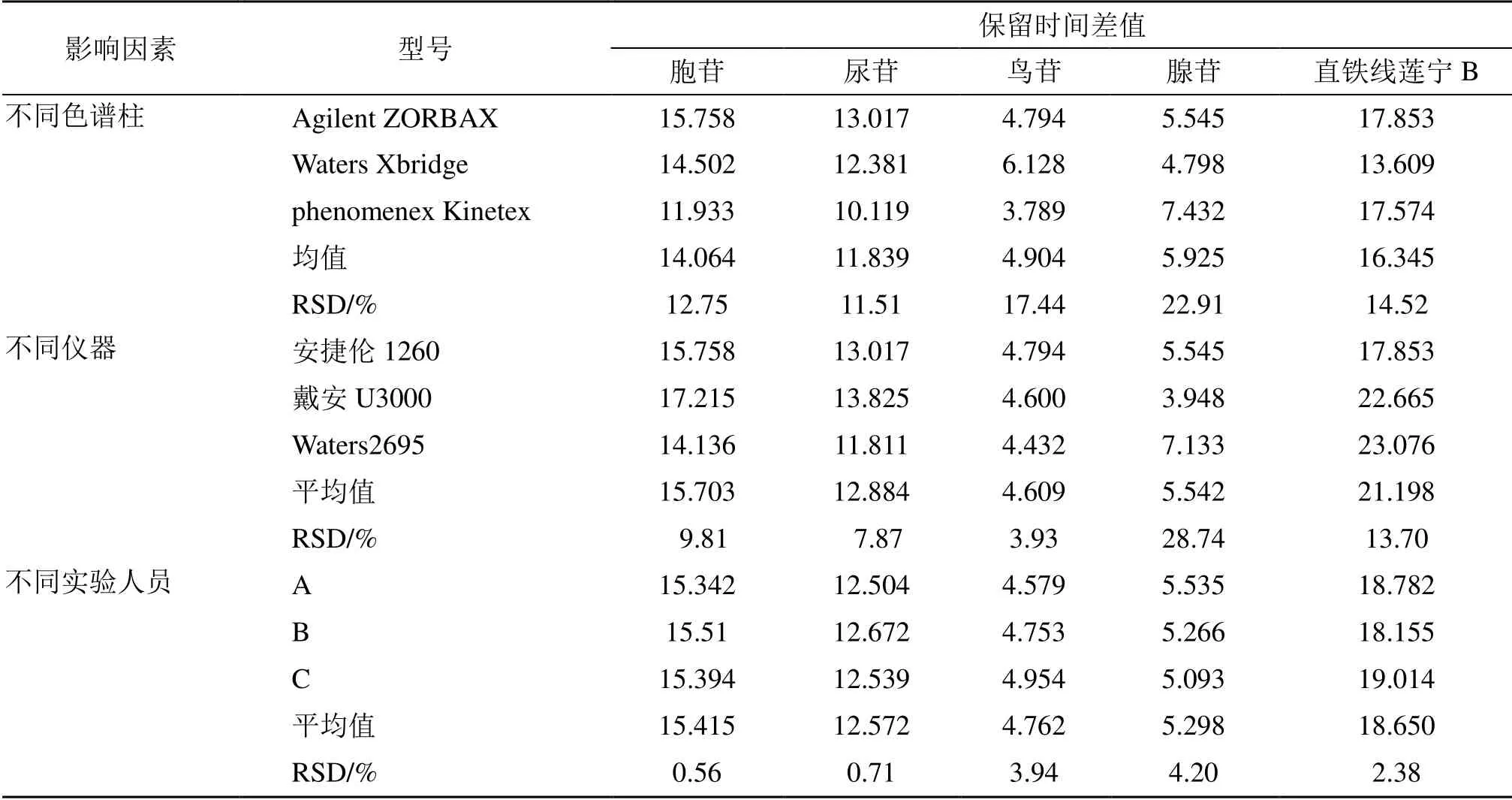
表6 不同因素对保留时间差值的影响Table 6 Influence of different factors on retention time difference

表7 不同因素对相对保留时间的影响Table 7 Influence of different factors on relative retention time
2.8 QAMS 法与外标法结果比较研究
采用了HPLC法,以(R,S)-告依春作为“一测多评”的参照成分,测定其在板蓝根中的含量,并通过测得的直铁线莲宁B、胞苷、尿苷、鸟苷和腺苷的fk/m,分别计算出这5 种成分的含量。同时,使用外标法测定了板蓝根中(R,S)-告依春、直铁线莲宁B、胞苷、尿苷、鸟苷和腺苷的含量,将外标法测定含量与QAMS 法计算的含量采用相对偏差法进行比较,从而验证QAMS 法用于测定板蓝根中的多种类成分测定的准确性(表8)。

表8 QAMS 法与外标法测定26 批药材中6 种成分的比较Table 8 Comparison of determination of six components in 26 batches of medicinal materials by QAMS and ESM
3 讨论
3.1 测定波长的选择
本研究测定的化学成分种类较多,包括核苷类、生物碱类和木脂素类,共6 种化合物。采用DAD 全波长扫描对照品溶液,分别对(R,S)-告依春、直铁线莲宁B、胞苷、尿苷、鸟苷、腺苷进行紫外波长扫描。结果显示,(R,S)-告依春和胞苷、尿苷、鸟苷、腺苷在254 nm 处同时有较大吸收,(R,S)-告依春和直铁线莲宁B 在230 nm 处同时有较大的吸收,且干扰少,峰形良好,基线平稳,因此检测波长最终设定为254 nm 和230 nm。
3.2 内标物和质量控制指标的选择
现有QAMS 法测定(R,S)-告依春和核苷类成分的研究[1],但是该方法选择腺苷作为内标物,测定了(R,S)-告依春、鸟苷、尿苷、胞苷的含量。本研究发现腺苷并不稳定,不适合作为内标物和质量控制指标成分;而其他核苷类成分和(R,S)-告依春较稳定,板蓝根中另一关键抗病毒性成分直铁线莲宁B 亦有良好的稳定性,均可作为质量控制指标成分;且(R,S)-告依春与其他5 种成分都可实现同波长下的较大吸收。因此,本研究选择(R,S)-告依春为内标物,结果显示各成分的相对校正因子稳定,重现性良好。
3.3 QAMS 法用于板蓝根质量控制的合理性
本研究的相对标准偏差表明,外标法和QAMS 法计算的含量相似性极高,表明2 种含量测定方法计算得到的含量值之间无显著性差异。此外,在不同高效液相色谱仪、不同色谱柱等条件下均有良好的重复性。板蓝根中化学成分众多,以外标法测定各成分含量需要对照品的数量多,部分对照品价格昂贵且难以获取,采用QAMS 法测定各成分含量能极大的减少对照品使用数量,节约成本,增加检测便利性。因此,QAMS 法用于板蓝根质量控制具有极高的实用性、便利性和科学性。
利益冲突所有作者均声明不存在利益冲突
