流式液相蛋白定量技术测定生物医用材料产品体液免疫评价中免疫球蛋白含量
2021-02-03侯丽王国伟孙晓霞高冉冉
侯丽,王国伟,孙晓霞,高冉冉
山东省医疗器械产品质量检验中心; 国家药品监督管理局生物材料器械安全性评价重点实验室;国家药品监督管理局药品包装材料质量控制重点实验室;山东省医疗器械生物学评价重点实验室,济南市,250101
0 引言
免疫原即医疗器械中所含有的,可以刺激机体发生免疫应答的异源性物质。对于医疗器械而言,聚合材料、陶瓷制品及金属材料可能具有的溶出物、磨损或可降解部分能够与宿主蛋白结合。生物源性的材料,如胶原、天然乳胶蛋白、白蛋白和动物组织等都可以刺激机体发生免疫应答[1]。目前,评价医疗器械免疫毒性主要依据GB/T 16886.20—2015[2],该标准为医疗器械免疫毒理学试验提供了指南。目前,鉴于生物科学新方法新技术的研究更加深入,评价医疗器械免疫学毒理学试验方法也不断涌现。
流式液相多重蛋白定量技术(CBA)是基于荧光微球技术与“双抗体夹心”液相检测技术的结合,特异性捕获样品中或标准品中的目的蛋白,捕获微球、目的蛋白与加入的检测抗体形成双抗体夹心的“三明治”结构复合物,利用流式细胞仪对该复合物的荧光强度进行检测,从而实现多种可溶性蛋白同时定量检测。
本研究为充分评价CBA技术,以临床常见的动物源医疗器械作为研究对象,对生物医用材料产品体液免疫评价中的免疫球蛋白进行检测,为深入研究CBA技术在医疗器械免疫毒理学提供了研究数据。
1 材料
1.1 试剂
磷酸盐缓冲液(PBS)、牛血清白蛋白(BSA)、完全弗氏佐剂(CFA)、LENGENDplexTMMulti-Analyte Flow Assay Kit(Cat No.740493)。
1.2 器具和仪器设备
流式细胞仪、生物安全柜、离心机、电动涡旋仪、摇床等。
1.3 试验动物
Balb/C小鼠,6~8周龄,共50只,雌雄各半。购自北京维通利华实验动物技术有限公司。
2 试验方法
2.1 实验组
将受试样品(牛源异种脱细胞真皮基质)植入小鼠,设高、中、低剂量组,植入剂量分别为3.28、1.64、0.82 cm2产品/只小鼠。
2.2 植入方式
戊巴比妥钠(55 mg/kg)腹腔麻醉小鼠,在其背部脊柱两侧剃毛,面积约2 cm×2 cm,碘伏消毒,用眼科剪剪约5 mm直径切口,用眼科镊在皮肤切口部位制备皮下囊,将被测样品植入囊内并缝合。植入周期为28 d。
2.3 对照组
阴性对照组:除不用受试样品进行处理以外,与实验组的实验动物进行相同的操作和处理方式。
阳性对照组:采用牛血清白蛋白(bovine serum albumin,BSA)作为阳性对照。免疫前,取3 mg BSA和9 mL PBS(pH=7.4)制成混合溶液。充分混匀后,取3 mL混合溶液与3 mL弗氏完全佐剂等体积混合。取0.12 mL混悬液注射到小鼠皮下,从试验第一天开始,每周免疫一次,免疫3次,于免疫后第2周对阳性对照动物进行评价。
2.4 血清制备
试验第1天时,将试验样品植入BALB/C小鼠背部皮下(记为植入第1天),在植入第29天时采取小鼠摘眼球取血法,收集外周血至1.5 mLEP管中,4 ℃静置30 min后,2 000 g离心20 min,收集上层血清。
2.5 试剂及准备
试验前将所需beads超声1 min,涡旋30 s。将20×Wash Buffer静置恢复室温后,混匀使其中盐分充分溶解。用去离子水将其配制成1×Wash Buffer。用250 μL Assay Buffer溶解Standard Cocktail,充分混匀后静置10 min,然后转入EP管中,标记为C7。取7个EP管,分别加入75 μL Assay Buffer,4倍倍比稀释。从C7中取25 μL进行梯度稀释,直到稀释到C1为止,C0为Assay Buffer(0 pg/mL)。取血清血浆样本,试验前需要用Assay Buffer进行稀释,稀释50 000倍。
2.6 试验过程
所有样品孔/标准孔中加25μL Assay Buffer,取25 μL稀释好的标准品/样品分别加入对应的孔中;试验前涡旋beads 1 min,涡旋后每孔加入25 μL beads。避光,室温300 r/min震荡孵育2 h;孵育结束后,300 g离心5 min,弃上清;每孔加入200 μL Wash Buffer保持1 min,离心弃上清;每孔加入25 μL的检测抗体,避光,室温300 r/min震荡孵育1 h;孵育结束后,直接向每孔中加入25 μL的SA-PE,避光,室温300 r/min震荡孵育30 min;每孔中加入150 μL 1×Wash Buffer,重悬beads准备上机检测。在流式细胞仪上开启流式细胞仪分析软件获取数据。将获取的数据在LEGENDplexTM软件上进行分析,根据已知浓度的标准品的平均荧光强度(MIF)制作标准曲线,依据样本的平均荧光强度(MIF)计算出样本的可溶性蛋白浓度。
2.7 统计学分析
所有实验结果都以平均值±标准差的形式展示,采用Student's t(等方差,单尾) 进行统计学分析,P<0.05 时认为两组之间具有显著性差异。
3 实验结果
3.1 绘制标准曲线
以标准品浓度做为横坐标,平均荧光强度(MFI)为纵坐标,通过五参数拟合模型绘制出标准曲线。曲线R2值均大于0.99(如图1~6所示)。
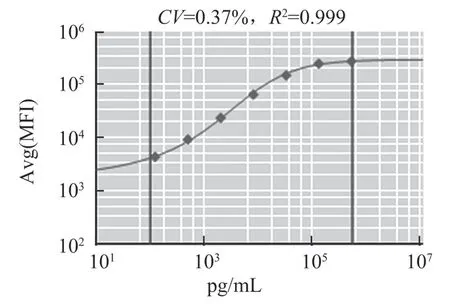
图1 IgG1标准品绘制标准曲线Fig.1 The standard curve of IgG1
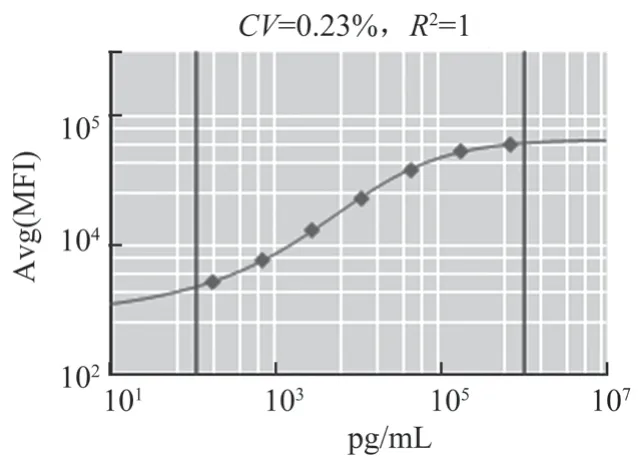
图2 IgG2a标准品绘制标准曲线Fig.2 The standard curve of IgG2a
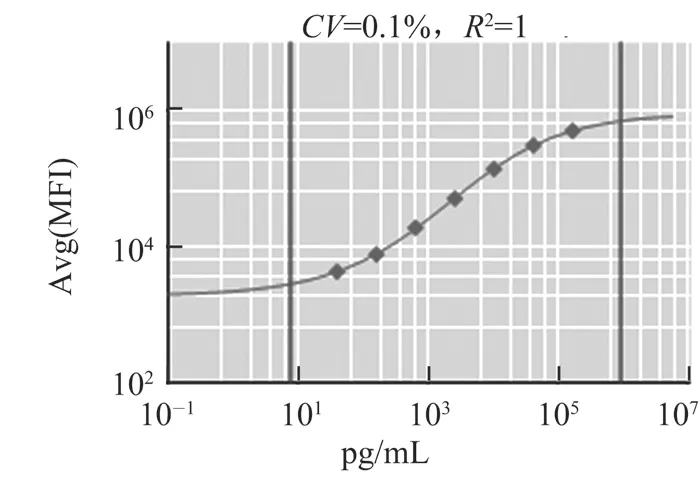
图3 IgG2b标准品绘制标准曲线Fig.3 The standard curve of IgG2b
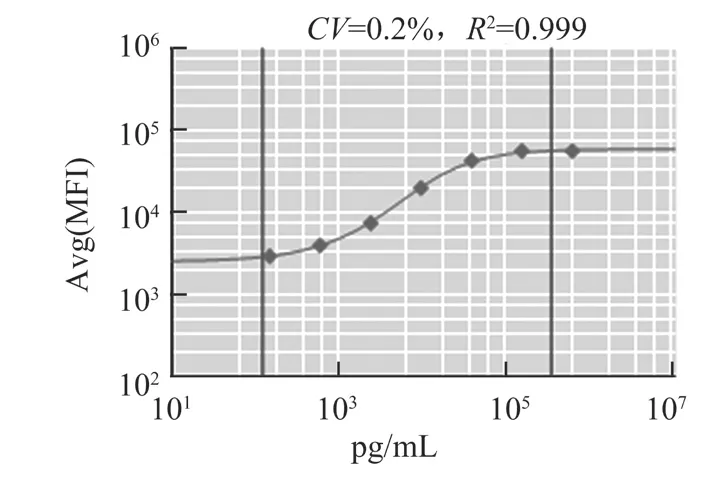
图4 IgG3标准品绘制标准曲线Fig.4 The standard curve of IgG3
图5 IgA标准品绘制标准曲线Fig.5 The standard curve of IgA

图6 IgM标准品绘制标准曲线Fig.6 The standard curve of IgM
3.2 各实验组免疫球蛋白含量
应用流式液相多重蛋白定量技术对实验各剂量组以及对照组小鼠血清中IgG1、IgG2a、IgG2b、IgG3、IgA、IgM的含量进行同时测定。与阴性对照组相比,阳性对照组中IgG3、IgA含量未见明显差异,而IgG1、IgM、IgG2b含量显著性高于阴性对照组(P<0.01),表明本试验系统运行正常。被测样品植入低、中、高剂量组IgG1、IgG2a、IgG2b、IgG3、IgA、IgM含量没有明显变化(P>0.05)。各实验组中血清免疫球蛋白浓度数据见表1。
4 讨论
随着生物医用材料的不断发展与应用,人们对医疗器械的安全性和有效性提出了更高的要求。其中,医疗器械或生物材料与机体免疫系统的相互作用也日益受到关注。若医疗器械所含材料的化学特性提示有免疫毒性的数据或任何化学物具有不可知的潜在免疫毒性时,都应考虑进行免疫毒性试验[2]。特别对动物源性医疗器械评价时,需进行免疫原性方面的安全风险分析。目前,虽然GB/T 16886.20给出了进行医疗器械免疫毒性试验的指导,但并未给出具体的试验方法。YY/T 1465.7系列标准已给出了医疗器械免疫原性评价系列方法供使用方选择。其中ELISA法测定血清免疫球蛋白和补体成分以及用流式细胞仪测定动物脾脏淋巴细胞亚群等方法已作为标准化方法得到日益广泛应用[3-4]。但由于通常采用小鼠作为实验动物模型,获取的样本量过少导致不能满足多个指标的同时观察,从而进一步造成实验动物资源浪费。
表1 植入28天后小鼠血清中免疫球蛋白浓度 (±S,μg/mL,n=10)Tab.1 Immunoglobulin concentrations in serum of mice 28 days after implantation
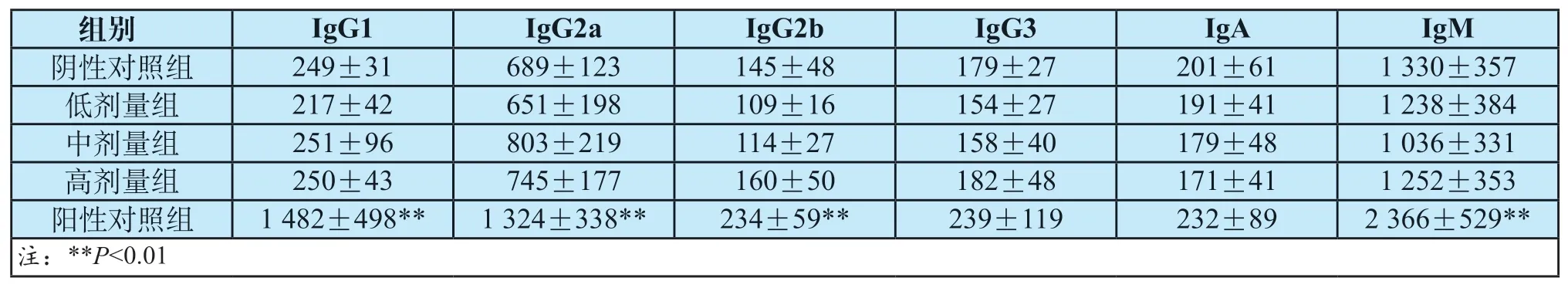
表1 植入28天后小鼠血清中免疫球蛋白浓度 (±S,μg/mL,n=10)Tab.1 Immunoglobulin concentrations in serum of mice 28 days after implantation
CBA技术是基于流式细胞检测系统,集ELISA和细胞流式技术优点为一身的液相蛋白检测技术可通过对应的微球分别标记有不同强度的荧光,每一种微球分别耦联对应目标抗原的捕获抗体,同时,通过标准品绘制标准曲线,可实现对待测样本中多种可溶性蛋白的定量检测,目前在药物毒理研究的应用已日益广泛[5]。
与传统的ELISA检测相比,流式液相多重蛋白定量技术对样本量需求小,特别是珍贵样本获取困难,利用该技术可大大缓解样本量的难题;可同时对样本中多个目标蛋白进行检测,具有一定的经济性并且大大减少时间与人力的消耗;检测灵敏度高检测范围更宽。同时,该技术操作步骤简化,检测结果的重复性好,并易于标准化。IgM、IgA是评价体液免疫功能的重要指标,IgG是血清中含量最高的免疫球蛋白,其作用大多通过IgG亚型来完成,不同亚型功能不同,由于一种IgG亚型水平的降低可以伴有一种或几种其他亚型水平的提高,从而使IgG总量水平保持正常,故有必要测定IgG亚型的水平[6]。本研究中,取少量血样即可应用流式液相蛋白定量技术同时测定小鼠血清中不同类型免疫球蛋白含量,为今后在同组动物中测量不同时期血液指标变化趋势提供基础。牛血清白蛋白(BSA)是对生物医用材料产品体液免疫评价时一种常用的阳性对照物[7],本实验中阳性对照组IgG1、IgG2a、IgG2b、IgM含量显著高于阴性对照组,说明通过CBA技术可以检测出在适宜的免疫刺激下的免疫球蛋白指标的变化。综上所述,本方法可以替代ELISA法测定生物医用材料产品体液免疫评价中免疫球蛋白含量。
