藏族大肠息肉患者肠道菌群结构特征研究
2021-02-03涂庆丽陈小红胡丽霞
宦 徽,涂庆丽,蒲 雪,许 立,潘 雯,陈小红,胡丽霞,刘 超
西藏自治区人民政府驻成都办事处医院(四川大学华西医院西藏成办分院)消化内科,四川 成都 610041
各种肠道细菌、真菌等微生物与人共生形成复杂的生物系统,即肠道微生态系统。其中细菌占肠道微生态系统的比例最高,因此成为近年来的研究热点。肠道中的细菌主要分为有益菌和与宿主共栖的条件致病菌,前者是肠道中的有益菌,可分为专性或兼性厌氧菌群;后者是肠道非优势菌群,以兼性需氧菌为主;此外,肠道中还可能存在一些病原菌,大多为过路菌,一般较少在肠道中长期定植[1-2]。当肠道微生态的平衡打破后,则会在一定程度上影响机体的正常功能,与多种疾病的发生和发展相关,影响着机体的健康[3]。
大肠息肉(colorectal adenoma polyps,CAP),又名结直肠腺瘤息肉,是一种消化道常见疾病,其形成主要与大肠上皮细胞的异常增生相关,而大肠上皮细胞的异常增生又受到慢性炎症的刺激[4]。研究表明,肠道菌群紊乱会引起免疫应答功能的失调,导致机体的免疫力下降和慢性炎症反应发生[5],进而在结直肠癌的发生发展中产生实质性的影响[6]。CAP与大肠癌之间有着密切的相关性[4],而肠道菌群组成的改变是诱导CAP发病的因素,还是CAP继发引起肠道菌群组成的改变,目前还尚不清楚。藏族人群长期居住在青藏高原上,其独特的生存环境养成了其特有的饮食习惯,也将造成其肠道菌群结构特征的差异[7]。因此,本研究将着重于藏族CAP患者肠道菌群的变化,基于16S rDNA高通量测序探讨肠道菌群与CAP的相关性,找到其相关规律。
1 资料与方法
1.1 样本来源以肠镜检查是否发现CAP为标准,收集2018年4月至2019年1月在我院门诊就诊的藏族CAP患者30例(CAP组),以及20名藏族健康体检者(Control组)。CAP组男16例,女14例,年龄27~72岁。Control组男12名,女8名,年龄26~63岁。排除标准:(1)合并肠道感染及炎性疾病,或未控制的感染或败血症;(2)色素沉着息肉综合征、家族性肠息肉病等肠息肉病患者;(3)合并恶性肿瘤、恶病质患者,或有放、化疗史者;(4)近2周内使用抗生素、类固醇等激素和益生菌制剂。所有研究对象均自愿加入研究,签署《知情同意书》。本研究由医院伦理会批准[编号:(2018)科研第24号]。
1.2 粪便样本采集、DNA提取、16S rDNA高通量测序采集研究对象的粪便标本,每份不少于6 g,采集到的粪便标本立即存入-80 ℃冰箱中。随后,根据DNA提取试剂盒的操作说明提取粪便标本中的总DNA(DNeasy PowerSoil Kit,天根生化科技有限公司,中国北京)。利用分光光度计对提取得到的总DNA进行质检,通过质检的DNA存放于-20 ℃冰箱中。基于16S rDNA序列片段V3区进行高通量测序,扩增引物为338F_806R,测序平台为Illumina Miseq,测序工作由上海美吉生物医药科技有限公司完成(中国上海)。
1.3 生物信息学分析
1.3.1 测序序列的拼接与质控:测序得到的原始序列使用Qiime 1.9.1(http://qiime.org/install/index.html)进行序列去重过滤,然后使用Flash 1.2.11(https://ccb.jhu.edu/software/FLASH/index.shtml)pair-end双端序列拼接,得到cleantags,最后使用Fastp 0.19.6(https://github.com/OpenGene/fastp)进行质控分析。
1.3.2 OTU聚类与统计:OTU聚类和统计分别使用Uparse 7.0.1090(http://www.drive5.com/uparse/)和Usearch 7.0(http://www.drive5.com/usearch/)进行。
1.3.3 α多样性分析:α多样性是反映物种多样性、丰富度、均匀度的综合指标,采用Mothur 1.30.2(https://www.mothur.org/wiki/Download_mothur)进行α多样性分析,包括Ace指数、Chao指数、Shannon指数、Simpson指数、Coverage指数、Sobs指数。
1.3.4 物种组成分析:通过与Silva(Release132 https://www.arb-silva.de/)数据库进行比对,对OTU在门(Phylum)、纲(Class)、目(Order)、科(Family)、属(Genus)、种(Species)几个分类上进行物种分类,统计样本中各微生物的序列数,即各微生物的相对丰度。
1.3.5 功能预测分析:16S序列的KEGG、COG功能预测则采用PICRUSt 1.1.0(http://picrust.github.io/picrust/)。
2 结果
2.1 研究对象的人口学特征如表1所示,藏族CAP组和Control组在性别、年龄上差异有统计学意义(P<0.05),但两组的BMI指数差异无统计学意义(P>0.05)。

表1 研究对象的人口学特征Tab 1 Demographic characteristics of the study object
2.2 测序质量分析对测序得到的原始序列进行去重过滤和拼接,CAP组和Control组分别得到1 744 385条和1 179 312条序列,平均序列长度分别为415 bp和416 bp。以97%相似度对所有样品的cleantag进行OTU聚类,总共获得1 401个OTU,Taxon个数统计分别为1个界(Kingdom)、14个门、21个纲、47个目、93个科、301个属、645个种。Sobs指数和Shannon指数稀释曲线显示,随着测序深度的增大曲线趋于平坦,表明继续取样已不能产生更多的OTU,测序深度合理(见图1)。
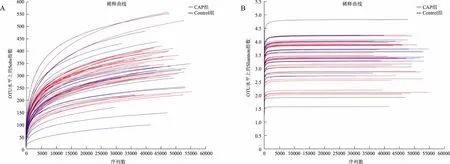
图1 Sobs指数(A)和Shannon指数(B)稀释曲线Fig 1 Rarefaction curves of Sobs index (A) and Shannon index (B)
2.3 α多样性分析分别通过Chao、Simpson、Shannon、Ace、Sobs、Coverage指数水平比较CAP组与Control组的α多样性差异,结果显示,这6种指数在两组间的差异均无统计学意义(P>0.05),说明CAP组与Control组的物种多样性、丰富度、均匀度差异均无统计学意义(见图2)。

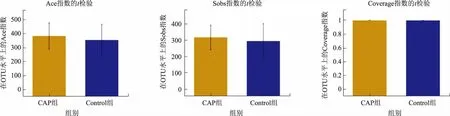
图2 CAP组和Control组的α多样性指数差异分析Fig 2 The difference analysis of α diversity indexes between CAP group and Control group
2.4 CAP组和Control组物种差异分析根据OUT的注释与丰度,在门、科、属3个水平上分析CAP组与Control组各物种的比例,并比较两组间的差异物种。
在门水平上,CAP组与Control组的细菌组成比例主要是厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobateria)、疣微菌门(Verrucomicrobia)、软壁菌门(Tenericutes)、梭杆菌门(Fusobateria)、蓝细菌门(Cyanobateria)、Patescibateria、互养菌门(Synergistetes)、Lnetisphaserae、Epsilonbacteria、绿弯菌门(Chloroflexi)。其中,CAP组中变形菌门(Proteobacteria)的相对丰度显著低于Control组(P=0.02865)(见图3)。
在科水平上,CAP组与Control组的细菌组成比例主要是毛螺菌科(Lachnospiraceae)、疣微菌科(Ruminococcaceae)、普雷沃氏菌科(Prevotellaceae)、Bacteroidaceae、肠杆菌科(Enterobacteriaceae)、韦荣氏菌科(Veillonellaceae)、链球菌科(Streptococcaceae)、韦荣球菌科(Erysipelotrichaceae)、氨基酸球菌科(Acidaminococcaceae)、乳杆菌科(Lactobacteriaceae)、红蝽杆菌科(Coriobacteriaceae)、双歧杆菌科(Bifidobacteriaceae)、理研菌科(Rikenellaceae)、克里斯滕森菌科(Christensenellaceae)、Muribaculaceae。其中,CAP组中普雷沃氏菌科(Prevotellaceae)的相对丰度显著高于Control组(P=0.04538),而肠杆菌科(Enterobacteriaceae)的相对丰度显著低于Control组(P=0.02863)(见图4)。

注:*P<0.05。
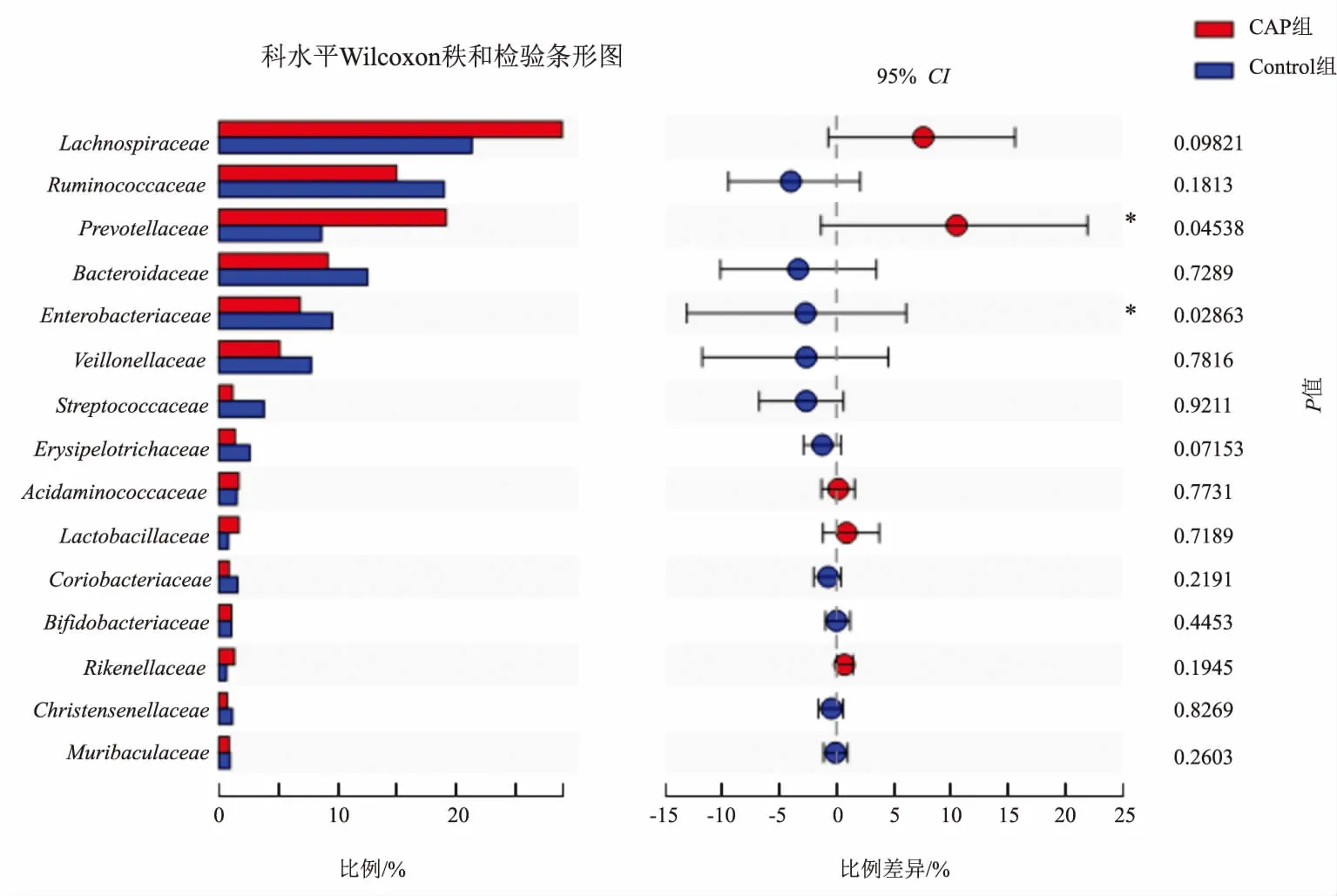
注:*P<0.05。
在属水平上,CAP组和Control组的细菌组成比例主要是普氏菌_9属(Prevotella_9)、拟杆菌属(Bacteroides)、直肠真杆菌属(Agathobacter)、普拉梭菌属(Faecalibacterium)、大肠杆菌志贺氏菌属(Escherichia-Shigella)、巨单胞菌属(Megamonas)、布劳特氏菌(Blautia)、罗斯氏菌(Roseburia)、链球菌(Streptococcus)、Subdoligranulum、瘤胃菌属_UCG-002(Ruminococcaceae_UCG-002)、胃瘤球菌属(Ruminococcusl_torques_group)、考拉杆菌属(Phascolarctobacterium)、克雷伯氏菌属(Klebsiella)、Dorea。其中,CAP组中直肠真杆菌属(Agathobacter)和罗斯氏菌(Roseburia)的相对丰度显著高于Control组(P=0.005233、0.002142),而CAP组中克雷伯氏菌属(Klebsiella)的相对丰度显著低于Control组(P=0.008115)(见图5)。
2.5 功能预测分析随后我们针对细菌16S扩增子测序数据进行功能预测,首先去除16S标记基因(marker gene)在物种基因组中的拷贝子(copy)数目的影响;然后通过每个OTU对应的基因号(greengene id),获得OTU对应的COG家族信息和KEGG Orthology(KO)信息,并计算各COG的丰度和KO丰度。
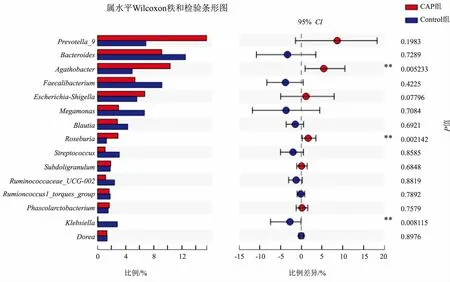
注:**P<0.01。
如图6所示,COG功能主要集中在碳水化合物转运与代谢(carbohydrate transport and metabolism),一般功能预测(general function prediction only),转录(transcription),氨基酸转运与代谢(amino acid transport and metabolism),复制、重组、修复(replication,recombination and repair),细胞壁/细胞膜的生成(cell wall/membrane/envelope biogenesis),翻译、核糖体结构、生物合成(translation,ribosomal structure and biogenesis),信号传导机制(signal transduction mechanisms),无机离子转运与代谢(inorganic ion transport and metabolism),能量产生与转化(energy production and conversion)。其中,细胞骨架(cytoskeleton)功能在两组间差异有显著统计学意义,CAP组富集丰度显著低于Control组(P=0.04790)。
注:A:RNA加工与修饰;B:染色质结构与动力学;C:能量产生与转化;D:细胞周期调控,细胞分裂,染色体分隔;E:氨基酸转运与代谢;F:核苷酸转运与代谢;G:碳水化合物转运与代谢;H:辅酶转运与代谢;I:脂质转运与代谢;J:翻译,核糖体结构和生物合成;K:转录;L:复制、重组、修复;M:细胞壁/细胞膜的生成;N:细胞运动;O:翻译后修饰,蛋白质转换,伴侣;P:无机离子转运与代谢;Q:次级代谢产物的合成、转运、代谢;R:一般功能预测;S:未知功能;T:信号传导机制;U:细胞内的转运、分泌和囊泡运输;V:防御机制;
此外,通过比对,通过KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库发现CAP组和Control组的大部分基因富集在转运蛋白(transporters),一般功能预测(general function prediction only),ABC转运体(ABC transporters),DNA修复和重组蛋白(DNA repair and recombination proteins)、核糖体(ribosome)、嘌呤代谢(purine metabolism)、肽酶(peptidases)、嘧啶代谢(pyrimidine metabolism)、转录因子(transcription factors)、染色体(chromosome)。
3 讨论
CAP是消化道常见的一种疾病,是任何突出于肠腔内的隆起的总称,有着明显的癌变倾向[8-9],由此可见,了解CAP的发生发展规律可以更好地控制大肠癌的发生。肠道菌群是人体的“第二基因组”,越来越多的研究表明,肠道菌群可参与人体正常的生理功能与新陈代谢,与机体相互作用影响着机体的疾病和健康状态[10-12]。然而,遗传因素、生存环境、饮食习惯不可避免地影响肠道菌群的构成。藏族人群主要生活在海拔3 000 m以上的青藏高原,为适应低氧、低气压为特征的特殊高原环境,当地的藏族人群形成了独特的遗传倾向、生活方式、饮食习惯,在大多数的高海拔地区,肉类(牛羊肉)、牦牛油、牛奶等乳制品是饮食的主要组成,此外,藏族食源性钠的摄入量较高,蔬菜和水果的消费量明显低于低海拔人口。这一独特的生存环境与饮食习惯使得其肠道微生物的构成区别于汉族人群[13],因此,着重于藏族CAP患者的肠道菌群结构可以更好地揭示藏族人群肠道微生物与CAP的相关性,指导藏族CAP患者的个性化治疗。
本研究采用16S rDNA高通量测序技术,对30例藏族CAP患者和20名藏族健康体检者肠道菌群的菌落组成和丰度进行了分析。研究结果显示,Sobs指数和Shannon指数稀释曲线均随着测序深度的增加趋于平坦,说明物种丰度已趋于饱和,测序深度合理,测序结果可靠。α多样性分析显示,CAP组肠道菌群的丰度和多样性与Control组之间差异无统计学意义,这与之前的研究结果一致[14]。在门水平上,CAP组和Control组主要由厚壁菌门、拟杆菌菌门、变形菌门构成,与以往研究一致[15];此外,物种差异分析显示,CAP组中相对丰度显著降低的有变形菌门(Proteobacteria);在科水平上,CAP组中相对丰度显著降低的有肠杆菌科(Enterobacteriaceae),相对丰度显著升高的有普雷沃氏菌科(Prevotellaceae);在属水平上,CAP组中相对丰度显著降低的有克雷伯氏菌属(Klebsiella),相对丰度显著升高的有直肠真杆菌属(Agathobacter)和罗斯氏菌(Roseburia)。
变形菌门包含沙门氏菌、大肠杆菌、幽门螺杆菌等,这些细菌与胃肠道疾病密切相关[16],然而,有研究发现,CAP组的幽门螺杆菌感染率显著高于健康对照组[17],因此需进一步的研究来比较变形菌门中幽门螺杆菌以及其他病原菌在两组间的差异。在之前的研究中显示,在结直肠癌患者中普雷沃氏菌属(Prevotella)显著增加[18],表明在CAP组中增加的普雷沃氏菌科(Prevotellaceae)肠道菌群可能与CAP发展为大肠癌有关。克雷伯氏菌属(Klebsiella)为条件致病菌,隶属变形菌门肠杆菌科(Enterobacteriaceae),可能是造成CAP组中变形菌门相对丰度降低的主要物种。此外,直肠真杆菌属(Agathobacter)和罗斯氏菌(Roseburia)可分别产丁酸盐和丁酸[19-20],丁酸是肠上皮细胞的主要能量来源之一,对肠上皮细胞的增殖、分化和凋亡均可产生影响[21],CAP组中直肠真杆菌属(Agathobacter)和罗斯氏菌属(Roseburia)的丰度增加可能是为CAP中增生的肠上皮细胞提供能量。PICRUSt功能预测分析显示,CAP组的COG功能分类和KEGG功能预测与Control组之间差异无统计学意义。
近年来,肠道菌群成为疾病防控的新方向,也有研究称,可将肠道微生物作为新型的疾病生物标志物[22-23]。藏族CAP患者中相对丰度增加的直肠真杆菌属(Agathobacter)和罗斯氏菌属(Roseburia)可能与CAP的形成相关,此外,相对丰度增加的普雷沃氏菌科(Prevotellaceae)也可能是CAP发展为大肠癌的信号,然而,这些相关性需要进一步的研究加以证实。
