鸡卵白蛋白-桑葚酒渣花色苷纳米颗粒特性
2021-02-03张丽霞刘书晶张晨颜虞力范龚健
张丽霞,刘书晶,张晨颜,虞力,范龚健
(1. 江苏省农业科学院农产品加工所,南京 210014;2. 江苏大学食品与生物工程学院,江苏 镇江 212013;3. 南京林业大学轻工与食品学院,南京 210037)
桑葚系桑科桑属植物桑(MorusalbaL.)的成熟果实,又称桑果、桑枣,呈椭圆形黑色或者深紫色,自古享有“民间圣果”“中华果王”之美称。研究表明,桑葚花色苷具有防止脑神经老化、降血糖、降血脂、抗氧化、抗癌和增强机体免疫力等多种生物活性功能。桑葚酒是桑葚加工中常见的产品,具有营养丰富、酒体醇厚和香气宜人等特点而备受消费者推崇[1-2]。桑葚酒渣中含有丰富的花色苷[3],为桑葚果酒酿造中重要副产物,具有抗氧化、抗肿瘤和保护心血管系统等生物学作用。然而,在桑葚酒酿造过程中产生的大量酒渣却并未得到充分利用。
花色苷极易受到pH、温度、氧、光照和金属离子等因素的影响,其活泼的酚羟基容易被氧化成醌类物质,限制了花色苷的使用[4-5]。花色苷与大分子物质如糖类、蛋白质等结合,可以增加花色苷的稳定性[6-7]。研究表明,纳米粒子具有独特的表面效应和量子尺寸效应,通过将功能因子包裹于纳米粒子内部或吸附于纳米粒子表面,能够提高生物活性成分的稳定性,促使其活性的最大发挥[8]。
鸡卵白蛋白(OVA)由386个氨基酸组成,分子量约45 ku[9]。OVA可以通过疏水作用力与花色苷结合,因其具有更好的包埋效果,已被应用于制备与具有生物活性小分子相互作用的模型蛋白[10]。蛋白类大分子可以提高功能活性成分的稳定性[11]。Chen等[12]研究发现,牛血清白蛋白(BSA)与蓝莓花青素结合形成的纳米颗粒,能提高其在模拟肠系统中的稳定性。于情情等[13]发现,牛血清白蛋白提高了紫玉米花色苷和笃斯越桔花色苷的胃肠吸收稳定性。Feng等[14]发现,以卵清蛋白和海藻酸钠构建的纳米颗粒载体,可以提高姜黄素纳米复合物的稳定性、生物可利用度和抗氧化活性。目前,以OVA为壁材包埋桑葚酒渣花色苷制备纳米颗粒、提高其稳定性的研究未见报道。
笔者以桑葚酒渣花色苷为研究对象,考察OVA-桑葚酒渣花色苷纳米颗粒的包埋率、外观形态、粒径和电势分布和抗氧化活性,以及在模拟胃肠道消化液中的稳定性,研究结果为桑葚酒渣花色苷的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
桑葚酒渣花色苷(MWPA),实验室自制,纯度为83.52%,主要含有矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷;鸡卵白蛋白,购自上海麦克林生化科技有限公司,纯度为98.00%。
1.2 OVA-桑葚酒渣花色苷纳米颗粒制备
参考文献[15]方法,用pH 7.4磷酸盐缓冲液配制1.5×10-4mol/L的OVA溶液,在70~90 ℃水浴中加热15 min,冷却至室温后按照桑葚酒渣花色苷与OVA的摩尔比为0∶1,1∶1,2∶1,3∶1,4∶1和 5∶1 的比例加入桑葚酒渣花色苷,充分溶解后,采用1 mol/L的醋酸溶液调节pH至4.2~4.5,室温条件下搅拌2 h,至OVA与桑葚酒渣花色苷结合完全。将溶液转移至超滤离心管中(截留分子量为10 ku),在4 500 r/min下离心15 min,去除未包封的桑葚酒渣花色苷,得到OVA-花色苷纳米颗粒。
1.3 OVA-桑葚酒渣花色苷纳米颗粒稳定性及释放
体外模拟胃肠道消化体系参照美国药典并稍作调整[16]。模拟胃液主要由0.32%(质量分数)胃蛋白酶和0.20%(质量分数)NaCl组成,用盐酸将pH调至1.2;模拟肠液主要由1.00%(质量分数)胰酶和0.68%(质量分数)K2HPO4组成,用NaOH将pH调至7.40。将OVA-花色苷纳米颗粒加入模拟胃液和肠液,在37 ℃温度、100 r/min下孵育,模拟胃液取样时间为0,0.5,1.0,1.5和2.0 h,模拟肠液取样时间为0,1,2,3和4 h,取样后立即于520 nm处测量样品的吸光度。
1.4 测定指标
1.4.1 OVA-桑葚酒渣花色苷纳米颗粒包埋率
按照OVA-花色苷纳米颗粒制备方法,取离心后的溶液1 mL定容至10 mL容量瓶中,采用消光系数法测定溶液中总花色苷浓度。包埋率计算公式如下:
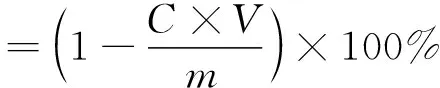
(1)
式中:C为离心液中花色苷浓度,mol/L;V为超滤液总体积,L;m为纳米颗粒制备过程中桑葚酒渣花色苷添加的摩尔质量,mol。
1.4.2 OVA-桑葚酒渣花色苷纳米颗粒的微观结构
分别取桑葚酒渣花色苷与鸡卵白蛋白摩尔比为0∶1和3∶1所制备的纳米颗粒溶液30 μL于玻璃片上自然晾干待用。扫描电子显微镜观察,工作电压为10 kV。
1.4.3 OVA-花色苷纳米颗粒粒径及Zeta电势
取不同比例的OVA-桑葚酒渣花色苷纳米颗粒用Nano-ZS90纳米粒度仪测定粒径和Zeta电势,每个样品重复3次,平衡时间2 min,累计次数100次。
1.4.4 自由基清除率
1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除率的测定采用陈培等[17]的方法,并稍作改进。分别加入15 μL样品溶液、60 μL 0.05 mmol/L Tris-HCl和150 μL 0.15 mmol/L DPPH溶液于96孔板中混合反应,避光放置30 min。用无水乙醇溶液作为颜色空白对照,磷酸盐缓冲溶液为空白对照,在酶标仪上于520 nm波长处检测吸光度大小,每个样品重复3次。
2,2′-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)二铵盐(ABTS)自由基清除率参照刘龙云等[18]的方法并加以改进。将ABTS原液稀释至吸光度为0.900±0.005。96孔板中每孔加入90 μL ABTS稀释液和10 μL的样品,放置4 min后用酶标仪检测样品在630 nm波长处的吸光度。所有操作避光条件下进行,每个样品重复3次。自由基清除率计算公式如下:
(2)
式中:A对照为无水乙醇溶液的吸光度;A样品为样品的吸光度;A空白为磷酸盐缓冲溶液的吸光度。
1.5 数据分析
采用SAS 8.0软件进行单因素方差分析和差异显著性分析,采用Excel 2016软件作图。
2 结果与分析
2.1 OVA-桑葚酒渣花色苷纳米颗粒的包埋率
桑葚酒渣花色苷添加量对纳米颗粒包埋率的影响见图1。由图1可知,随着桑葚酒渣花色苷和OVA摩尔比的不断增加,OVA-桑葚酒渣花色苷纳米颗粒包埋率呈现先上升后下降的趋势,这可能是由于制备体系中桑葚酒渣花色苷过量造成的。当花色苷与蛋白质摩尔比为3∶1时,OVA-桑葚酒渣花色苷纳米颗粒的包埋率达到最高,为82.34%。可能此时溶液带有的正负电荷大约相等,净电荷达到最小值,凝聚反应最为充分,产生凝聚物达到最大值[11],对花色苷的包埋也最为充分。
2.2 OVA-桑葚酒渣花色苷纳米颗粒的形态
OVA-桑葚酒渣花色苷纳米颗粒的微观形态见图2。OVA分子在磷酸盐缓冲液中开始形成球形颗粒,粒径约为135~140 nm,颗粒也开始分散。加入桑葚酒渣花色苷以后,OVA球形颗粒迅速增多,颗粒形态较未加花色苷的有所减小,颗粒直径从135~140 nm减小到40~45 nm,表明添加花色苷后粒径减小,OVA发生了聚合。这一结果与姚惠芳等[7]报道在磷酸盐缓冲液中添加花色苷后BSA粒径变小的情况一致。
2.3 OVA-桑葚酒渣花色苷纳米颗粒的粒径和电势分布
OVA-桑葚酒渣花色苷纳米颗粒的粒径分布如图3所示。由图3可知,随着花色苷与OVA的摩尔比增加,形成纳米颗粒粒径呈现不断下降的趋势。不含花色苷的OVA颗粒粒径约为120 nm,这与扫描电镜的结果基本接近。根据马鑫[19]的研究,可能是因为电镜处理样品时间稍长,样品发生聚合,导致颗粒粒径略有变大。随着花色苷与OVA的摩尔比越高,OVA-花色苷纳米颗粒逐渐减小,当花色苷与OVA摩尔比为5∶1时,粒径约为40 nm,这与扫描电镜的结果相同,说明加入花色苷后OVA发生了紧密的聚合。
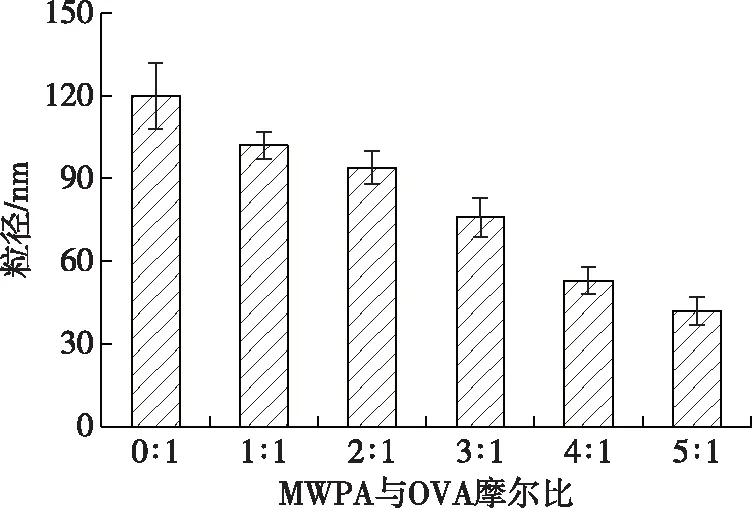
图3 OVA-桑葚酒渣花色苷纳米颗粒的粒径分布Fig. 3 Size distribution of OVA-mulberry wine pomace anthocyanin nanoparticles
OVA-桑葚酒渣花色苷纳米颗粒的电势分布如图4所示。在磷酸盐缓冲液中OVA的电势为-35 mV,随着花色苷与OVA摩尔比的逐渐增高,OVA-桑葚酒渣花色苷的电势逐渐降低,当摩尔比为5∶1时,OVA-花色苷纳米颗粒的电势最低,为-13 mV。这主要是由于OVA相对含量下降,溶液黏度随之下降,从而导致Zeta电势增加[20]。OVA-桑葚酒渣花色苷溶液Zeta电位绝对值增大时,表明OVA表面同性电荷增多,由于同性电荷间的相互排斥使OVA-桑葚酒渣花色苷溶液更稳定。
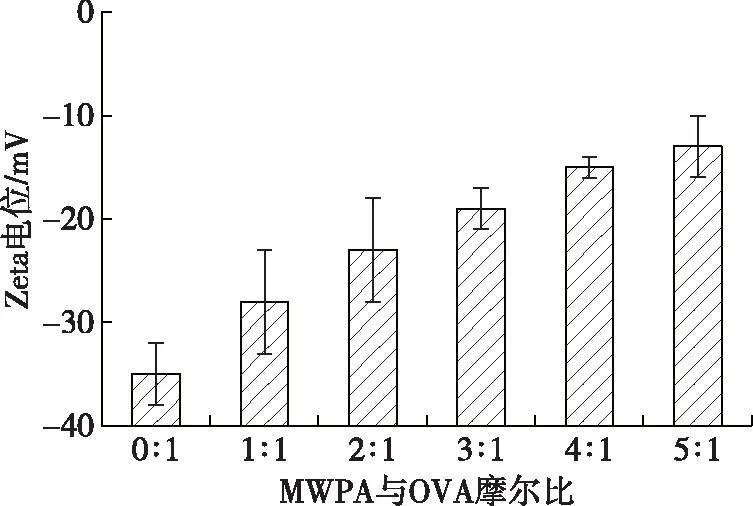
图4 OVA-桑葚酒渣花色苷纳米颗粒的电势分布Fig. 4 Zeta potential of OVA-mulberry wine pomace anthocyanin nanoparticles
2.4 OVA-桑葚酒渣花色苷纳米颗粒的抗氧化活性
OVA-桑葚酒渣花色苷纳米颗粒的抗氧化活性见图5。由图5a可知,当花色苷与OVA摩尔比逐渐增大时,DPPH自由基清除率呈现先增大后极缓慢上升的趋势。当摩尔比小于3∶1时,OVA-桑葚酒渣花色苷纳米颗粒清除DPPH能力随着浓度比增加呈增加趋势;当摩尔比大于3∶1时,随着花色苷与OVA浓度增加,OVA-桑葚酒渣花色苷纳米颗粒清除DPPH自由基清除率无明显增强。OVA-桑葚酒渣花色苷纳米颗粒清除ABTS自由基的能力与清除DPPH自由基规律一致(图5b)。由此可见,在一定范围内提高花色苷的浓度可以增强对OVA-桑葚酒渣花色苷纳米颗粒自由基清除的能力,原因是单位体积内花色苷B环酚羟基数目大,B环酚羟基可以与自由基发生反应,形成氢键并稳定,从而导致中断自由基链的反应[21]。
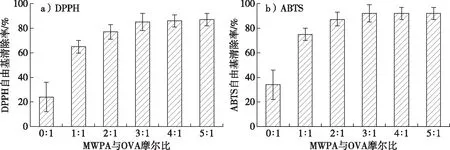
图5 OVA-桑葚酒渣花色苷纳米颗粒的抗氧化活性Fig. 5 Antioxidant activity of OVA-mulberry wine pomace anthocyanin nanoparticles
2.5 OVA-桑葚酒渣花色苷纳米颗粒模拟消化特性
OVA-桑葚酒渣花色苷纳米颗粒模拟胃肠道消化特性见图6。花色苷溶液在520 nm处有特征吸收,吸光度值越低,说明溶液中花色苷降解越严重。OVA-桑葚酒渣花色苷纳米颗粒和花色苷在模拟胃消化过程中较稳定,模拟消化液520 nm处吸光度值缓慢下降,且两者差异不显著(P>0.05)。这与Reyes等[20]研究的花色苷在酸性条件下相对稳定的结果一致。在模拟肠消化模型中,花色苷稳定性较差,520 nm处吸光度值在2.0 h内降低了83%,而2.0~4.0 h则保持不变,这是因为花色苷被氧化并生成了醌类物质,不再具备花色苷的抗氧化性以及各种光谱特征等性质,因此,在同样的测试条件下无法被检测[21]。González-Barrio等[22]报道花色苷在回肠内分解后的含量下降60%,从而失去其特征吸收。OVA-桑葚酒渣花色苷纳米颗粒在模拟肠消化过程中520 nm处吸光度值也在缓慢下降,4.0 h后的含量仅为初始的55%左右,但显著高于未包埋的花色苷,由此可见,OVA包埋对桑葚酒渣花色苷有保护作用。
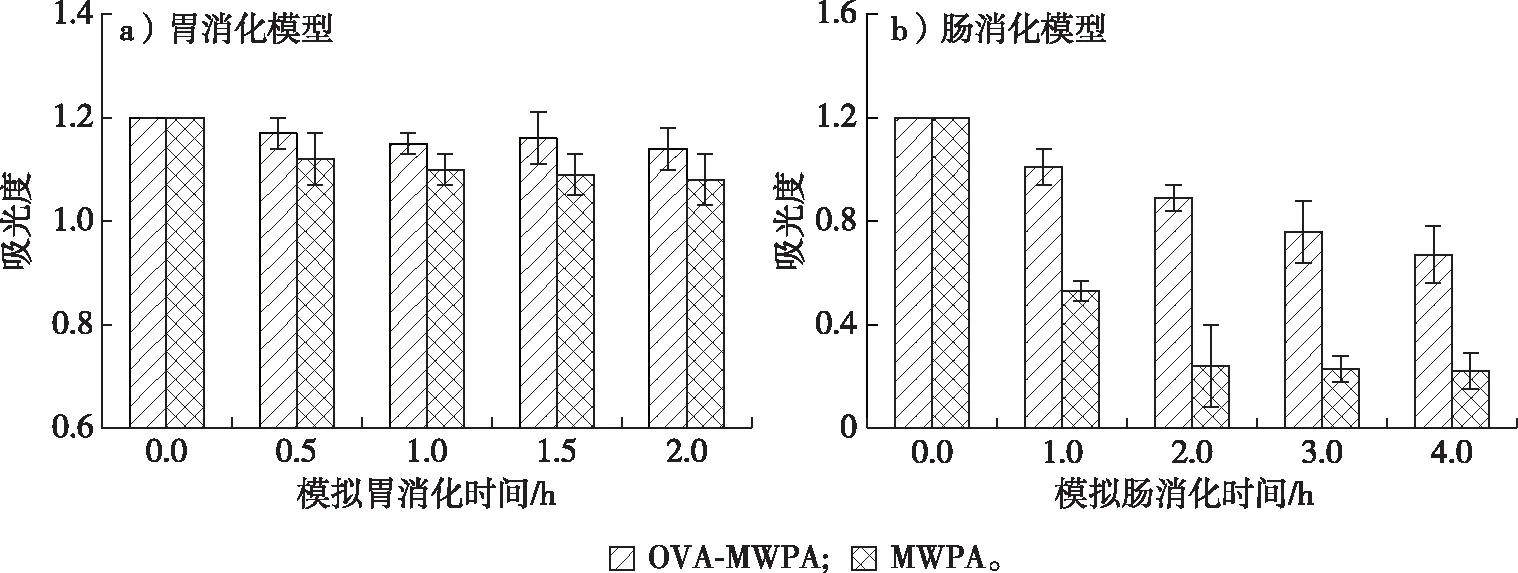
图6 OVA-花色苷纳米颗粒在体外消化模型中的稳定性Fig. 6 Stability of OVA-mulberry winepomace anthocyanin nanoparticles in vitro digestion model
3 结 论
1)鸡卵白蛋白可用于桑葚酒渣花色苷的纳米颗粒制备。当花色苷与蛋白质摩尔比为3∶1时,OVA能包埋最多的花色苷。桑葚酒渣花色苷与OVA在磷酸盐缓冲液中能相互作用形成纳米颗粒,粒径为40~45 nm。OVA纳米载体能显著提高花色苷的抗氧化活性。
2)在pH为7.4的肠模型中,OVA纳米载体可以增强花色苷的稳定性,能够提升其在人体内的吸收利用。研究结果可解决桑葚酿酒过程中酒渣处理困难的问题,提高桑葚的综合利用价值,对于推进桑葚系列产品的研发和桑葚产业健康持续发展具有重要现实意义。
