溶血对液相色谱串联质谱检测血清中维生素A、E、D、K的影响
2021-02-02黄和飞李佳兴谷叶李泽东李俊宇夏跃莲吕小波
黄和飞,李佳兴,谷叶,李泽东,李俊宇,夏跃莲,吕小波
(昆明和合医学检验所,云南 昆明 650106)
维生素是维持人体正常生理功能所必须的一类小分子有机化合物,在体内不能合成或合成量极低,必须由食物供给。维生素既不构成机体的组成成分,也非功能物质,然而在孕育生命及生长发育、调节人体物质代谢、维持正常生理功能、防治疾病等方面却发挥着极其重要的作用。为提高临床医师对患者维生素代谢状况评估及加强对防治维生素缺乏的了解,进一步推动我国维生素研究的开展,自2006年以来,中华医学会肠外肠内营养学分会及北京医学会肠外肠内营养学分会专家讨论制定《维生素制剂临床应用专家共识》[1]。随着临床检验技术的不断发展及检验设备的不断更新,液相色谱串联质谱因灵敏度高,特异性强,越来越多的被应用于小分子物质检测。近年来,液相色谱串联质谱法检测维生素受到广泛关注及应用,也为临床诊断及病情评估提供有效依据,但是在对血液标本进行检验时,常见血液溶血现象,溶血是血液样本采集中最常遇到的问题,溶血样本由于响应低、有基质效应等问题会影响LC-MS/MS的测定结果[2],《中华人民共和国药典(2015版)》、欧洲药品管理局、美国食品与药品监督管理局均要求关注溶血样本的基质效应。该现象会严重影响检验结果的准确性,进而影响临床诊断结果,导致预后效果不理想,因此,在检验过程中应尽量避免血液标本溶血现象[3-4]。本研究探讨溶血对维生素A、E、D、K测定结果的影响,旨在为临床取样提供参考,现报道如下。
1 材料与方法
1.1 材料
1.1.1 血样来源与选择 30 名健康志愿者均为昆明和合医学检验所员工,上午11:00 空腹采血,血样置于普通紫帽采血管中。
1.1.2 仪器与试剂 LC-MS/MS AB Sciex-4500MD、UV2802紫外-可见分光光度计、XA105电子天平、H2050R-1高速离心机、旋涡振荡器、氮吹仪、屈臣氏蒸馏水、HPLC 级甲醇、甲酸(质谱级)、维生素A(视黄醇):Sigma(USA)、维生素E(α-生育酚):Sigma(German)、维生素A 同位素内标:buchem bv、维生素 E 同位素内标:TRC、维生素 D2:Sigma(USA)、维生素 D3:Sigma(USA)、维生素 D2~d3:ISO(USA)、维生素 D3~d6:TRC(CAN)、维生素K1:中检所、维生素K1~d7:Sigma-aldrich、维生素K2(MK4):Sigma-aldrich;维生素K2(MK4):Sigma-aldrich、维生素K2(MK4)-d7:TRC。
1.1.3 血样采集 30 名健康志愿者,每人用2 支5 mL 的紫帽采血管自肘静脉分别采2管血液,每管3 mL;然后分别取1管血液,共30 管作为溶血对照组,另外30 管作为正常对照组。30管正常对照组血液样本3 000 rpm离心20 min,分离血浆备用。另外30管溶血对照组血液样本按上述方法用一次性注射器针头涡旋搅拌3 min,或剧烈震荡1 min,使血样发生溶血;溶血样本3 000 r/min 离心20 min,分离血浆备用,分成2份,1份用于检测溶血率,1份用于检测维生素A、E、D、K的浓度。
1.1.4 溶血模型的建立 按文献[5-6]方法,将取样后的血样用一次性注射器针头涡旋搅拌3 min,或剧烈震荡1 min,使血样发生溶血。
1.1.5 样本制备 ①阳性对照管:取1 支正常血液样本(2 mL),加入等体积的纯化水2 mL裂解红细胞,制备阳性对照管;②阴性对照管:用0.9%氯化钠溶液或纯化水作为阴性对照;③检测:用紫外-可见分光光度计于545 nm检测阳性对照管(3管)、阴性对照(3管)及溶血待测样本的吸光度,并计算溶血率。溶血率(%)=(溶血样本-阴性对照)/(阳性对照-阴性对照)[5-6]。
1.2 方法
1.2.1 生物样本前处理 全血样本3 000 r/min离心10 min,收集血清200 μL,加入无水乙醇400 μL,振荡5 min,1.2 mL正己烷振荡提取6 min,离心10 min取上清进行氮气吹干,流动相溶解后,取100 μL上机检测。
1.2.2 色谱和质谱条件 流速0.4 mL/min,色谱柱:Agilent,C8,5 μm,2.1 mm×50 mm;柱温箱25 ℃,进样体积10 μL,分析时间6.5 min,流动相:有机相纯甲醇,水相(0.1% 甲酸),进行梯度洗脱,梯度程序,见表1。

表1 液相色谱梯度洗脱程序(%)Table 1 Gradient elution procedures for liquid chromatography(%)
电喷雾电离(ESI 源),正离子扫描,采集模式:MRM 扫描,仪器参数分别为:CUR,15;CAD,5;TEM,350;Gas 1,20,DP,70 V;EP,10 V;CE,20 V;离子通道MRM 分别为:VA,m/z 269→213;VA-IS,m/z 272→216;VE,m/z 431→165;VE-IS,m/z 437→171;VD2,m/z 413→337;VD2-IS,m/z 416→340;VD3,m/z 401→365;VD3-IS,m/z 407→371;VK1,m/z 451→187;VK1-IS,m/z 458→194;VK2,m/z 445→187;VK2-IS,m/z 452→194。
1.3 统计学方法 采用SPSS 11.5统计软件进行数据分析,计量资料以“±s”表示,采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 标准曲线建立 分别精密称量AEDK 标准品,并根据SOP制备相对应的标准工作溶液,每个项目重复3次,标准曲线方程及相关系数,见表2~4。
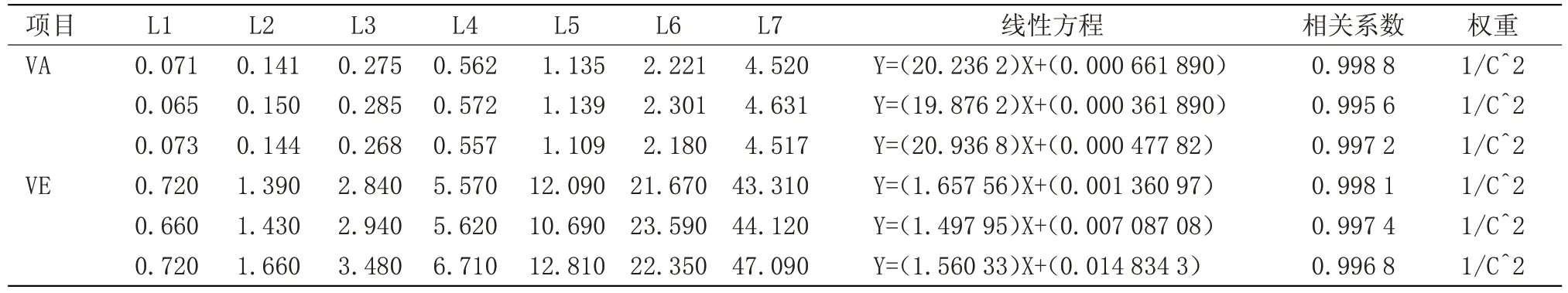
表2 VA、VE测定标准曲线方程及相关系数Table 2 VA,VE determination of standard curve equation and correlation coefficient
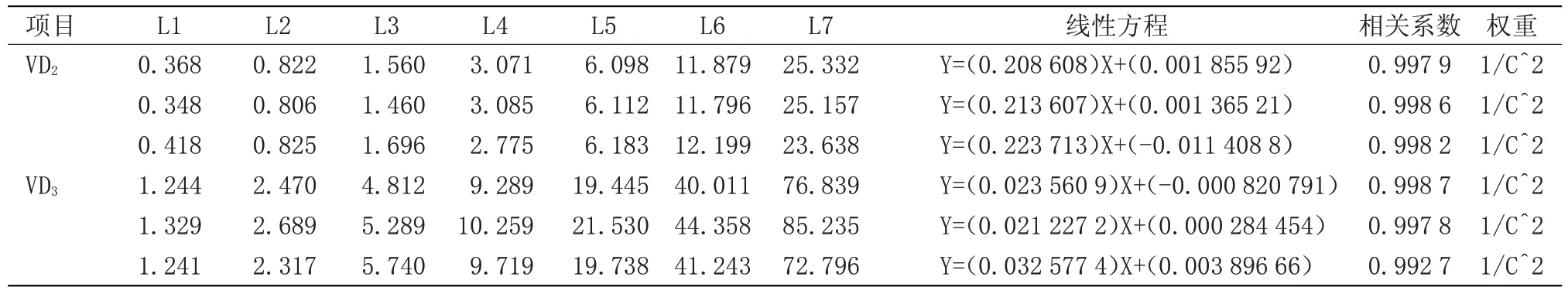
表3 VD2、VD3测定标准曲线方程及相关系数Table 3 VD2,VD3 determination of standard curve equation and correlation coefficient

表4 VK1、VK2测定标准曲线方程及相关系数Table 4 VK1,VK2 determination of standard curve equation and correlation coefficient
2.2 溶血对维生素A、E、D、K的影响 溶血对照组的样本溶血率平均为34%;同一组样本溶血后,维生素A的含量明显降低,与溶血前对照组比较差异有统计学意义(P<0.01);而维生素E、D2、D3、K1、K2的含量无明显变化,与溶血前对照组比较差异无统计学意义,见表5。
2.3 不同溶血程度对维生素A、E、D、K的影响趋势 不同程度溶血后,VA、VD2、VD3、VK1、VK2的含量与正常值比较差异无统计学意义,且同一组溶血样本,轻、中、重度溶血后,各组检测值比较差异无统计学意义;轻、中度溶血后,VE的含量与正常值比较差异无统计学意义,但重度溶血组检测值与中度溶血组及正常值之间比较差异有统计学意义(P<0.05),见表6~7。
2.4 溶血程度与维生素A、E、D、K 的相关性考察(皮尔逊相关系数R) 在不同程度溶血期间,当溶血率>50%时,VA、VE的皮尔逊相关系数R值均≥0.9,说明VA、VE含量与重度溶血相关性明显;在不同程度溶血期间里,VD、VK 的皮尔逊相关系数R值远<0.9,说明VD、VK 含量与溶血程度无相关性,见表8~9。
2.5 不同溶血程度平均值与维生素A、E、D、K的平均值相关性考察(皮尔逊相关系数R) 在不同程度溶血期间,VA的皮尔逊相关系数R值>0.9,说明VA含量与溶血相关性明显;VE的皮尔逊相关系数R值接近0.9,说明VE含量与溶血也有较大相关性;VD、VK的皮尔逊相关系数R值远<0.9,说明VD、VK含量与溶血程度没有相关性,见表10~11。
表5 样本溶血对维生素A、E、D、K的血药浓度影响(±s)Table 5 Effects of hemolysis on the plasma concentrations of vitamin A,E,D and K(±s)

表5 样本溶血对维生素A、E、D、K的血药浓度影响(±s)Table 5 Effects of hemolysis on the plasma concentrations of vitamin A,E,D and K(±s)
检验项目VA(μg/mL)VE(μg/mL)VD2(ng/mL)VD3(ng/mL)VK1(ng/mL)VK2(ng/mL)溶血前对照组(n=30)检测结果0.46±0.13 11.40±2.97 0.87±0.42 17.23±6.51 1.29±0.89 0.14±0.10溶血后对照组(n=30)检测结果0.37±0.12 10.70±2.89 0.88±0.41 17.10±6.01 1.46±0.64 0.12±0.07溶血率(%)0.34±0.22
表6 不同溶血程度对维生素A、D的血药浓度影响趋势(±s,n=30)Table 6 Influence trend of different hemolysis degree on blood drug concentration of vitamin A and D(±s,n=30)
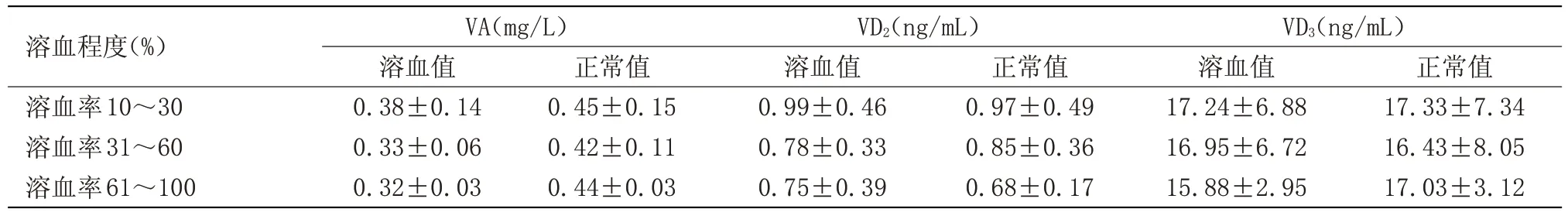
表6 不同溶血程度对维生素A、D的血药浓度影响趋势(±s,n=30)Table 6 Influence trend of different hemolysis degree on blood drug concentration of vitamin A and D(±s,n=30)
溶血程度(%)溶血率10~30溶血率31~60溶血率61~100 VA(mg/L)溶血值0.38±0.14 0.33±0.06 0.32±0.03正常值0.45±0.15 0.42±0.11 0.44±0.03 VD2(ng/mL)溶血值0.99±0.46 0.78±0.33 0.75±0.39正常值0.97±0.49 0.85±0.36 0.68±0.17 VD3(ng/mL)溶血值17.24±6.88 16.95±6.72 15.88±2.95正常值17.33±7.34 16.43±8.05 17.03±3.12
表7 不同溶血程度对维生素E、K的血药浓度影响趋势(±s,n=30)Table 7 Influence trend of different hemolysis degree on blood drug concentration of vitamin E and K(±s,n=30)

表7 不同溶血程度对维生素E、K的血药浓度影响趋势(±s,n=30)Table 7 Influence trend of different hemolysis degree on blood drug concentration of vitamin E and K(±s,n=30)
注:与溶血率31~60组比较,aP<0.05;与正常值比较,bP<0.05
溶血程度(%)溶血率10~30溶血率31~60溶血率61~100 VE(mg/L)溶血值11.07±3.11 10.40±1.37 7.68±1.28ab正常值11.47±3.14 11.18±1.73 11.17±2.26 VK1(ng/mL)溶血值1.27±0.49 1.68±0.64 1.18±0.30正常值1.11±0.55 1.24±0.77 0.92±0.32 VK2(ng/mL)溶血值0.10±0.04 0.12±0.05 0.16±0.16正常值0.11±0.07 0.11±0.07 0.16±0.08

表8 不同溶血程度与维生素A、D2、D3相关性分析(n=8)Table 8 Correlation between different hemolysis degrees and vitamin A,D2 and D3(n=8)
表9 不同溶血程度与维生素E、K1、K2相关性分析(±s,n=8)Table 9 Correlation between different hemolysis degrees and vitamin E,K1 and K2(±s,n=8)

表9 不同溶血程度与维生素E、K1、K2相关性分析(±s,n=8)Table 9 Correlation between different hemolysis degrees and vitamin E,K1 and K2(±s,n=8)
溶血程度(%)溶血率10.0~20溶血率20.1~30溶血率30.1~60溶血率60.1~100 VE(mg/L)溶血值10.42±3.01 11.46±3.27 11.65±1.37 7.68±1.28 R值0.37 0.21 0.87 0.94 VK1(ng/mL)溶血值1.03±0.37 1.41±0.51 1.39±0.64 1.18±0.30 R值0.43 0.64 0.23 0.63 VK2(ng/mL)溶血值0.11±0.02 0.10±0.05 0.14±0.04 0.16±0.03 R值0.39 0.04 0.10 0.75
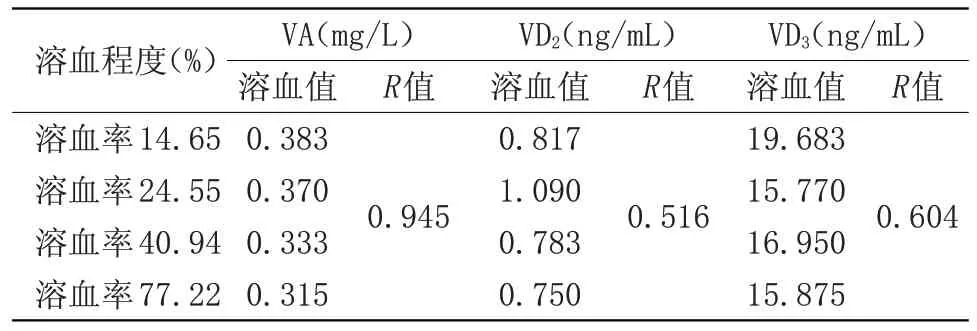
表10 不同溶血程度平均值与维生素A、D2、D3平均值相关性分析(n=32)Table 10 Correlation between the mean value of different hemolysis degrees and the mean value of vitamin A,D2 and D3(n=32)

表11 不同溶血程度平均值与维生素E、K1、K2血药浓度平均值相关性分析(n=32)Table 11 Correlation between the mean value of different hemolysis degrees and the mean value of vitamin E,K1 and K2(n=32)
3 讨论
临床检验能为诊断和治疗提供科学的数据支持,检验结果的准确性对于临床诊断的准确性及治疗的有效性具有直接影响[7],只有做好检验分析前的质量控制,才能有效确保后续工作质量。但是,本研究结果发现,溶血样本对维生素检测结果的影响机制大致可归纳为以下几个方面:①对化合物稳定性的影响:溶血的发生会导致红细胞中的部分物质(如酶)释放到血清/血浆中[8]。这些物质可能会造成目标化合物在血清/血浆基质中稳定性的改变[9-10],具体表现为红细胞破裂后释放的血红蛋白引起测量误差,血红蛋白中含有过氧化物酶和超氧化物歧化酶,由于维生素A属于脂溶性维生素,可作为阻断反应链的抗氧化剂,与有机过氧自由基结合,其中过氧化物酶和超氧化物歧化酶水平与血清中视黄醇(维生素A)水平有密切关系,可相互作用,直接影响机体的抗氧化系统,调控机体抗氧化能力[11];②红细胞对待测物有一定的吸附作用,尤其在重度溶血的样本中,红细胞浓度过高,虽然前处理已进行蛋白质沉淀和液液萃取,但样本中仍有大量红细胞未被除去,进入质谱后,干扰待测物信号;③对色谱分离的影响[12]:溶血样本在萃取后可能会有一些特有的与待测物质共流出的内源性干扰。使用基于非溶血基质开发的色谱分离方法,可能无法将这些干扰与待测化合物分离;④对基质效应的影响:溶血的发生会产生溶血基质特有的基质效应,可能引起离子抑制或增强,进而影响试验的总体精密度和准确度[13]。本研究中存在的局限或不足是无法通过肉眼来判断溶血程度的大小,目前尚无有统一的溶血判断标准,为保证维生素检测的准确性,在日常样本采集中尽量避免溶血。
有研究结果显示,通过优化检测方法、增强抗干扰能力、提升检测敏感性,可消除溶血对LC-MS/MS检测结果的影响。分析原因为,①溶血样本中有干扰峰,可优化色谱条件,如流动相、色谱柱、洗脱梯度等,使待测物与基质分离[14];Hughes等[2]在检测血浆中的阿托伐他汀时,通过优化流动相中有机相和水相的比例,消除溶血样本中的干扰峰对内标物的影响。②溶血样本中待测物信号受到抑制,一方面可优化样本前处理过程,尽可能去除溶血产生的杂质,Hughes 等[2]通过在固相萃取处理前先进行蛋白沉淀,并在固相萃取处理时多进行一步酸洗,成功消除了溶血对卡维地洛定量分析的影响。另一方面也可优化离子源种类和质谱参数,提高敏感性;一般情况下,LC-MS/MS常用的离子源克服基质效应的能力依次为大气压光喷雾电离源、大气压化学电离源、电喷雾电离源[15]。③溶血样本与非溶血样本间的差异较大,可选用合适的内标。与结构类似物作为内标相比,同位素标记的内标可更加准确地修正基质效应对结果的影响,因此,应尽可能使用稳定同位素标记的内标以消除基质效应的影响[16]。
综上所述,溶血对于维生素A 有较大影响,临床采集血液样本时应严格遵守操作规程,防止溶血现象发生,确保检验结果的准确性。
