Complexin蛋白通过C端序列加速突触形成
2021-02-02吴世平裴青崔超扬阳小飞
吴世平,裴青,崔超扬,阳小飞
(中南民族大学 生物医学工程学院&脑认知国家民委重点实验室&医学信息分析及肿瘤诊疗湖北省重点实验室&膜离子通道与药物研发实验室,武汉 430074)
中枢神经系统的活动对维持生物体正常的生命活动具有重要意义,所以神经元的正常生长和发育尤为重要.中枢神经系统主要存在两种信息传递方式,其中一种是细胞内的电传导,而另一种则是通过囊泡运输来实现细胞间的信号传递.囊泡释放主要依赖于膜上的SNARE复合体[1],而SNARE复合体的正常组装不光影响囊泡的释放,同时可能会影响神经元的生长与发育.
Cpx(complexin)蛋白是一种可溶性的蛋白小分子,又名 Synaphin,可以与SNARE 复合体结合,直接参与突触囊泡分泌[2].Cpx主要存在四种亚型,在本文中使用亚型Ⅰ.CpxⅠ主要由四个结构域组成,包括N末端(1-26)、附属α-螺旋(27-47)、中心α-螺旋(48-70)和C末端(71-134)[3].其中N末端在钙离子触发的快速同步释放中起重要作用[4];附属α-螺旋钳制自发性的囊泡释放[5];中心α-螺旋是与SNARE复合物结合的区域,CpxⅠ的所有功能都需要中心α-螺旋[6];C末端则对囊泡的固定和启发至关重要[7].最近,C末端也被认为是导致膜被弯曲的重要因素[8].CpxⅠ通过参与SNARE复合体的组装来调控囊泡的释放,同时,CpxⅠ的不同结构域对囊泡的释放有不同的影响.但是,CpxⅠ对神经元的生长是否具有影响还不是十分清楚,这种影响是否具有结构域的依赖性也未可知.
基于此,本文主要研究过表达的CpxⅠ蛋白是否对小鼠大脑皮层神经元的生长产生影响,以及这种影响是否存在结构域的依赖性.
1 材料与方法
1.1 材料和仪器
HEK293T细胞(本实验室保存);小鼠大脑皮层神经元细胞(自提取).
胎牛血清、DMEM高糖培养基、MEM培养基、Opti-MEM减血清培养液、PEI、0.05% 胰蛋白酶-EDTA、0.25% 胰蛋白酶-EDTA(Gibco);Na2HPO4、NaHCO3、KH2PO4、NaCl等(Sigma).
共聚焦显微镜(Nikon C2);相差显微镜(奥林巴斯CKX41);超净工作台(苏州净化设备,SW-CJ-2D);低速离心机(安徽中科中佳科学仪器,sc-3610);CO2恒温细胞培养箱(Thermo Scientific 3111);智能数显恒温水浴锅(国华2004-21);低温摇床(Thermo Scientific MAXQ4000);高压灭菌锅(Panasonic MLS-3781L).
1.2 实验方法
1.2.1 配制溶液
用DMEM、MEM和胎牛血清等试剂配制培养细胞所需的培养基,并调至适当的pH与渗透压(pH调至7.2~7.4,渗透压调至300~320 mOsm·kg-1);利用NaCl、KCl、Na2HPO4、KH2PO4等试剂配制PBS缓冲液(每升超纯水中加入NaCl 8 g,KCl 0.2 g,Na2HPO41.44 g,KH2PO40.24 g,pH调至7.4);配制PEI(60~68 ℃下溶解PEI干粉,终浓度为1 μg·μL-1,pH调至7.4),细胞培养基及PEI溶液采用真空过滤消毒,PBS溶液采用灭菌锅灭菌.
1.2.2 HEK293T细胞的传代培养
使用DMEM高糖培养基对HEK293T细胞进行传代培养,将HEK293T细胞接种于T25培养瓶中并加入3 mL DMEM高糖培养基,当细胞生长覆盖率达到80%~90%时,进行细胞传代[9].
1.2.3 慢病毒包装
在1.5 mL EP管中加入100 mL Opti-MEM减血清培养液,后加入RRE 1 μg、REV 1 μg、VSVG 0.5 μg、目的质粒1.5 μg,之后加入12 μL PEI试剂震荡混匀,室温静置30 min,最后将包装好的病毒加入传代培养1 d的HEK293T细胞中,在培养48 h后收取上清,加入10%的蔗糖溶液,静置分层,之后10000 g离心4 h,弃去上清,加入20 μL PBS溶液静置24 h得到高滴度慢病毒.
1.2.4 小鼠大脑皮层神经元的原代培养
用灭菌的镊子将多聚赖氨酸预处理过的玻片夹入24孔培养板中并用超纯水清洗3次,洗去多余的多聚赖氨酸.准备48 h内的新生昆明小白鼠,取小鼠的大脑皮层,之后皮层加1 mL 0.25% 胰蛋白酶-EDTA放入CO2培养箱消化13 min.消化完成,弃去胰蛋白酶,用MEM培养基清洗3次,轻轻吹打小鼠大脑皮层8~10次,滤网过滤后[10],混匀加入至24孔培养板中,放入5%二氧化碳培养箱中进行原代培养,培养时间总共为10 d.
1.2.5 病毒侵染
当小鼠大脑皮层神经元培养至第4 d时,向每个孔中加入3 μL高滴度的慢病毒溶液,之后继续培养,小鼠皮层神经元细胞总计培养10 d,病毒侵染后的培养时间为6 d.
1.2.6 免疫荧光染色
小鼠大脑皮层神经元培养至第10 d,进行免疫荧光染色.每孔加入500 μL PBS;吸净PBS后加入400 μL 4% PFA固定15 min;吸净PFA后加入400 μL 0.2% Triton X-100穿孔5 min;吸净Triton X-100后500 μL BSA洗3次,后用500 μL BSA封闭30 min;吸净BSA,每孔加入250 μL一抗,37 ℃孵育2 h或4 ℃隔夜孵育;吸净一抗,500 μL PBS洗3次,每次5 min;洗完后,每孔加入250 μL二抗孵育30 min;孵育结束加入500 μL PBS洗6次,每次5 min;之后在载玻片上滴加3 μL Fluoromount-G,将处理好的玻片倒置粘贴于载玻片上,静置数小时,等玻片彻底固定后开始免疫成像.一抗中兔抗标记Synapsin,鼠抗标记MAP-2(微管相关蛋白2);二抗中山羊抗兔488标记Synapsin,山羊抗鼠546标记MAP-2.
1.2.7 共聚焦成像
使用共聚焦显微镜进行免疫荧光成像,物镜选取60倍的油镜,拍摄分辨率选择2048×2048,扫描间隔为2.4 s,检测灵敏度HV设置成100,offset设置成-20,激光功率设置成20.在本次实验中,每组样本拍摄10~20张图片.
1.2.8 数据处理
用Image J软件对所拍图片进行分析,将荧光图像转化成8 bit的灰度图,再将灰度图进行二值化处理,转换成黑白图像,荧光强度高于40的呈黑色,低于40的呈白色.在黑白图像中,突触呈现为单个点连成的线,通过计算点的密度和平均大小,来推断突触的生长情况.实验中,每张成像图片中含有一根或多根突触,若存在多根突触,则分别计算每根突触的密度和平均大小,之后对所有突触进行平均,最后再对多张成像图片进行统计,分析方法为学生t检验.
2 结果
2.1 过表达野生型complexin对小鼠皮层神经元生长的影响
对培养10 d的小鼠神经元细胞进行免疫荧光试验,再使用共聚焦显微镜对细胞进行荧光成像,Synapsin抗体标记神经元突触,MAP-2标记神经元树突.使用Image J对获得的荧光成像图片进行处理,然后对突触进行统计分析,得到突触的密度和平均大小.本次实验采用随机区组设计,进行4次独立重复实验并统计分析.结果如图1所示,过表达CpxWT的实验组相较于空载的对照组,突触密度显著上升(P<0.001),但突触平均大小无显著性差异.故可以推测,过表达的CpxWT对小鼠皮层神经元的生长可能有一定的促进作用.
2.2 Complexin不同结构域对小鼠皮层神经元生长的影响
CpxⅠ不同结构域在囊泡释放中起不同功能,因此在本次实验中构建了两种不同的CpxⅠ突变,以探究CpxⅠ的促进作用是否存在结构依赖性.两种突变分别为C末端部分缺失的Cpx1-86和N端完全缺失加附属α-螺旋部分缺失的Cpx41-134.3次独立重复实验后进行统计分析,结果发现:Cpx1-86在突触的密度上有较显著地下降,在突触的平均大小上无差异;而Cpx41-134在突触的密度上有较显著地上升,在突触的平均大小上无差异.因此,根据结果可以推测Cpx1-86缺失的C末端在促进神经元的生长上具有较关键的作用,而N末端和附属α-螺旋的缺失可能对CpxⅠ促进生长的功能无显著的影响.
2.3 Complexin的C末端定位对小鼠皮层神经元生长的影响
根据已有的研究[4],推测在促进小鼠皮层神经元的生长过程中CpxⅠ的C末端起着较为重要的作用.因此,在Cpx1-86的基础上构建了两种CpxⅠ的突变体,其中一种为Cpx1-86-CAIM,是将异戊二烯化的C末端序列连接到Cpx1-86的尾端,这种突变体将优先与细胞膜融合;而另一种突变为Cpx1-86-CSpα,在Cpx1-86的尾端加上半胱氨酸串联蛋白序列,这种串联蛋白被认为是囊泡锚定蛋白,因此Cpx1-86-CSpα将更优先与囊泡膜融合.3次独立重复实验后进行统计分析,结果发现:无论是在尾端加上异戊二烯化的C末端序列还是半胱氨酸串联蛋白序列,Synapsin的密度都有较显著地上升,而大小都有不显著地下降,因此可以认为两种突变都恢复了Cpx1-86的促进生长功能.通过上述实验可以推测:CpxⅠ对神经元的促进作用不依赖于CpxⅠ的定位,而是与C末端序列本身有关.
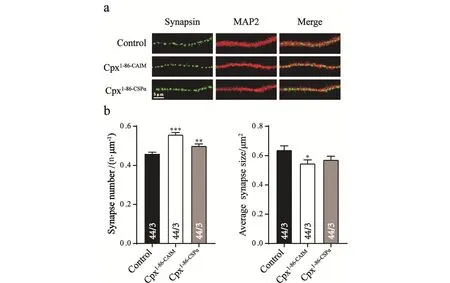
图3 Cpx的不同定位对突触的生长无影响Fig.3 No facilitation of synapse formation by the different target of Cpx(a)免疫荧光成像示意图.对照组为空载,实验组分别过表达Cpx1-86-CAIM和Cpx1-86-CSpα.绿色荧光标记突触蛋白,红色荧光标记MAP-2;(b)荧光图像转换成二值化图像后,对突触蛋白的密度和平均大小进行统计,**P<0.01 vs.control,***P<0.001 vs.control
3 讨论
神经递质的释放过程是SNARE依赖性的囊泡融合[11],而在囊泡融合的过程中,complexinⅠ(CpxⅠ)与SNARE复合体的结合是必不可少的[12].CpxⅠ在突触囊泡融合中的作用已经得到了充分的研究,但它是否参与了突触的形成过程仍未被发现.
CpxⅠ是调控突触囊泡释放的蛋白,但CpxⅠ对突触的生长是否有影响,则是本次实验的目的.根据以往的研究,CpxⅠ对囊泡的释放具有钳制的作用,当CpxⅠ缺失时,突触的自发性囊泡释放失去控制,频率明显增加;而诱发性的囊泡释放幅值明显减少[7],同时缺失CpxⅠ和CpxⅡ的幼鼠出生致死[13].所以,CpxⅠ作为生命活动必不可少的蛋白,在突触的生长过程中可能也起着一定的作用.为了验证推测,用过表达的CpxⅠ慢病毒侵染小鼠大脑皮层神经元细胞,经过培养后,免疫荧光成像,统计分析后发现过表达CpxⅠ对突触的生长确实存在一定的促进作用.
过表达的CpxⅠ对突触的生长有促进作用,这与初步猜测相符,之后进一步推测CpxⅠ的促进作用是结构依赖的,因为大量研究表明CpxⅠ在神经递质释放中具有结构/功能依赖性[3-6,8,14].对于CpxⅠ而言,除了至关重要的中心α-螺旋外,对功能影响较大的是N末端和C末端,N末端调控诱发性的囊泡释放[4],C末端和囊泡的固定与释放有关[7].因此,对于结构依赖性的研究主要着手于CpxⅠ的N末端以及C末端.于是构建了两种质粒,一种过表达缺失C末端的CpxⅠ,一种过表达缺失N末端的CpxⅠ;侵染神经元后,统计分析发现缺失C末端的CpxⅠ对突触的生长存在一定的抑制,而缺失N末端的CpxⅠ与野生型的CpxⅠ表现一致,所以可以认为C末端在促进突触生长的过程中较为重要.
通过实验发现:促进小鼠皮层神经元生长时,Cpx的C末端较为重要,而C末端的功能主要与CpxⅠ的定位有关,所以接着确定Cpx的促进功能是否与Cpx的定位有关.构建了两种C末端突变体并侵染到神经元中,其一为异戊二烯化的C末端突变CpxⅠ(Cpx1-86-CAIM),这种突变使CpxⅠ优先与膜融合[15];而另一种突变是在Cpx1-86后面加半胱氨酸串联蛋白尾巴(Cpx1-86-CSpα),这种突变将CpxⅠ固定在囊泡膜上[16].有研究表明:就调控囊泡释放而言,Cpx1-86-CSpα能恢复CpxⅠ的功能,Cpx1-86-CAIM不能恢复CpxⅠ的功能,因此CpxⅠ在行使功能的时候是优先与囊泡膜融合的.推测Cpx1-86-CSpα有促进突触生长的功能,而Cpx1-86-CAIM没有.但是经过统计分析后,发现无论是Cpx1-86-CSpα还是Cpx1-86-CAIM都具有促进突触生长的功能.所以,CpxⅠ的促进功能可能与它的定位没有太大的联系,而是与C末端序列本身有关.
可以做出推论:CpxⅠ对神经元突触的生长具有促进作用,并且这种促进作用是C末端依赖性的,而CpxⅠ定位不同并不会改变这种促进作用,因此可以认为是C末端的序列本身产生的功能.但是,还不能明确CpxⅠ的促进功能是否与它调控囊泡释放的功能有关.
