不同种类固相萃取柱对特医食品中香料含量结果的影响
2021-02-01吴纤愫郑平安周勇陈才军
吴纤愫,郑平安,周勇,陈才军
1. 舟山市食品药品检测检验研究院(舟山 316021);2. 浙江海力生生物科技股份有限公司(舟山 316021)
香兰素、乙基香兰素、甲基香兰素、麦芽酚和乙基麦芽酚等是食品中重要的增香剂。增香剂具备弥补食品本身味道缺陷、赋予或加强食品生动滋味的特点,被广泛应用于食品,特别是乳制品、固体饮料、保健食品、特医食品中[1-2]。添加食品级香料不会出现食品质量安全问题,但如果超标使用或者带入,则会对人体造成潜在性危害,婴幼儿、危重患者及围手术期病人是对有害物质最敏感的群体[3-4]。特医食品是为满足进食受限,消化吸收障碍或代谢紊乱等这些最敏感的群体,专门加工配制而成的配方食品[5-7]。因此建立特医食品中香精香料的检测方法具有重要意义。
国内较多文献中有关于香兰素、乙基香兰素等添加剂的检测方法,主要有毛细管电泳法、液相色谱法、液相色谱-质谱法、氢火焰-气相色谱法、伏安法、气相色谱-质谱法等,多是应用于乳制品、牛奶、饮料等食品中[8-9]。对这些样品而言,成分都过为单一,并没有针对特医食品的检测方法,在样品处理方法和检测的灵敏度与特医食品存在差异。在特医食品中需要考察基质效应对含量准确性的影响,现有标准均不能满足具有复杂基质的特医食品检测的需要。最新的有关文献中有GC-MS和LC-MS这2种检测技术来检测食品中香料,但前处理操作复杂,仪器运行成本较为昂贵,不能很好满足基层检测单位的实验室推广应用。因此,需要对上述方法进行优化和建立简单易行的固相萃取检测技术来满足特医食品中食用香精香料的检测需要[10]。
1 材料与方法
1.1 材料与设备
特殊医学用途配方食品;香兰素(纯度99.9%)、香草酸(纯度98.9%)、愈创木酚(纯度98.9%)、4-羟基苯甲酸(纯度99.9%)(上海安谱实验科技股份有限公司);乙基香兰素(纯度98.5%)(美国Sigma);甲基香兰素(纯度98%)、乙基麦芽酚(纯度98%)、邻香草醛(纯度97%)(加拿大TRC公司);麦芽酚(纯度99.8%)、丁香酚(纯度99.0%)、香豆素(纯度99.7%)(德国Dr. Ehrenstorfer)。
甲醇(色谱纯,德国Meker公司);磷酸(GR级,国药集团化学试剂有限公司);色谱柱Poroshell 120 SB-Aq(4.6 mm×100 mm,2.7 μm,美国安捷伦),Ultimate LP-C18(4.6 mm×250 mm,5 μm,月旭科技(上海)股份有限公司);固相萃取柱Welchrom®C18E(150 mg/6 mL)、Welchrom®P-SAX(150 mg/6 mL)、Welchrom P-WAX(150 mg/6 mL)(月旭科技(上海)股份有限公司),Poly-Sery HLB(500 mg/6 mL,上海安谱试验科技股份有限公司),Captive EMR-Lipid小柱(600 mg/6 mL,美国安捷伦公司);防交叉污染固相萃取装置(SUPELCO VISIPREP 24TM DL,美国Supelco公司)。
1.2 试验方法
1.2.1 标准储备液及工作液的配制
将11个标准品分别精密称取至20 mL容量瓶中,加甲醇配制成单个标准溶液。质量浓度分别为2.572 5,3.010 0,3.036 2,3.305 1,2.655 5,2.732 3,4.049 8,2.557 3,3.048 6,3.198 7和4.812 7 mg/mL,于-18 ℃冷冻保存。分别精密移取2.5 mL单个标准液,用甲醇准确定容至50 mL容量瓶,混匀后得到混合标准中间液1;精密移取1.0 mL混合标准中间液1,用甲醇准确定容至50 mL容量瓶,混匀得到混合标准中间液2。精密移取11种标准溶液各1.00,0.50,0.20,0.10,0.05和0.02 mL,分别置于20 mL容量瓶中,加甲醇稀释至刻度,摇匀,即得系列标准曲线。
1.2.2 液相色谱条件
色谱柱:Poroshell 120 SB-Aq(4.6 mm×100 mm,2.7 μm);DAD检测波长280 nm;进样体积5 μL;流速1.0 mL/min;柱温30 ℃;流动相:A 0.1%磷酸水溶液;B甲醇;梯度洗脱条件见表1。
1.2.3 样品制备
样品溶液制备:固体样品用研钵研磨混合均匀,称取1 g置于刻度比色管中,加10 mL甲醇,涡旋1 min,超声提取10 min,以10 000 r/min离心10 min,静置分层,取5.0 mL上清液,供净化用(液体样品取1 g置于刻度比色管,加甲醇至10 mL,与固体样品同法制备)。
文言文是考试中的重头戏,也是我们常说的“学生有三怕”之一。我们在教授课内文言文的同时,虽然能让学生积累到不少有用的文言字词,但如果不做上几篇课外文言文,似乎也难以招架考试,而做课外文言文的目的主要在于熟悉题型,培养考感。
1.2.4 样品净化
Captive EMR-Lipid小柱处理方法:直接取上清液加至柱管内,上样接收,重力自流,抽干小柱,接收液用氮吹仪35 ℃吹至溶液不到1 mL,用甲醇定容至1 mL。过0.45 μm滤膜滤过,滤液供高效液相色谱测定。
SPE固相萃取小柱处理方法:分别用5 mL甲醇、5 mL超纯化水活化和平衡SPE柱,将上清液全部上柱,用8 mL甲醇洗脱,洗脱液用氮吹仪35 ℃吹至2 mL左右溶液,加甲醇定容至2 mL。
1.2.5 加标回收率试验
称取样品(全营养配方粉、高脂配方粉、匀浆膳(高纤维)、营养混悬液)各3份,每份1 g,置于刻度比色管中,分别加入2.0和0.1 mL混标标准中间液1以及2.0 mL混标标准中间液2,分别作为高、中、低浓度回收率,加甲醇至10 mL,按样品制备的方法制成加标回收溶液,待测定。
2 色谱条件的优化和选择
取11种香料标准品储备液,通过紫外可见分光光度计对每个单标进行最大波长扫描,发现280 nm吸收波长处,各分析物的响应、峰型、分离度均有较好效果。考察甲醇-水、乙腈-水混合溶剂体系及其添加0.1%磷酸、0.1%三氟乙酸时对11种香料的色谱行为影响。通过试验发现甲醇-0.1%磷酸溶液作为流动相且以1.2.2的梯度条件洗脱待测物质的分离度及峰形较好。
同时测定11种香料化合物对色谱柱的分离度等条件要求较高,难度在于目标物物理化学性质很接近,彼此间的微小差异不明显,流动相中甲醇初始体积分数的改变会导致色谱峰出峰顺序波动较大,且使用不同的色谱柱检测11种香料化合物,出峰顺序也不尽相同,普通色谱柱难以在较短的保留时间内分离。在仪器、流动相、柱温、进样量等条件相同的情况下,比较Agilent Poroshell 120 SB-AQ(4.6 mm×100 mm,2.7 μm)和Ultimate LP-C18(4.6 mm×250 mm,5 μm)等不同类型、不同粒径色谱柱对11种人工合成香料的分离情况。在梯度条件下,Ultimate LP-C18上除乙基香兰素和香豆素外其他的香料化合物均达到分离目标,但出峰时间较长,丁香酚流出时间95 min左右,不适用于目标成分较多的分析测试;Agilent Poroshell 120 SB-AQ则在20 min内将目标峰全部流出,且11种目标被测组分与相邻物质分离度良好。通过实验室长期使用发现AQ柱柱效高、重现性好,可耐受高水相、低pH及高柱温的极端条件,可匹配高效液相色谱仪(HPLC)和超高效液相色谱仪(UPLC),快速且高效地完成11种目标物质的色谱分离,提高检测效率,适用于批次较大、样品基质复杂的基层实验室使用。图2为最佳色谱条件下11种人工香料化合物的混合标准溶液色谱图。

图2 Agilent Poroshell 120 SB-AQ对11种人工合成香料的分离色谱图

表2 2种色谱柱的性能区别
3 结果与讨论
3.1 5种SPE固相萃取柱对11种香料化合物的加标回收率比较
由于特医食品中蛋白质含量较高,用水对样品进行浸泡处理时会带入大量水溶性蛋白质,因此测定前需对样品进行净化处理。根据香兰素、乙基香兰素、甲基香兰素、愈创木酚、香草酸、丁香酚、麦芽酚、乙基麦芽酚、香豆素、4-羟基苯甲酸、邻香草醛这11种人工合成香料弱酸性的特质[11],设计多种固相萃取小柱[12-13],分别是Welchrom® P-SAX混合强阴离子小柱、Welchrom P-WAX混合弱阴离子小柱、Poly-Sery HLB亲水-亲脂小柱[14]、Welchrom C18E封尾的C18小柱和Captive EMR-Lipid增强型脂质去除过滤柱,对目标化合物进行有效的分离、净化和富集。通过加入混合标准中间液1(1.0 mL)直接上柱,甲醇10 mL洗脱、35 ℃氮吹至近干,定容1 mL,过0.45 μm滤膜,按1.2.2色谱条件上机检测,测定5种小柱净化处理后回收率。Welchrom C18E柱、Poly-Sery HLB柱和Captive EMR-Lipid小柱混标过柱回收率均为满意。结果见表3。
3.2 样品加标过固相萃取柱的回收率影响
选择特医食品中全营养配方粉和营养混悬液各1 g,加1.0 mL混合标准中间液1,加甲醇至10 mL,与1.2.3和1.2.4样品前处理方法同法处理过柱,见表4。Poly-Sery HLB柱的固体样品回收率为22%~63%,Welchrom C18E小柱作为分散固相萃取基质难以完全去除脂质,过柱后的样液有部分乳状物积蓄,难以滤过,对仪器损害较大,需复溶至2~5 mL,想要达到检出限需加倍称样量。Captive EMR-Lipid小柱有较好回收率和重复性,快速、简便,满足检测要求且回收率良好,对样品基质选择范围更广泛,操作过程中上样无需活化和平衡,样液直接加载至Captive EMR-Lipid小柱以吸附脂肪和磷脂及蛋白质,除杂净化效果好,可明显提高样品前处理工作效率,适用于基层实验室对特医食品的初筛。试验均使用Captive EMR-Lipid为固相萃取小柱进行处理。
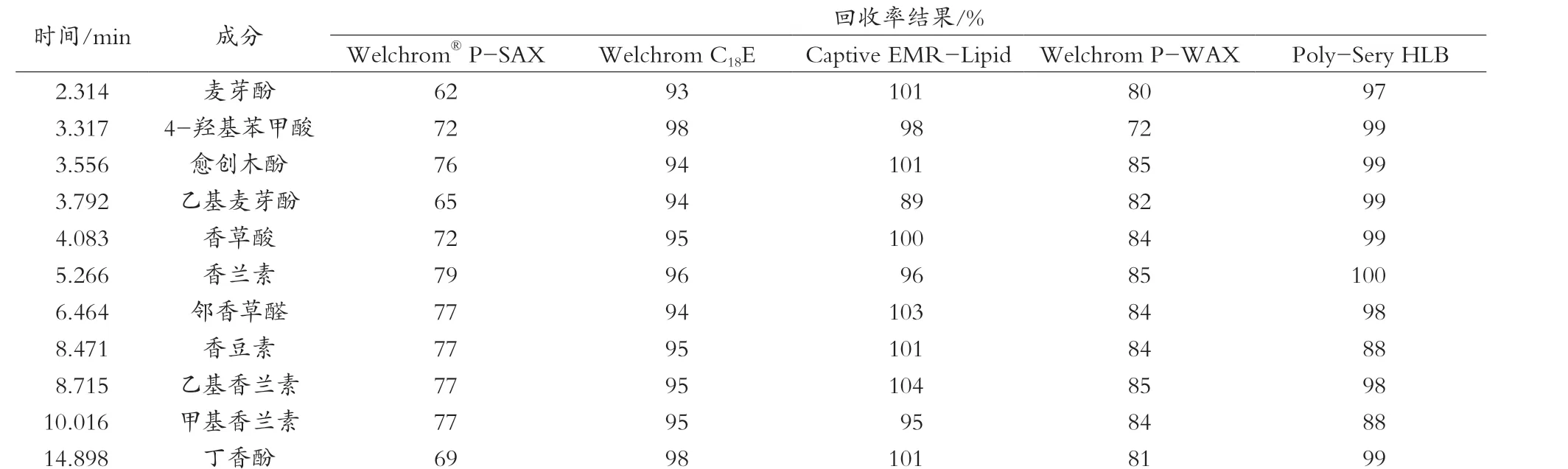
表3 不同类型固相萃取小柱对11种人工合成香料的回收率结果 %

表4 不同固相萃取方法对样品中11种人工合成香料回收率影响
3.3 不同溶剂对特医食品基质中11种人工合成香料的提取回收率影响
考虑到11种人工合成香料均极性较大,易溶于醇,试验用甲醇、甲醇-水(不同比例)、乙醇、乙腈等为提取溶剂,以常见全营养配方粉为研究对象,考察回收率影响。由于厂家会采用一些分子包埋技术来保护营养粉配方成分[15],因此在加入提取溶剂前,先添加适量水分来浸润样品,添加甲醇提取以增加待测组分的包埋释放;因目标化合物有酚羟基基团,具有弱酸性[16],考虑其提取净化过程在酸性条件下进行。由图3和图4可知,选用乙醇、乙腈虽可沉淀蛋白,降低干扰物的响应,但目标物随之流失。以甲醇为提取溶剂时,可获得理想的回收率;选择不同酸度、不同比例甲醇溶液则对4-羟基苯甲酸、乙基麦芽酚、邻香草醛这3种香料影响较大,回收率随着甲醇比例增加而明显提高,且重现性好。确定甲醇为提取溶剂。

图3 不同溶剂提取11种人工合成香料的回收率结果

图4 不同比例的甲醇和不同酸度的甲醇提取11种人工合成香料的回收率结果
3.4 11种香料化合物萃取效果的优化
3.4.1 甲醇提取量的选择
考察10 mL甲醇直接提取和10 mL甲醇分2次提取(5 mL、5 mL),取5.0 mL上清液氮吹至1 mL,结果表明,2种提取方式结果差别不大,直接提取混标过柱回收率较好,可达95%~101%。
3.4.2 萃取时间的优化
选择不同的超声时间萃取,取上清液过EMR-Lipid小柱,洗脱液浓缩后,滤过,检测。图5表明,11种人工合成香料在不同超声时间上的萃取结果,最佳萃取时间10 min。
综合比较混合标准中间液1(各取2.0 mL)加标水平下各因素组合的回收率和净化效果,使用10 mL甲醇作为提取剂,漩涡1 min,超声10 min,以10 000 r/min离心10 min,5.0 mL上清液直接上样过EMR-Lipid柱,重力自流,可获得良好提取、净化效果。

图5 不同萃取时间下11种人工合成香料的回收率结果
3.5 Captive EMR-Lipid净化及浓缩步骤的优化
试验采用通过式净化方式将提取溶液加载到EMR- Lipid固相萃取柱[17],针对脂类物质进行必要的净化,直接收集流出液完成净化,取定量浓缩管,用氮吹仪浓缩至少于1 mL,定容至1 mL,达到最低检出限。香料属于挥发性物质,会随着温度升高而挥发,故分别以35,40和45 ℃为氮吹温度考察11种人工香料化合物的回收率,以35 ℃为氮吹温度时,目标物质几乎没有损失,确定最佳氮吹温度35 ℃。见图6。
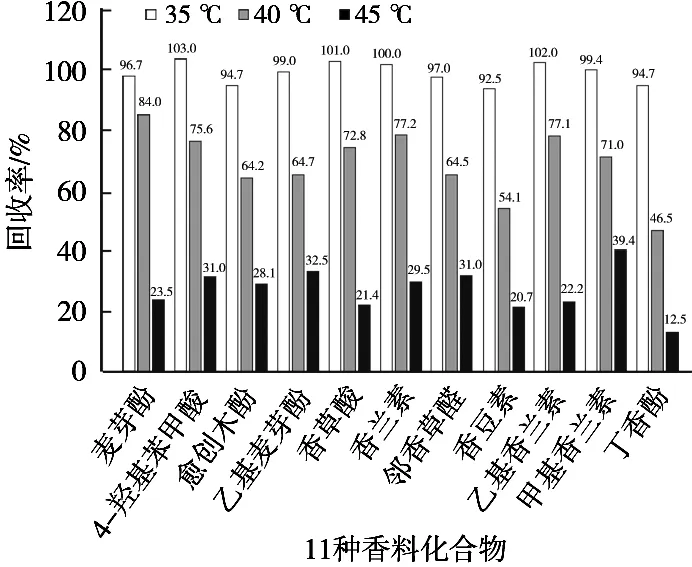
图6 氮吹仪水浴温度对11种人工合成香料的回收率影响
3.6 液-液萃取法和Captive EMR-Lipid柱的检测结果比较
利用香兰素等成分在酸性和碱性溶液中分别以盐和分子形式存在的特点,采用液液萃取的方法进行前处理,乙醚液萃取加酸溶液的样品,弃去水层;加一定量NaOH溶液萃取后,弃去乙醚层;加酸调pH至酸性,用乙醚萃取后,挥干乙醚,用甲醇定容,滤过0.45 μm滤膜,进样检测,与Captive EMR-Lipid柱的检测结果比较,样品加标回收率为21.9%~76.9%。
3.7 不同类型的特医食品加标回收率结果
按特医食品脂肪、蛋白质含量的高低和剂型的不同,在4种样品中添加不同浓度的各分析物进行回收率试验,3种添加水平的平均回收率为84%~107%。所得结果见表5。

表5 各成分的回收率及精密度结果(n=3)
转下页
接表5
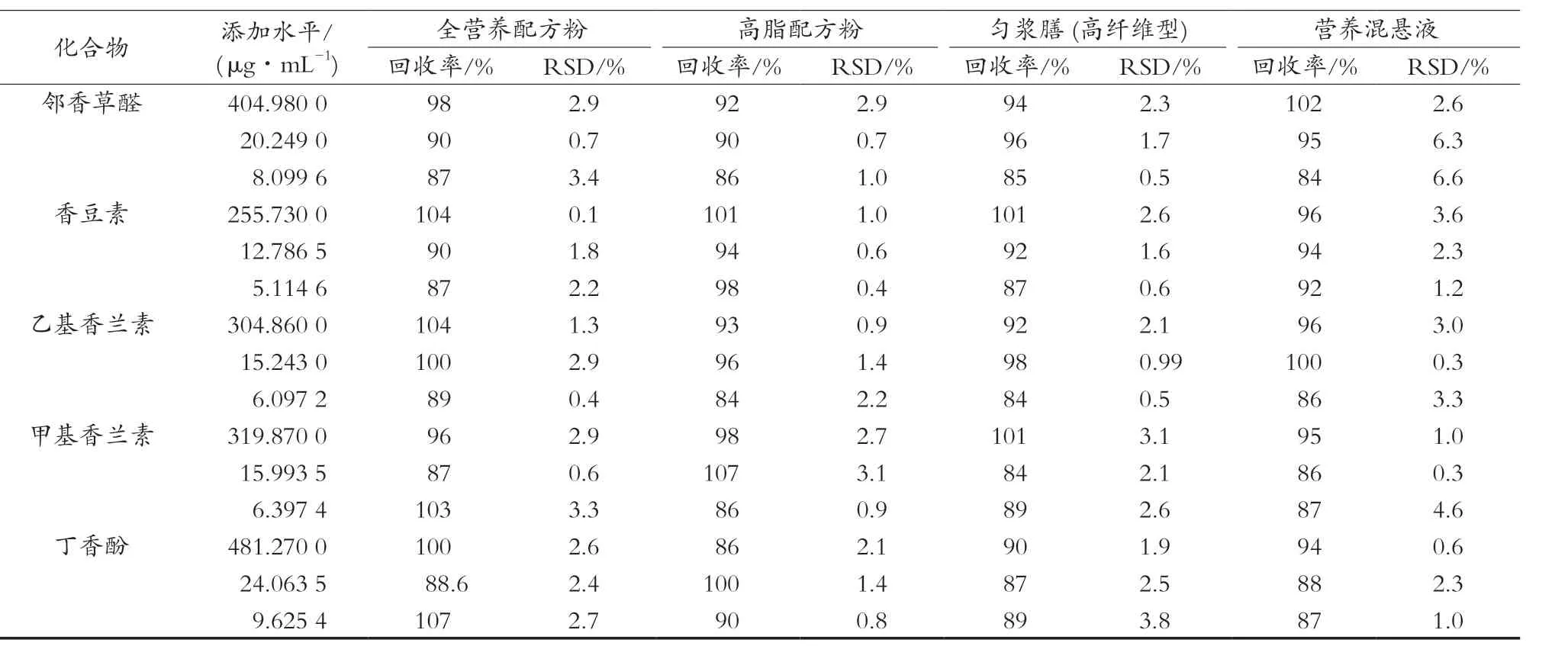
化合物 添加水平/(μg·mL-1) 全营养配方粉 高脂配方粉 匀浆膳 (高纤维型) 营养混悬液回收率/% RSD/% 回收率/% RSD/% 回收率/% RSD/% 回收率/% RSD/%邻香草醛 404.980 0 98 2.9 92 2.9 94 2.3 102 2.6 20.249 0 90 0.7 90 0.7 96 1.7 95 6.3 8.099 6 87 3.4 86 1.0 85 0.5 84 6.6香豆素 255.730 0 104 0.1 101 1.0 101 2.6 96 3.6 12.786 5 90 1.8 94 0.6 92 1.6 94 2.3 5.114 6 87 2.2 98 0.4 87 0.6 92 1.2乙基香兰素 304.860 0 104 1.3 93 0.9 92 2.1 96 3.0 15.243 0 100 2.9 96 1.4 98 0.99 100 0.3 6.097 2 89 0.4 84 2.2 84 0.5 86 3.3甲基香兰素 319.870 0 96 2.9 98 2.7 101 3.1 95 1.0 15.993 5 87 0.6 107 3.1 84 2.1 86 0.3 6.397 4 103 3.3 86 0.9 89 2.6 87 4.6丁香酚 481.270 0 100 2.6 86 2.1 90 1.9 94 0.6 24.063 5 88.6 2.4 100 1.4 87 2.5 88 2.3 9.625 4 107 2.7 90 0.8 89 3.8 87 1.0
4 结论
针对特医食品基质通过不同种固相萃取柱净化后的加标回收率考察试验,选择对特医食品基质净化效果较好的Captive EMR-Lipid(增强型脂质去除过滤柱),并结合高效液相色谱仪进行检测,DAD光谱图定位,方法具有回收率高、操作简便快速、易于批处理等优点,可用于特医食品中香兰素等11种人工合成香料的检测分析。
