印迹基因PHLDA2在孕妇子痫前期胎盘中的差异表达和甲基化状态
2021-02-01顾蔚蓉
朱 好 胡 蓉 顾蔚蓉
(复旦大学附属妇产科医院产科 上海 200011)
PLHLDA2(Pleckstrin homology-like domain,family A,member 2)是位于染色体11p15的母源性印迹基因,主要在胎盘中表达,既往研究发现PHLDA2与子代出生体重呈负相关[1-2],通过促进滋养细胞凋亡、抑制滋养细胞侵袭,在妊娠并发症的发生发展中起到重要作用[3]。本研究采用Realtime PCR和焦磷酸甲基化测序方法检测子痫前期孕妇胎盘组织中印迹基因PHLDA2的表达改变和甲基化差异,初步了解PHLDA2与子痫前期的关系。
资料和方法
研究对象 早发型子痫前期4例、晚发型子痫前期16例及正常对照组30例子代胎盘组织均来源于复旦大学附属妇产科医院2017年6月—2018年12月分娩的产妇。各组孕妇知情同意将组织进行科学研究,本研究获得复旦大学附属妇产科医院伦理委员会批准(批件号:Kyy2016-42)。
纳入标准 子痫前期组为根据《妇产科学》(第九版)[4]教材,符合子痫前期及慢性高血压并发子痫前期,系自然妊娠且无其他妊娠合并症者的胎盘组织;其中发病孕周<34周者为早发型子痫前期,发病孕周≥34周者为晚发型子痫前期。正常对照组为自然妊娠且无妊娠合并症者的胎盘组织。
排除标准 合并内科或外科的合并症,包括糖尿病、肾炎、心脏病、贫血、肝炎、妊娠期肝内胆汁淤积症、性传播性疾病,以及其他孕妇内外科疾病。合并妊娠期或分娩期的并发症,如前置胎盘、胎盘早剥、产时发热、胎儿窘迫、羊水量异常、胎儿畸形、巨大儿、胎儿贫血、胎儿先天性疾病等。
妊娠结局及新生儿情况 记录各组一般信息、分娩方式、孕龄和新生儿出生体重、Apgar评分等。
标本采集 胎盘娩出后立即无菌下留取母体面中央区胎盘组织(避开钙化区),剪去表面蜕膜组织后,留取约200 mg组织块,置冻存管中后置液氮罐中,30 min后转移至-80℃冰箱储存。
Real-time PCR取约直径5 mm冻存胎盘组织加入1 mL Trizol,充分研磨后抽提总RNA,紫外分光光度仪测定RNA纯度并计算其浓度。1%琼脂糖凝胶电泳分析其产物,确定RNA完整性。采用20 μL反转录体系,试剂盒购自Invitrogen公司。NCBI查询mRNA序列,primer3软件筛选出一对cDNA引物(苏州金唯智公司合成)。PHLDA 2上游引物序列5’-GCTTCCACTCCATCCTCAAG-3’,下游引物5’-GGTTCTGG-AAATCGATGAGC-3’,扩增片段长159 bp;GAPDH上游引物序列5’-GCGAGATCCCTCCAAAATCAA-3’,下游引物序列 5’-GTTCA-CACCCATGACGAACAT-3’,扩增片段长172 bp。使用7500 Fast Real-time PCR System,采用10μL反应体系,95℃预变性2 min,95℃变性5 s,60℃退火10 s,45个循环后反应结束,确认Realtime PCR的扩增曲线和融解曲线,进行PCR相对定量。目的基因mRNA的表达水平根据PCR扩增曲线所得CT值,以GAPDH基因为内参,比较内参基因与目的基因的CT值,得出各标本之间目的基因 表 达 量 的 多 少 。 计 算 公 式 :ΔCT=CT目的基因-CT管家基因;相对含量(%)=2-ΔΔCT×100%,其中ΔΔCT=(CT目的基因-CT管家基因)实验组-(CT目的基因-CT管家基因)对照组。
焦磷酸甲基化测序 启动子区Cp G岛引物由PyroMark Assay Design 2.0设计,由生工基因合成,所选择Cp G岛区域设计焦磷酸测序模板制备引物和测序引物。PHLDA 2上游引物序列5’-GTAATGGGTATAGTGATGTAAAAATAAGAT-3’,下游引物序列3’-CACAACTC-TCTAACCCAATCCTTTC-5’,测序引物序列 5’-ATTAGATAGTTTAATAATTTAAGG-3’。使用QIAGEN基因组DNA抽提试剂盒,从冻存胎盘组织中提取基因组DNA,计算所提取DNA含量并保存,对基因组DNA进行亚硫酸氢盐处理。应用PyroMark Q48软件对焦磷酸测序结果进行分析。
统计学分析 分析采用SPSS l7.0软件包,计数资料采用χ2及Fisher精确检验;计量资料比较采用单因素方差分析及t检验,结果用表示。
结果
临床资料 与正常对照组比较,早发型子痫前期组分娩孕周小(P<0.000)、手术助产率高(P=0.015)、新生儿出生体重低(P<0.000)、1 min低Apgar评分率高(P<0.000);晚发型子痫前期组手术助产率高(P=0.012),如表1所示。进一步比较早发型子痫前期在分娩孕周(P<0.000)、出生体重(P<0.000)、1 min低 Apgar评分发生率(P=0.003)较晚发型病情更早更重。本研究中有2例SGA均为早发型子痫前期,出生体重分别为1 650 g(35+2周)、1 720 g(36+4周),3组均无新生儿死亡。
子痫前期PHLDA2 mRNA的表达改变 用SYBR GreenⅠ荧光Real-time PCR法检测发现,晚发型子痫前期组胎盘PHLDA2的mRNA表达较对照组明显降低(P=0.019),而早发型子痫前期与晚发型、正常对照组之间差异均无统计学意义,如表2所示。
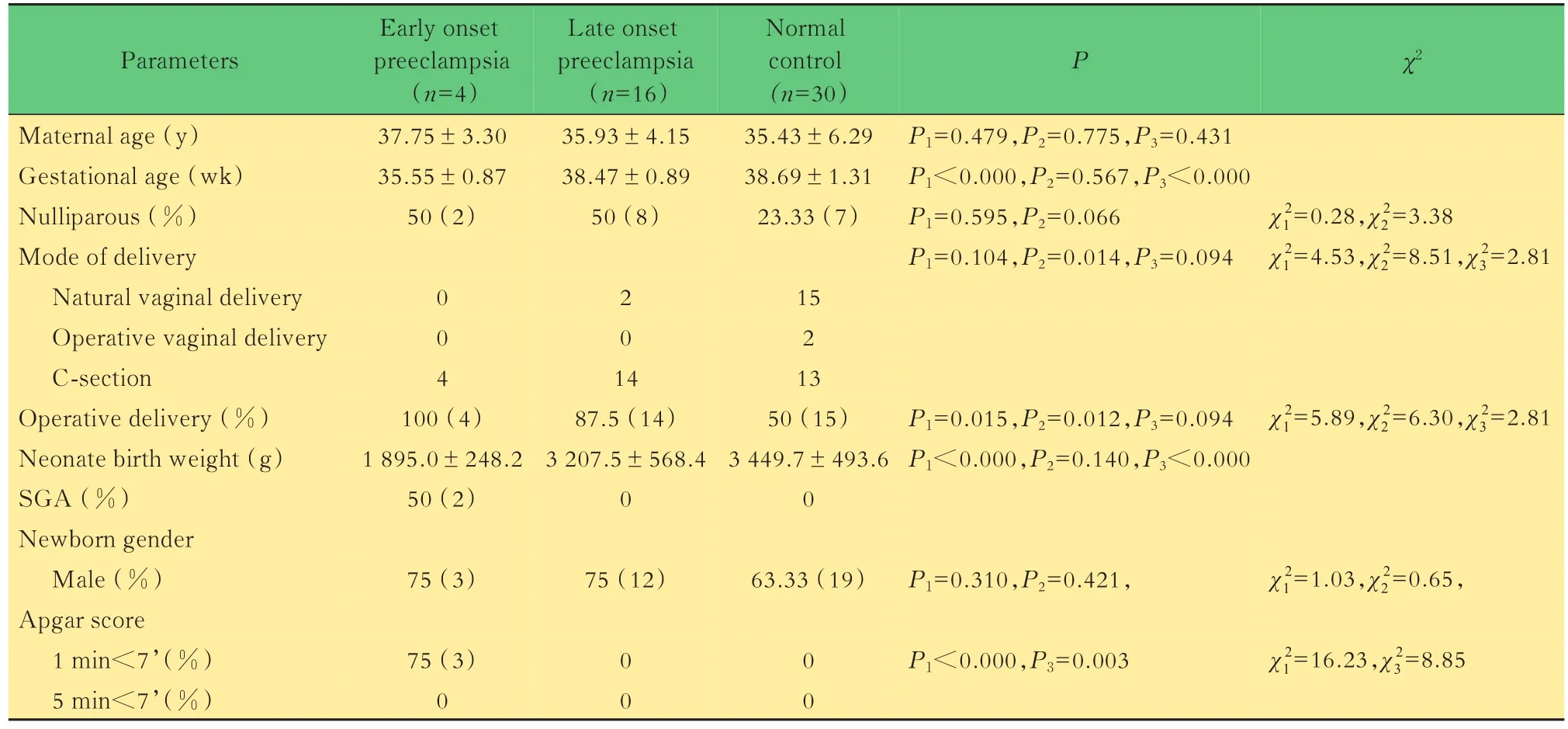
表1 早发型、晚发型子痫前期组与正常对照组临床资料的比较Tab 1 Clinical features and obstetrical outcomes among the three groups

表2 3组胎盘印迹基因PHLDA2表达差异比较Tab 2 The expression of PHLDA2 in placenta among the three groups
子痫前期PHLDA2启动子甲基化的表达改变用焦磷酸甲基化测序的方法检测发现,各组之间的胎盘组织中PHLDA2启动子区甲基化程度差异均有统计学意义(P<0.000),由高到低依次为早发型、晚发型、对照组(表3)。
讨论本研究检测了子痫前期组和正常对照组胎盘组织中PHLDA2基因表达和启动子区甲基化情况,结果显示子痫前期组胎盘组织中PHLDA2 mRNA表达降低,而启动子区呈高甲基化表达状态。这一结果在子痫前期的研究中为首次报道。
子痫前期的发病率约为7%~10%[5-6],占孕产妇死亡的 9.2%[5,7],影响围产儿结局和远期预后[8],其中早发型子痫前期发生胎盘组织病变比晚发型更常见,易导致更严重的母体及胎儿并发症[9-10],因此需要更积极的临床干预。本研究中早发型患者分娩孕周较晚发型和正常对照产妇平均提前了约3周,且均接受了剖宫产终止妊娠,分娩孕周的提前导致了新生儿出生体重较低,发生1 min低Apgar评分较多,这些结局与早发型子痫前期的病情出现更早、母儿并发症更严重相关。
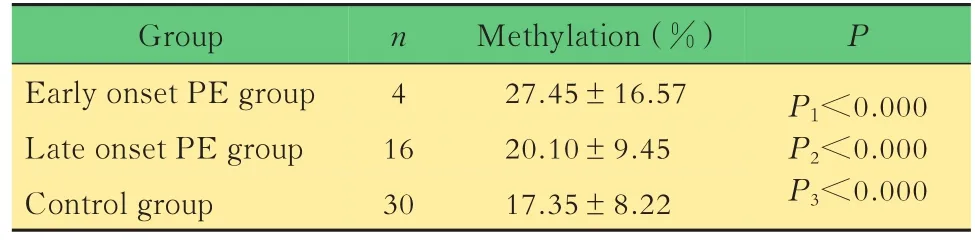
表3 3组中PHLDA2启动子区甲基化情况比较Tab 3 The methylation statue in promoter region of PHLDA2 among three groups
子痫前期胎盘娩出后临床症状和体征可自然消退,因此被认为是与胎盘密切相关的疾病,并且可能是一种与母系表达的印迹基因异常的疾病[11]。从表观遗传学角度探讨印迹基因对滋养细胞侵袭行为的调控分子机制与印迹基因中胞嘧啶甲基化尤其是Cp G岛的甲基化密切相关[12]。本研究中子痫前期孕妇PHLDA2启动子区呈高甲基化表达,提示表观遗传的改变可能是导致胎盘内PHLDA2 mRNA的表达抑制的原因,从而导致子痫前期的发生和发展。印迹基因异常表达所导致的妊娠期并发症往往还与胎盘功能异常有关,动物实验发现PHLDA2基因表达与胎儿及胎盘重量呈负相关[13-14],限制胎盘糖原累积[14]。对人类胎盘的研究中发现,高表达PHLDA2可导致滋养细胞功能下降,使胎盘功能受限,进一步导致FGR、早产、流产等妊娠并发症[1,3]。低表达PHLDA2 可导致出生体重增加和胎盘肥大[15]。本研究结果中PHLDA2 mRNA在胎盘内的表达减少与既往FGR的研究结果相反,提示晚发型子痫前期胎盘PHLDA2表达较少,也可能是缺氧导致滋养细胞侵袭力降低后的反向保护作用。
综上,本研究观察到印迹基因PHLDA2在子痫前期胎盘内的表达差异和表观遗传学改变,初步了解基因的低表达和启动子区Cp G岛高甲基化与子痫前期的关系,为子痫前期分子机制提供了依据。
作者贡献声明朱好 论文设计,数据采集和统计分析,论文撰写和修订。胡蓉 数据统计与分析,修订论文。顾蔚蓉 论文构思和修订。
利益冲突声明所有作者均声明不存在利益冲突。
