维替泊芬诱导子宫内膜癌细胞发生内质网应激及自噬相关蛋白表达
2021-02-01任晓俊
王 博 任晓俊 薛 誉 王 超△
(1复旦大学附属妇产科医院妇科 上海 200011;2上海市女性生殖内分泌相关疾病重点实验室 上海 200011)
子宫内膜癌是常见的三大女性生殖系统肿瘤之一,其发病率逐年上升[1]。子宫内膜癌的发病机制一直是妇科肿瘤领域研究的热点,但多数研究集中在子宫内膜癌PI3K/AKT/mTOR信号通路的激活及胰岛素抵抗的作用机制等方面[2-3]。而肿瘤的发生往往伴随着癌基因突变,转录、翻译过程异常,导致胞内蛋白质异常折叠并堆积,继而发生内质网应激(endoplasmic reticulum stress,ER stress)。内质网应激与子宫内膜癌细胞的凋亡、自噬等有密切联系[4-6]。内质网应激标志蛋白葡萄糖调节蛋白78(GRP78,又名 BIP蛋白)和 C/EBP同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)在子宫内膜癌患者中均明显升高[7-9],提示内质网应激在子宫内膜癌的发病机制中同样重要。维替泊芬(verteporfin)是一种用于光动力疗法(photodynamic therapy,PDT)的光敏剂,曾被证明是Hippo通路主要效应分子YAP的抑制剂,被广泛应用于肿瘤抑制相关研究[10-11]。我们前期工作首次报道维替泊芬能明显拮抗子宫内膜癌细胞生长[3],在电镜下观察到维替泊芬诱导细胞内出现自噬小体[12]。已有文献报道,内质网过度应激可诱导自噬小体产生,参与细胞的自噬和凋亡过程[13]。因此我们假设:维替泊芬通过诱导子宫内膜癌细胞发生内质网应激,促进细胞自噬和死亡,从而抑制子宫内膜癌。本研究重点验证维替泊芬诱导子宫内膜癌细胞发生内质网应激的过程,为维替泊芬的临床应用提供理论和实验基础。
资料和方法
细胞和试剂维替泊芬购自美国Sigma公司;IRE-1a、BIP、PDI、CHOP、YAP、Rab11抗体购自美国 Cell Signaling Technology(CST)公司;P53、βaction购自美国VWR International公司、Erk2抗体购自美国Santa Cruz Biotechnology公司;子宫内膜癌细胞株既往获赠于美国安德森癌症中心系统生物学Dr.Mills实验室。根据前期研究工作[3]和文献报道,实验组中维替泊芬的浓度设定为0.1、0.15、0.3、1、2.5、3、5、10 μmol/L。
细胞培养选用前期研究工作中使用的4种人子宫内膜癌细胞株 KLE、EFE184、NOU-1和SKUT-2[2-3,12]。上述细胞均 培养于含有 5% 的胎牛血清中,分别用 DMEM/F12、RPMI1640、DMEM培养液进行培养,细胞放置在37℃、5%CO2培养箱中,取对数生长期细胞进行后续实验。所有细胞系在分发前都通过了美国安德森癌症中心细胞库短串联重复序列(short tandem repeat,STR)的鉴定,每个细胞系平均6个月重复鉴定STR。
细胞增殖能力测定取对数期生长的人子宫内膜癌细胞接种于96孔板上,每孔100μL,孵育24 h,待细胞贴壁后加入不同浓度的维替泊芬(0.15、2.5、3、5、10 μmol/L),分别培养不同时间(12、16、24 h),处理后的细胞于4℃下在96孔板中用10%三氯乙酸(trichloroacetic acid,TCA)固定1 h,去离子水洗涤并在室温下风干。然后每孔加入1%乙酸溶液与0.4% 磺酰罗丹明B(sulforhodamine B,SRB),并在室温下孵育30 min;然后用1%乙酸洗涤并在室温下风干。使用100~200μL的10 mmol/L非缓冲Tris碱溶液(pH=10.5)溶解已结合的SRB。用自动酶标仪测量540~560 nm波长的吸光度值(D)。所有实验均进行3次。
Western blot实验收集处理后的细胞,使用4℃PBS洗涤2次,在RIPA裂解液(美国Santa Cruz Biotechnology公司)中裂解。将得到的悬浮液在4℃、14 000 r/min离心10 min(有效离心半径为15 cm)。收集上清液,用试剂盒(美国Thermo Scientific公司)测定蛋白质浓度。将细胞裂解液与6×SDS样品缓冲液在100℃孵育5 min,行SDSPAGE,转移至膜上,用适当的一抗和二抗探测。通过增强型化学发光(enhanced chemilumine-scence,ECL)技术(美国GE Healthcare公司)检测蛋白质条带。
免疫荧光显微镜将细胞在4%多聚甲醛中固定10 min,在冰上用含有0.3%Triton X-100的PBS溶液渗透2 min。室温下用1%牛血清白蛋白封闭1 h后,使用一抗(1∶1 000),4℃下细胞染色过夜。PBS洗涤3次,将细胞与适当的二抗(1∶2 500)在室温下孵育1 h。PBS洗涤3次,将载玻片用抗褪色试剂、内质网应激示踪剂(绿色)和DAPI(蓝色)固定。
统计学分析通过双侧方差分析和Sidak多重比较检验得出统计显著性(除非另有说明),通过在多个相关细胞系中重复研究来支持结果的准确性和通用性。对照标准化为1,除非另有说明,否则统计量代表3个独立实验的x±s,每个实验重复3次。P<0.05为差异具有统计学意义。
结 果
蛋白酶抑制剂MG132和硼替佐米对子宫内膜癌细胞形态学及增殖的影响使用文献常用的蛋白酶抑制剂MG132和硼替佐米[14-17]处理子宫内膜癌细胞系KLE和EFE184。结果显示,细胞出现肿胀,胞内空泡样结构增多,随着药物处理时间的延长,细胞死亡增加,其中EFE184细胞变化更明显(图1A和1B)。细胞增殖实验显示,MG132处理KLE和EFE184细胞12 h和24 h后,细胞增殖活力下降(图2A)。硼替佐米处理后,EFE184和KLE细胞增殖活力也下降,而且随着药物作用时间的增加,增殖活性下降越明显(图2B)。
维替泊芬对子宫内膜癌细胞形态学及增殖的影响在活细胞成像系统中每隔4 h连续观察2种光敏剂维替泊芬(0.1μmol/L,12 h)和原卟啉(0.1μmol/L,12 h)对子宫内膜癌细胞EFE184形态的影响。发现维替泊芬同样引起细胞发生类似蛋白酶抑制剂作用后的细胞形态学改变,即细胞出现肿胀,胞内空泡样结构增多,随着药物处理时间的延长,细胞死亡增加。但原卟啉对细胞无此作用(图3)。
蛋白酶抑制剂MG132和硼替佐米上调内膜癌细胞内质网应激相关蛋白表达Western blot实验中,使用蛋白酶抑制剂MG132(10μmol/L)和硼替佐米(1μmol/L)作用KLE和EFE184细胞12 h后,钙敏感伴侣蛋白BIP和C/EBP同源蛋白CHOP水平均增加(图4A、4B)。随着作用时间的增加,MG132引起细胞内BIP和CHOP蛋白进一步增加(图4A),但硼替佐米无此作用。而且,当MG132仅作用6 h时,对 IRE-1a、BIP、PDI蛋白水平的影响不明显(图5A)。
维替泊芬对内膜癌细胞内质网应激相关蛋白的影响Western blot实验中,使用维替泊芬(10μmol/L)作用6 h后,KLE和EFE184细胞系中肌醇酶蛋白IRE-1a减少,钙敏感伴侣蛋白BIP增加,C/EBP同源蛋白CHOP水平未见增加,蛋白质二硫键异构酶 PDI降低,但 MG132(10 μmol/L)作用6 h后无类似作用(图5A)。降低维替泊芬的浓度(3μmol/L),增加作用时间至24 h后,发现在4种子宫内膜癌细胞系中CHOP的水平均增高(图5B)。
维替泊芬对内膜癌细胞内质网应激相关蛋白的影响呈浓度依赖性KLE和EFE184细胞系经不同浓度维替泊芬(0.15、2.5、5、10 μmol/L)处理 24 h后诱导内质网应激的作用与浓度有关。维替泊芬浓度越高,内质网应激相关蛋白肌醇酶IRE-1a和蛋白质二硫键异构酶(protein disulfide isomerase,PDI)降低越明显(图6A)。当维替泊芬浓度为0~5μmol/L时,随着浓度升高,增强子结合蛋白同源蛋白CHOP显影逐渐明显,BIP蛋白质水平也随之增加。而当维替泊芬增加至10μmol/L后,CHOP相对表达量下降,而BIP蛋白质相对水平仍增加。此外,还发现抑癌基因产物p53增加,抑癌通路效应蛋白(Yes-associated protein,YAP)减少(图6B)。
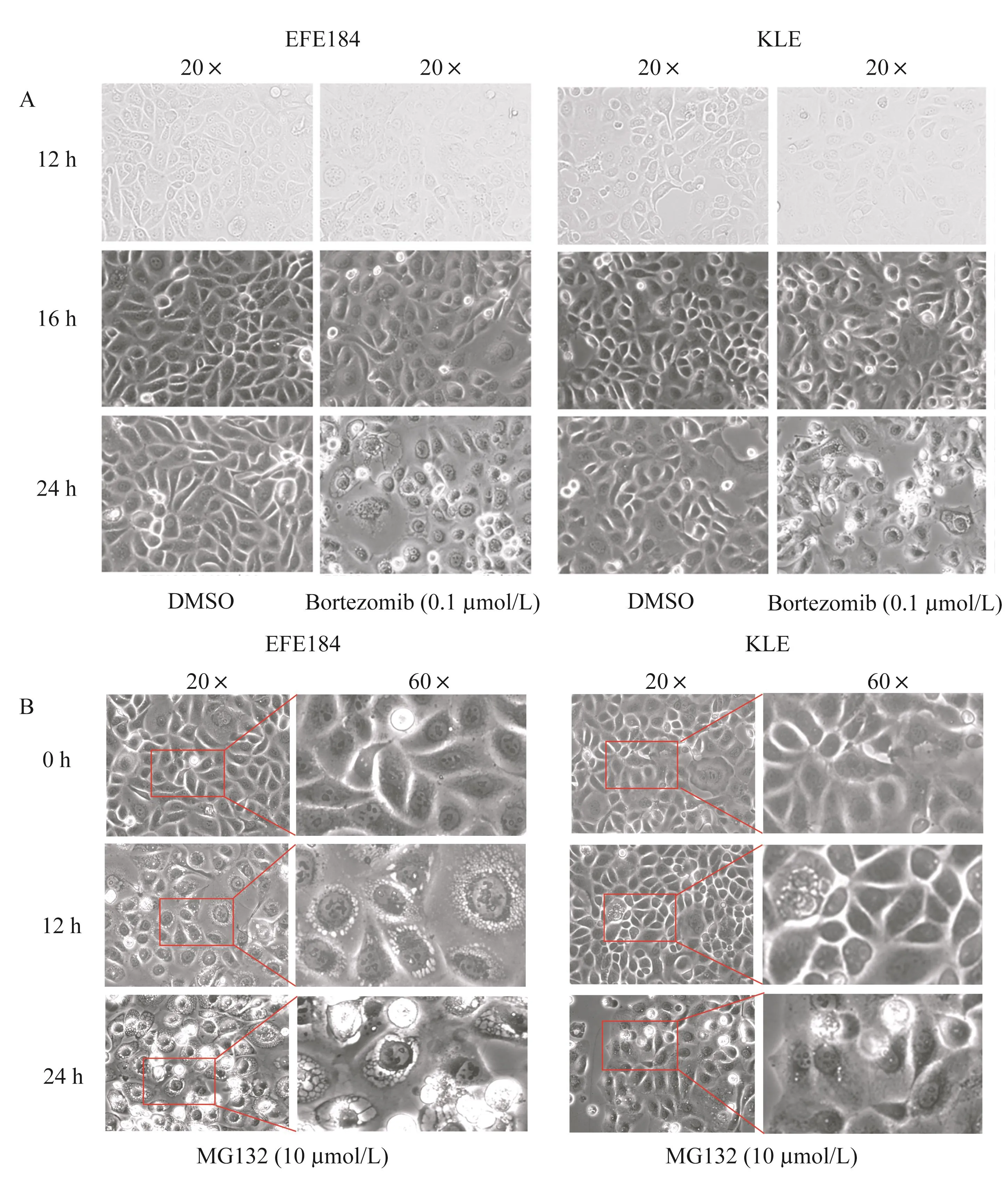
图1 蛋白酶抑制剂MG132和硼替佐米导致子宫内膜癌细胞系EFE184和KLE的形态学改变(光镜)Fig 1 Proteasome inhibitors MG132 and bortezomib induced morphological changesin endometrial cancer cell lines EFE184 and KLE(light microscope)
硼替佐米和维替泊芬均促进子宫内膜癌细胞发生内质网应激使用硼替佐米(1μmol/L)和维替泊芬(3μmol/L)处理细胞24 h后,在细胞免疫荧光实验中发现细胞质中出现绿色的内质网应激示踪剂,提示细胞质内发生内质网应激(图7A)。此外,维替泊芬作用后细胞质溶酶体生成增多,融合荧光图像后发现内质网应激(绿色荧光)和溶酶体(红色荧光)的定位重合(图7B)。
维替泊芬促进子宫内膜癌细胞中溶酶体的形成维替泊芬(3μmol/L,24 h)处理后,子宫内膜癌细胞系EFE184、NOU-1、SKUT-2中膜循环关键蛋白Rab11水平降低(图8A);在细胞免疫荧光实验中发现EFE184在3μmol/L维替泊芬处理12 h和24 h后发生了细胞核形态的皱缩(蓝色荧光)以及溶酶体的生成增多(红色荧光,图8B)。
讨 论
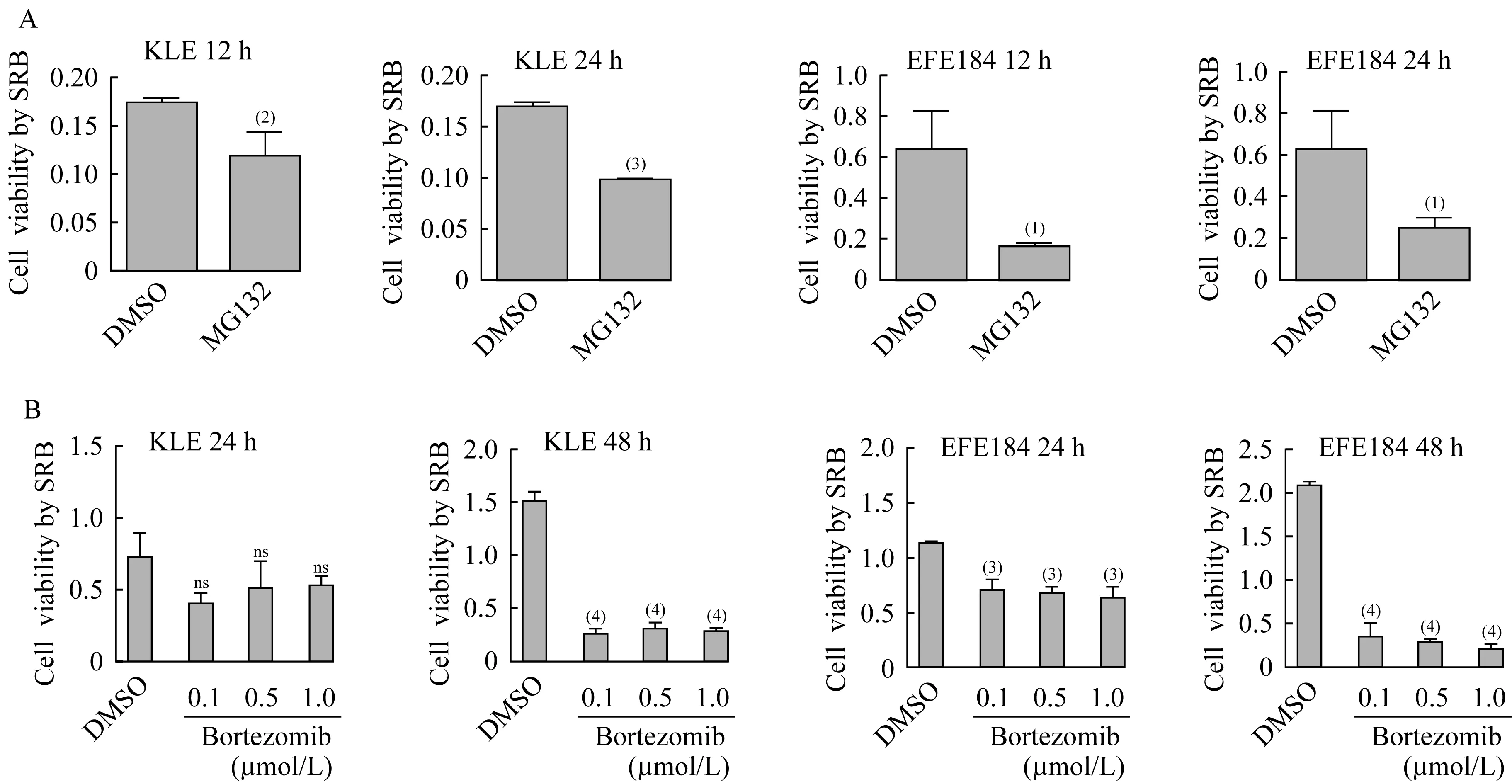
图2 蛋白酶抑制剂MG132和硼替佐米抑制子宫内膜癌细胞系KLE和EFE184增殖Fig 2 Proteasome inhibitors MG132 and bortezomib inhibited the proliferation of endometrial cancer cell lines KLE and EFE184

图3 光敏剂维替泊芬和原卟啉作用下子宫内膜癌细胞系EFE184的形态学改变Fig 3 Morphological changes of endometrial carcinoma cell line EFE184 under the treatment of photosensitizers verteporfin and protoporphyrin
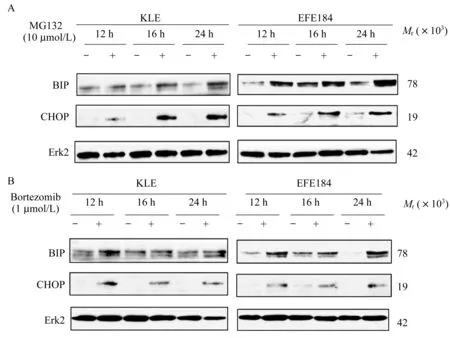
图4 蛋白酶体抑制剂MG132和硼替佐米对子宫内膜癌细胞系KLE和EFE184内质网应激相关蛋白表达的影响Fig 4 Effect of proteasome inhibitors MG132 and bortezomib on the expression of ER stress-related proteins in endometrial cancer cells KLE and EFE184
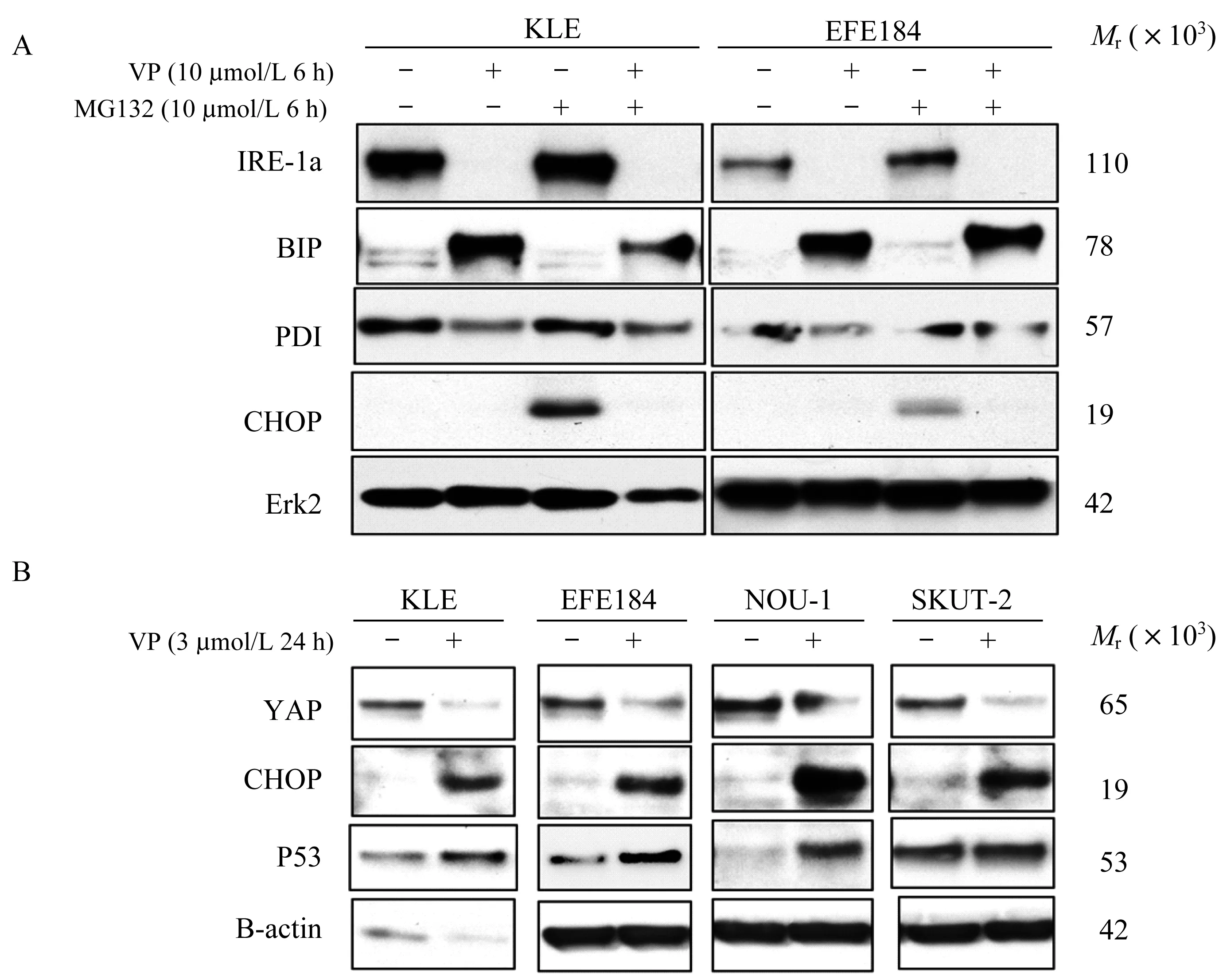
图5 维替泊芬改变4种子宫内膜癌细胞系中内质网应激相关蛋白表达Fig 5 Verteporfin affected expression of ER stress-related proteins in 4 types of endometrial cancer cells
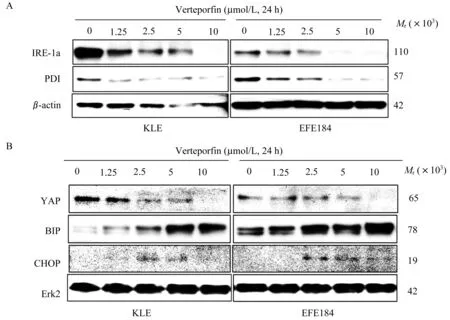
图6 维替泊芬诱导子宫内膜癌细胞系KLE和EFE184内质网应激具有浓度依赖性Fig 6 Verteporfin induced ER stressin endometrial cancer cell lines KLE and EFE184 in a concentration dependent manner
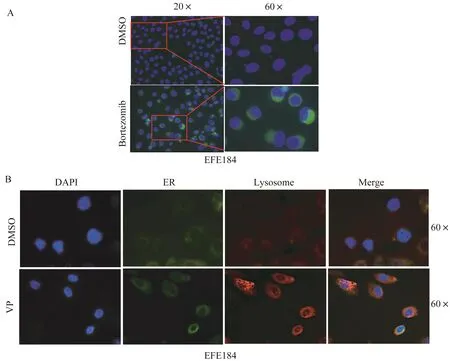
图7 硼替佐米和维替泊芬诱导子宫内膜癌细胞系EFE184内质网应激和溶酶体生成Fig 7 Bortezomib and verteporfin induced ER stress and lysosomes formation in endometrial cancer cell line EFE184
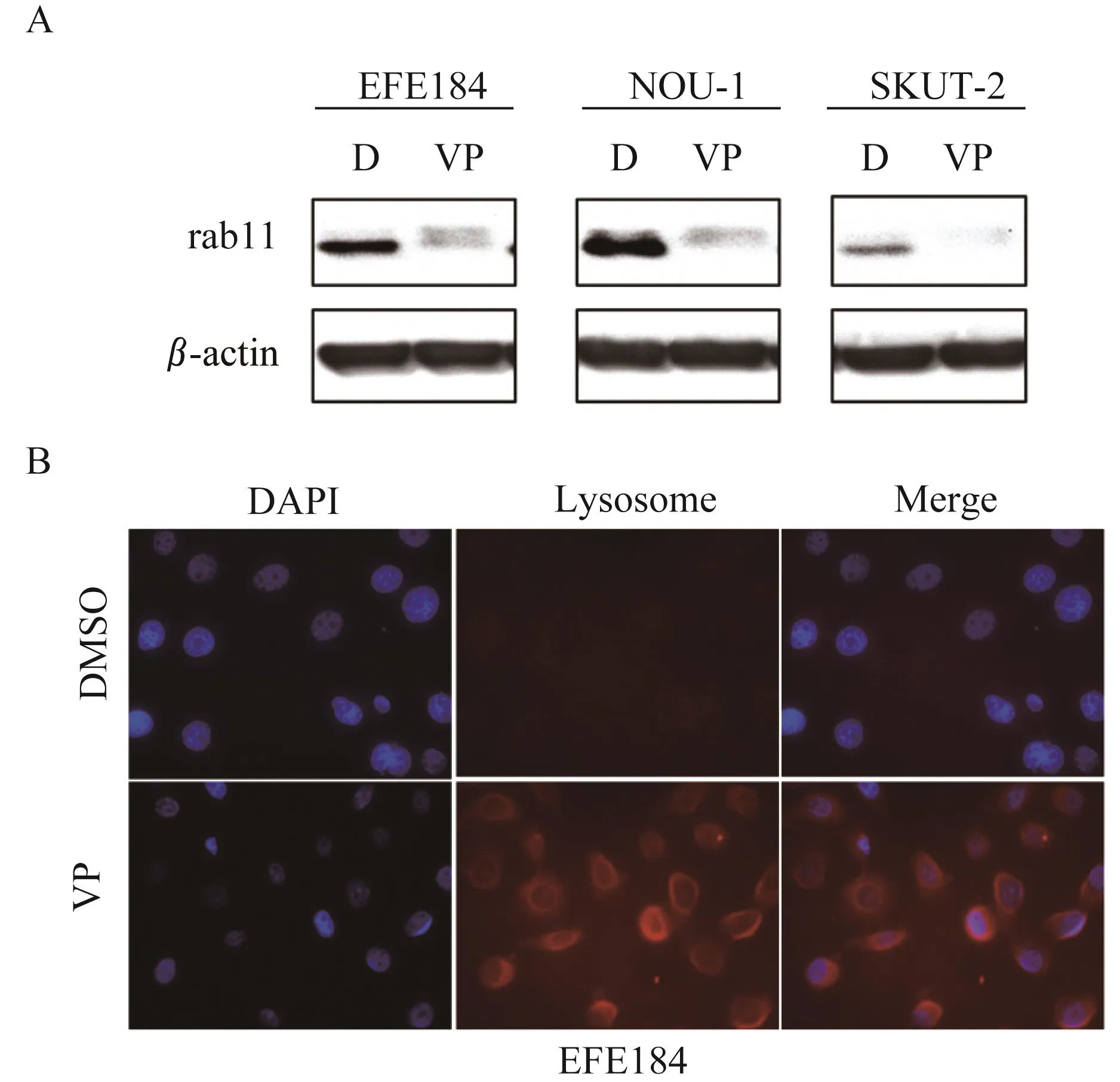
图8 维替泊芬诱导子宫内膜癌细胞内溶酶体形成Fig 8 Verteporfin induced the formation of lysosomes in endometrial cancer cells
肿瘤细胞存在营养缺乏、氧气受限、代谢需求高和氧化应激等病理情况,会干扰胞内蛋白质的折叠能力,从而引起内质网应激。子宫内膜癌细胞同其他肿瘤细胞一样,存在内质网应激。在子宫内膜癌患者中内质网应激标志物BIP和CHOP含量明显升高。部分药物作用于内质网应激通路,可抑制子宫内膜癌细胞的发生发展。药物雄黄通过内质网应激信号通路使得BIP蛋白质水平增加,以浓度依赖的方式诱导子宫内膜癌JEC细胞发生空泡化和内质网扩张,诱导细胞凋亡和坏死[6]。药物维替泊芬通常用于PDT,在多种肿瘤中被证实具有抑瘤作用,但具体机制尚不明了。我们前期研究发现维替泊芬通过抑制YAP功能,从而抑制子宫内膜癌细胞的增殖和侵袭。有研究报道维替泊芬引起细胞内发生小囊样改变,在内质网应激中与蛋白酶体抑制剂具有相同的细胞毒性作用[18]。我们最新的研究发现维替泊芬引起子宫内膜癌细胞出现肿胀,细胞内囊泡样结构增多。电镜和Western blot证实维替泊芬诱导的囊泡样结构正是自噬小体[12]。因此推测维替泊芬可以通过诱导内质网应激,促进细胞自噬和凋亡,从而对子宫内膜癌产生抑制作用。
内质网应激途径由3种信号蛋白组成:肌醇蛋白-1a(IRE-1a),蛋白激酶 RNA样内质网激酶(RNA-activated protein kinase-like endoplasmic reticulum kinase,PERK)和激活转录因子 6(activating transcription factor 6,ATF6)[19-21]。 BIP蛋白作为内质网应激伴侣蛋白,可结合ATF6并响应内质网应激而解离,导致细胞中BIP蛋白质水平增加[19]。在真核内质网中,蛋白质二硫键异构酶(PDI)可在蛋白质折叠过程中催化适当的二硫键形成[22],IRE-1a可以将信号从内质网传递到细胞质,从而进行细胞间沟通交流。病理情况下,蛋白折叠功能受损,触发未折叠蛋白反应,造成内质网应激状态,可在一定程度上维持细胞稳态。如果外界刺激超过细胞平衡限度,细胞可能发生自噬和凋亡[13]。我们的结果与之相符:子宫内膜癌细胞中加入10μmol/L维替泊芬6 h后,IRE-1a蛋白质水平明显下降,BIP蛋白质水平明显上升,提示维替泊芬激活IRE-1a的同时促进BIP蛋白的解离。维替泊芬在相对低浓度和长时间作用时(3μmol/L,24 h)通过改变内质网应激信号蛋白BIP、IRE-1a和CHOP,引发细胞的保护性自噬(图5B),促进P53增加,YAP蛋白质水平降低,诱发细胞凋亡。在相对高浓度和短时间作用时(10μmol/L,6 h),内质网维持稳态的作用被破坏,导致CHOP消失(图5A),细胞死亡。表明在一定程度刺激下,内质网应激能够维持细胞中蛋白信号的稳定,而过度的刺激会导致细胞状态不佳甚至死亡。我们在活细胞成像系统下发现维替泊芬在更低浓度(0.1μmol/L,8 h)时也能促进细胞死亡(图3)。这种与浓度和时间改变相关的内质网应激蛋白的改变,提示临床应选择合理的药物浓度和作用时间,遵循安全、有效的原则。我们还发现,尽管维替泊芬、MG132和硼替佐米均增加了细胞内BIP、CHOP的蛋白质水平,但是其对IRE-1a和PDI蛋白质水平的影响并不相同,提示其诱导细胞内质网应激的早期机制可能并不相同,有待进一步研究。
内质网应激介导的自噬的特征是自噬小体的产生,当细胞稳态被破坏,与内质网应激相关的自噬小体、溶酶体间接导致细胞的死亡。这个现象与我们此前发表的研究一致[12],即在维替泊芬作用下自噬相关的LC3蛋白质增加。部分自噬小体外层双层脂膜来自内质网,其中Rab11蛋白作为关键分子参与调节循环内体的形成和运输。本研究发现在维替泊芬的作用下Rab11蛋白质水平降低,间接证实了维替泊芬诱导自噬小体产生,促进受体和脂质的再循环,加速Rab11蛋白质的耗竭。
本研究证实了维替泊芬在多种子宫内膜癌细胞系中诱导内质网应激,小剂量维替泊芬持续作用一定时间促进细胞发生保护性自噬和凋亡,而大剂量维替泊芬则引发细胞死亡的过程,其引起细胞凋亡或死亡受细胞密度的影响。本研究不足之处在于实验未涉及维替泊芬在动物体内的机制验证、药理学作用、不良反应等,有待进一步研究,以帮助确定维替泊芬在体内的合理作用浓度和时间。本研究为今后进行临床试验甚至临床应用提供了前期基础。
作者贡献声明王博 文献调研与整理,数据分析,论文撰写。任晓俊 文献调研与整理,论文修订。薛誉 论文修订。王超 构思与设计,数据分析,获取资助,监督指导,论文修订。
利益冲突声明所有作者均声明不存在利益冲突。
