TMEM16A对衰老耳蜗血管纹周细胞凋亡的作用
2021-02-01李雪蕊冯子奕陈龙徐少然邓双马克涛司军强李丽
李雪蕊冯子奕陈龙徐少然邓双马克涛司军强李丽
1石河子大学医学院生理学教研室/新疆地方与民族高发病教育部重点实验室(石河子 832000)
2嘉兴学院医学院生理学教研室(嘉兴 314000)
衰老是任何生命发展过程中不可避免的自然过程。随着年龄增长,人体各个器官会出现老化,进而出现相应的功能改变。随着人口老龄化,老年性耳聋的患者也越来越多[1]。老年性耳聋是由加速的内耳细胞凋亡导致的一种退行性疾病。研究发现,老年C57BL/6J小鼠[2]和基因缺陷NOD.NONH2nb1/LtJ小鼠[3]中均发现血管纹毛细血管有一定程度的缺失,且老年动物的耳蜗血管纹毛细血管周细胞(Pericytes,PCs)分布密度明显降低[2]。钙激活氯通道(calcium-activated chloride channels,CaCCs)是一类具有重要生理功能的离子通道,分布非常广泛[4],在很多类型的细胞均有表达[5]。跨膜蛋白16A(TMEM16A)是CaCCs的主要组成蛋白[6,7]。有研究发现TMEM16A可以通过线粒体途径促进脑基底动脉平滑肌细胞(BASMCs)的凋亡[8]。本课题组前期研究发现耳蜗血管纹PCs具有平滑肌电生理特性[9],且豚鼠耳蜗血管纹PCs上广泛表达TMEM16A,但TMEM16A在耳蜗血管纹PCs的功能意义还不清楚。本研究通过原代培养耳蜗血管纹PCs,研究耳蜗血管纹PCs衰老过程中TMEM16A的变化,以及TMEM16A对衰老耳蜗血管纹PCs凋亡的影响,从而为CaCCs是否参与豚鼠老龄化过程中耳蜗血管纹PCs的凋亡提供一定的实验依据。
1 材料与方法
1.1 材料
实验动物2周龄左右新生豚鼠,雌雄不拘,体重150-200 g,购自新疆医科大学实验动物中心(动物使用许可证批号SCXK new 2003-0001),质量符合一级标准,本研究中动物的使用已获得石河子大学医学院附属第一医院动物实验伦理委员会的批准(许可证号A2017-168-01)。
1.2 方法
1.2.1 原代培养
2周龄新生豚鼠4-5只,100 mL/L戊巴比妥钠(上海生工,武汉)麻醉后断头处死,无菌条件下剪取颞骨,将其浸于4℃D-Hanks液(博士德生物公司),在显微镜下去除多余骨质,打开听泡,分离蜗壁暴露蜗轴,再以显微镊撕下整个血管纹连同螺旋韧带组织,仔细分离出血管纹,剪碎血管纹组织块。在3.5 cm培养皿中加入700 μl的周细胞选择培养基:改良的DMEM低糖培养基(DMEM low glucose,Invitrogen,USA),10%胎牛血清(FBS,Sigma,USA),0.1%Pigment epithelium-derived factor(PEDF,Sigma,USA)和1%双抗(青霉素/链霉素,Sigma,USA))。然后将组织块平展均匀的摆好在培养皿中,于37℃、5%CO2/95%空气的恒温培养箱中培养。24 h后去除未贴壁的细胞和杂质,并小心加入1 ml完全培养液。以后每天观察培养液的颜色、外观和组织块的颜色,以及细胞生长状况。1周换液2~3次,10~14天后可通过消化传代纯化周细胞。
1.2.2 细胞鉴定
应用倒置相差显微镜观察并拍照记录细胞的大小、形态及生长方式等。选取第5代的细胞种植到放有玻片的6孔板进行细胞爬片,2天后弃培养基,用37℃预温的PBS洗3次,2 min/次。4%的多聚甲醛固定15 min,PBS洗3次,2 min/次,之后2%Triton-x-100透化细胞3 min,PBS洗3次,2min/次。5%BSA 37℃温箱封闭30 min,弃封闭液,分别加入周细胞特异性标记物anti-desmin(Abcam公司,英国)和α-SM-actin(Abcam公司,英国),内皮细胞标记物vWF(Abcam公司,英国)一抗,置于湿盒中,4℃过夜。次日,37℃复温30 min,PBS洗3次,2min/次。暗室中加相应二抗,37℃恒温箱中孵育1 h,PBS洗3次,2 min/次,DAPI染核,用抗荧光淬灭剂封片,应用激光共聚焦显微镜采像,分析实验结果。
1.2.3 β-半乳糖苷酶染色确定细胞衰老模型
选取第5代、第9代和第13代的细胞分别均匀铺板置6孔板内培养24 h后,吸弃培养基,用PBS洗涤1次,每孔加入1 mL的β-半乳糖苷酶染色固定液(碧云天公司,上海),室温固定15 min后,吸弃培养基,用PBS洗3次,3 min/次,吸弃PBS,根据制造商的说明配置SA-β-Gal染色液,每孔加入1 mL染色工作液。用保鲜膜封住6孔板置于37℃恒温箱中孵育过夜后,普通光学显微镜下观察、拍照,分析实验结果。
1.2.4 免疫荧光检测TMEM16A的表达
选取第5代、第13代的细胞接种到放有玻片的培养皿,细胞爬片2天。步骤同前面耳蜗血管纹PCs免疫荧光鉴定。加入TMEM16A一抗(Abcam公司,英国),置于湿盒中,4℃冰箱过夜。次日,暗室中加相应二抗,DAPI染核,抗荧光淬灭剂封片,应用激光共聚焦显微镜采像,分析实验结果。
1.2.5 CCK-8确定:TMEM16A阻断剂T16Ainh-A01合适干预浓度
取对数生长期的PCs,以1~2×104/mL的密度接种于96孔板中培养24 h,细胞贴壁后更换为无血清培养液培养24 h。后将细胞分为对照组和T16Ainh-A01干预组(分别加入 10、20、30、50 μmol/L T16Ainh-A01),处理24 h后将10 μl CCK-8试剂(碧云天公司,上海)加入各孔中2 h,并使用酶标仪(Bio-Tek,Winooski,VT,USA)测量450 nm处的吸光度。分析结果计算细胞活力。
1.2.6 膜片钳记录PCs上CaCCs激活电流
将细胞培养皿放置在膜片钳显微镜载物台上,100倍镜下选取膜表面光滑,整体透亮的状态良好的PCs作为实验对象。选用Sutter Instrument公司生产的带芯的硼硅酸盐玻璃毛坯,使用P-2000电极拉制仪(Axon,美国)拉制成微电极,记录电极尖端直径约1 μm,电极阻抗约6~8 MΩ。电极内液包含(以 mM 计):CsCl 139,MgCl2121,HEPES 10,Na2ATP 3,用CsOH将pH值调节至pH 7.35左右。细胞外溶液包含(以mM计):NaCl 130,四乙基铵(TEA)-Cl 5.5,CaCl22.2,MgCl21,HEPES 10,葡萄糖10,用NaOH将pH值调节到7.35左右。加入TEA阻断钙激活钾离子通道电流,加入Na2ATP阻断ATP敏感钾离子通道电流。通过微操纵器使电极尖端接触到细胞后,给予负压形成G欧封接,补偿电极电容后,给予瞬时较强负压或者电刺激击破细胞膜形成全细胞膜片钳记录模式。在电压钳模式下(钳制电压-40 mV),阶跃电压20 mV,持续时间250 ms,记录膜电容(Membrane Capacity,Cinput),膜电阻(Membrane resistance,Rinput)用以测量并计算细胞的静息电位(Resting Potential,RP)和电流密度(Current Density,CD)。并观察用排药管给予T16Ainh-A01后电流的变化。记录的信号经MultiClamp 700B放大器(Axon,美国)放大,给予10 kHz的滤波,并由Digidata 1550A数模/模数转换器(Axon,美国)转换,采样频率为10~20 kHz。
1.2.7 Western Blot检测TMEM16A、Caspase-3、Bax和Bcl-2蛋白
取原代培养的PCs接种到六孔板,加入蛋白裂解液,12000 r/min,4℃离心10 min,取上清,测定蛋白质浓度。加入上样缓冲液后煮沸变性,冷却后冻存备用。取变性蛋白样品进行电泳,电泳结束后将分离好的蛋白条带转移至PVDF膜。用50 g/L牛奶室温封闭2 h,然后加入抗体4℃过夜。第二天TBST缓冲液漂洗,加入二抗,室温孵育1 h。TBST洗膜。于暗室中滴加发光试剂,压片,曝光,显影,定影,采集图像后分析各组PCs中TMEM16A、Caspase-3、Bax和Bcl-2的蛋白相对含量。
1.2.8 流式细胞术检测各组细胞凋亡率
细胞按每孔4×105个的密度接种到六孔板内,培养过夜后,给与相应药物干预,次日收集细胞,1000rpm离心5min,预冷的PBS洗涤2遍,每个待测样本管加入500μl Binding Buffer重悬细胞,分别加入5μl Annexin V-FITC和10μl PI Staining Solution,混匀后,避光孵育30分钟,将重悬后的液体转移至流式上样管内;流式上机检测。
1.2.9 统计学分析
采用SPSS 22.0软件分析,数据以()表示,两独立样本之间均数的比较使用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 原代培养PCs并鉴定
光镜下,细胞培养至第5天可见培养皿内组织块贴壁,细胞由组织边缘长出,细胞呈长梭形或不规则形,细胞核圆(图1)。第8~10天可见细胞增殖,呈典型"铺路石样"排列,大约2周可长满培养皿,并进行首次传代。反复传代纯化细胞至第5代,用PCs特异性标记物anti-desmin和α-SM-actin,内皮细胞标记物vWF进行细胞免疫荧光染色,结果显示原代培养的细胞desmin和α-SM-actin表达阳性(图2A,B),内皮细胞标记物vWF表达阴性(图2C),表明原代培养出较纯的PCs。

图1 原代培养耳蜗血管纹PCs:倒置显微镜(×400)A:第1天,耳蜗血管纹组织碎片贴壁;B:第5天,耳蜗血管纹组织碎片周围出现细胞簇;C:第10天,细胞扩散到整个培养皿。Fig.1 Primary culture of PCs:Inverted microscope(×400)A:The adherence of the cochlear stria vascular tissue fragments by day 1.B:Cells had begun to grow out from the cochlear stria vascular tissue fragments by day 5.C:The cells spread throughout the culture dish by day 10.
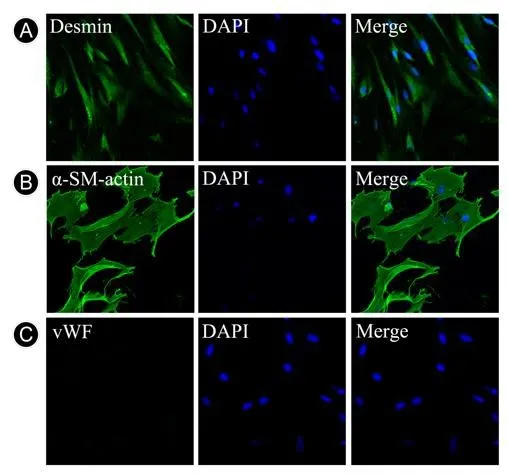
图2 原代耳蜗血管纹PCs鉴定:荧光倒置显微镜(×400)A:desmin表达阳性(绿色);B:α-SM-actin表达阳性(绿色);C:vWF表达阴性Fig.2 The PCs in the Cochlea StriaⅤascularis were identified:Fluorescence inverted microscope(×400)A:The expression of desmin was positive(green).B:The expression of α-SM-actin was positive(green).C:The expression of vWF was negative.
2.2 细胞衰老模型制备
选连续传代到第5、第9和第13代的细胞均匀铺置在6孔板内,β-半乳糖苷酶染色结果显示(图3),第9代细胞β-半乳糖苷酶染色的蓝色阳性颗粒较第5代细胞稍有增多(t=3.005,*P<0.05),第13代细胞β-半乳糖苷酶蓝染的阳性颗粒较第5代细胞明显增多(t=13.57,***P<0.001),表明PCs培养至第13代出现衰老。

图3 β-半乳糖苷酶染色:图A,C,E分别为第5,第9和第13代PCs的染色代表图(×100);图B,D,F分别第5,第9和第13代PCs染色代表图(×400)。G:染色阳性细胞的百分率。Fig.3 PCs are stained with β-Galactosidase.A,C and E:Representative pictures of P5,P9 and P13 PCs(×100).B,D and F:Representative pictures of P5,P9 and P13 PCs(×400).G:Percentage of positively stained P5,P9 and P13 PCs.
2.3 免疫荧光和Western Blot技术检测PCs上TMEM16A表达变化
免疫荧光结果显示:TMEM16A表达分布位置(如图4 A,D)。衰老组(第13代)PCs较年轻组(第5代)PCs上TMEM16A荧光强度明显增多(t=5.102,**P< 0.01)(如图 4 G)。Western Blot结果显示:衰老组(第13代)PCs较年轻组(第5代)PCs上TMEM16A蛋白表达量明显增多(t=5.989,**P<0.01)(图5)。
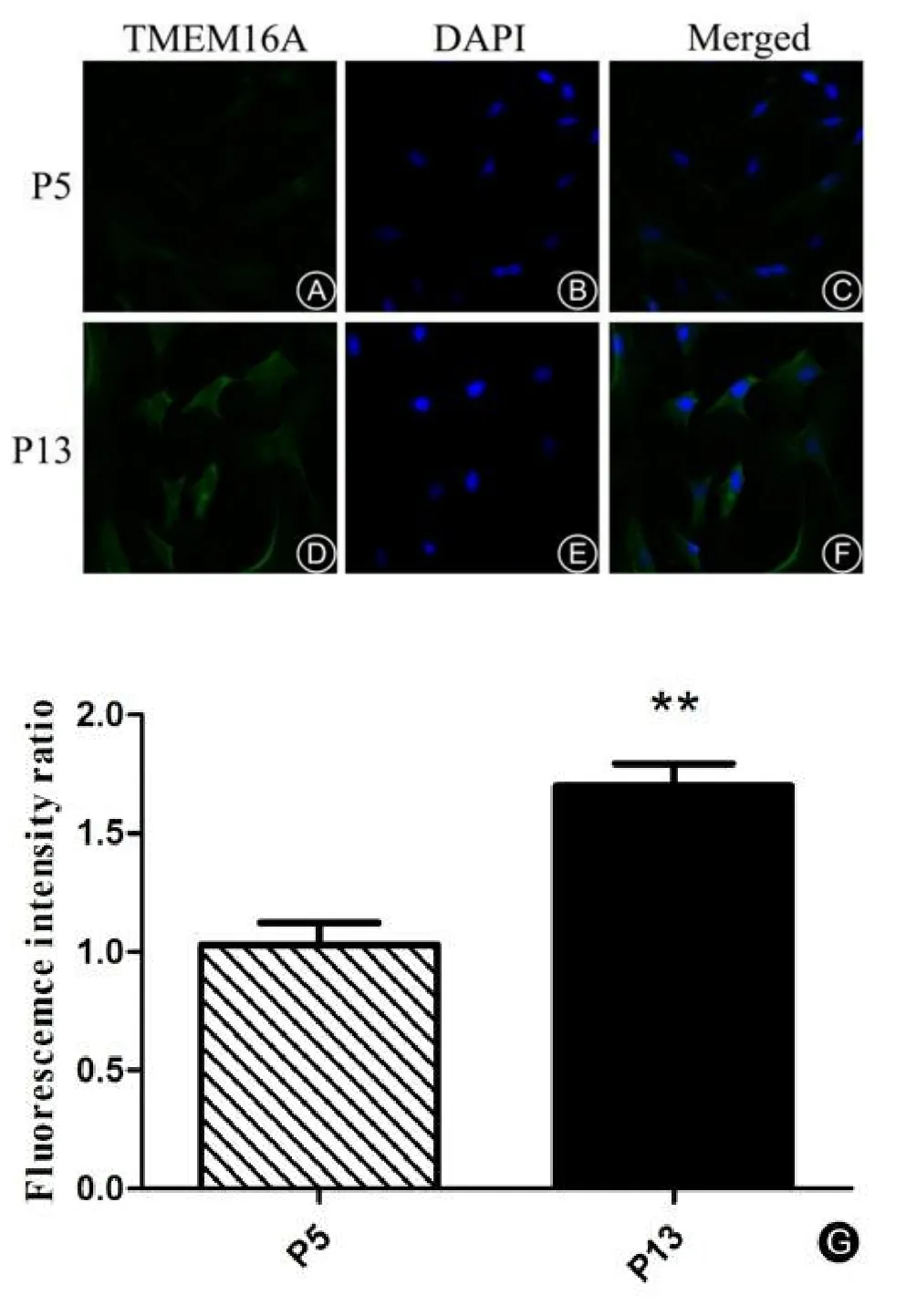
图4 免疫荧光检测PCs上TMEM16A表达变化(×400)A,D:TMEM16A的表达和位置(绿色);B,E:细胞核DAPI染色(蓝色);C,F:合成图像;G:荧光强度比率。Fig.4 Representative confocal microscopy images of pericytes expressing TMEM16A(×400).A,D:Expression and location of TMEM16A(green).B,E:Nuclear staining by DAPI(blue).C,F:Merged.G:Fluorescemce intensity ratio
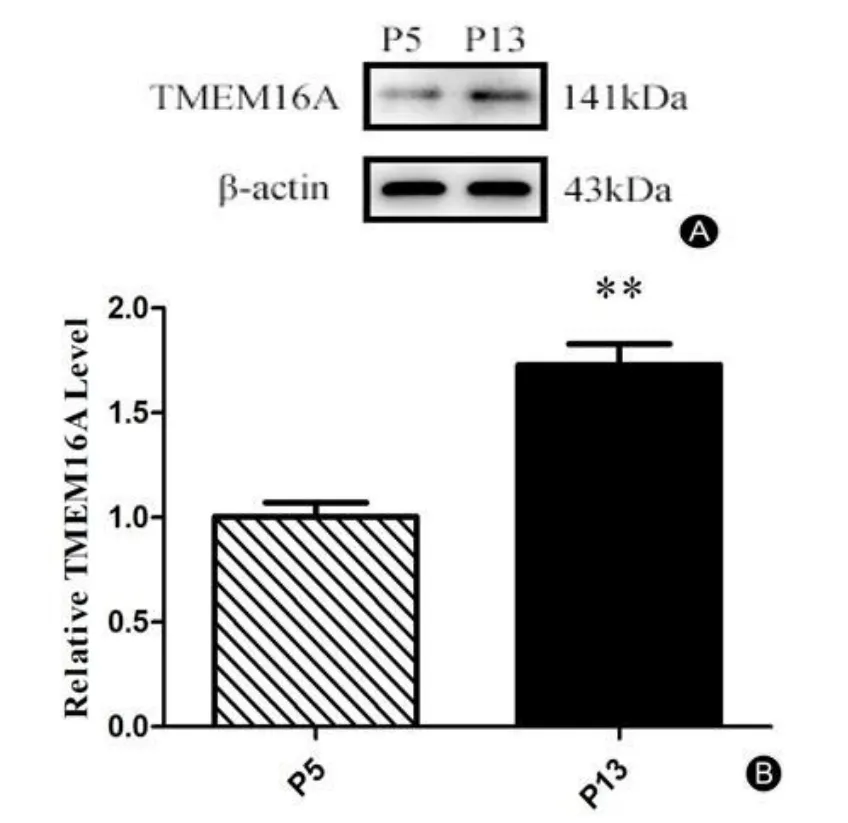
图5 PCs上TMEM16A蛋白表达变化。A:Western Blot印迹条带;B:TMEM16A相对表达水平。Fig.5 Expression of TMEM16A proteins in PCs.A:Western blot showing expression of TMEM16A in PCs.B:Densitometry analysis of TMEM16A.
2.4 CCK-8检测T16Ainh-A01干预后PCs的活力
将原代培养的PCs分别加入10、20、30和50 μmol/L的T16Ainh-A01处理24 h后,CCK-8检测各组PCs的活力。实验发现,随着给予T16Ainh-A01的浓度升高,所测PCs活力的OD值减小。与对照组相比细胞活力下降,20μmol/L T16Ainh-A01干预组(t=3.811,*P<0.05),30μmol/L T16Ainh-A01 干 预 组(t=4.181,*P< 0.05),50μmol/L T16Ainh-A01干预组(t=6.396,**P< 0.01),最后选择30μmol/L的干预浓度(图6)。
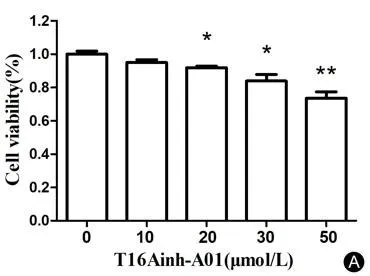
图6 CCK-8检测不同浓度T16Ainh-A01干预后PCs活性。Fig.6 CCK-8 test for PCs viability with different concentrations of T16Ainh-A01.
2.5 全细胞膜片钳记录CaCCs电流
利用全细胞膜片钳记录模式记录培养至第5代和第13代的PCs激活电流。如图7B所示,与对照组相比,衰老组(第13代)PCs的外向电流密度升高(t=5.269,**P<0.01)。使用CaCCs通道的特异性阻断剂T16Ainh-A01后,抑制了PCs的外向电流。将使用阻断剂T16Ainh-A01前后的激活电流相减,可以获得CaCCs的净电流(图7C),与年轻组(第5代)PCs相比,衰老组(第13代)的净电流升高(t=3.471,*P<0.05)。培养至第5代和第13代的PCs上CaCCs介导的净电流变化趋势与总的PCs激活外向电流相似。上述结果显示第13代衰老组PCs上CaCCs开放增加,外向电流增强,给予阻断剂T16Ainh-A01干预后可抑制此外向电流。
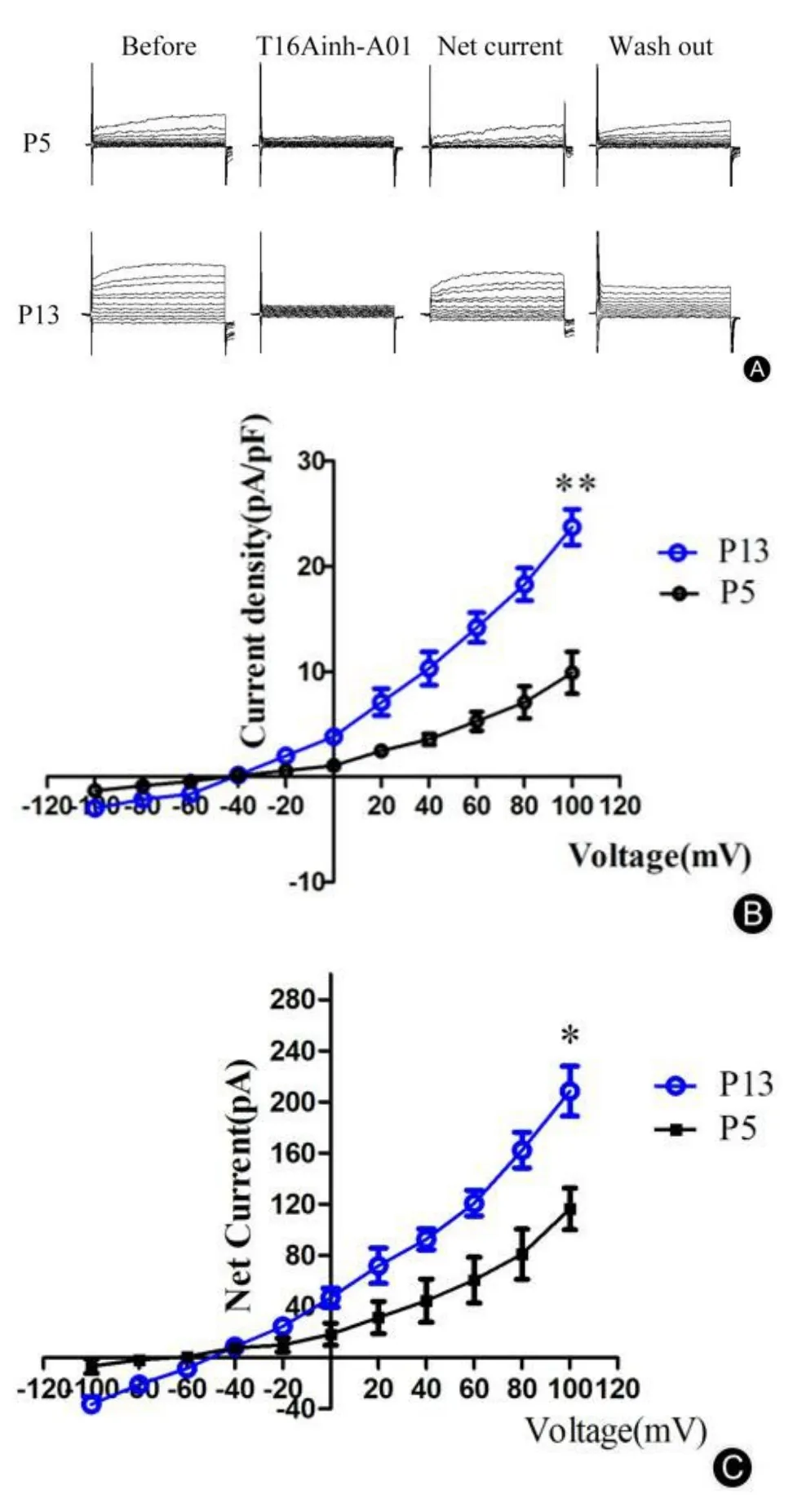
图7 CaCCs的净电流和电流密度变化。A:CaCCs的外向电流;B:CaCCs电流密度曲线;C:CaCCs净电流曲线。Fig.7 The current density and net current change of CaCCs.A:The outward current of CaCCs.B:The current density curve of CaCCs.C:The net current curve of CaCCs.
2.6 Western Blot检测相关凋亡蛋白Caspase-3、Bax和Bcl-2的变化
如图8结果显示,原代培养的衰老组(第13代)PCs与年轻组(第5代)PCs相比,凋亡蛋白Caspase-3的蛋白表达水平升高(t=6.492,**P<0.01),Bax蛋白表达水平升高(t=6.784,**P<0.01),Bcl-2的表达水平明显下降(t=10.29,***P<0.001)。衰老组给予30 μmol/L 的T16Ainh-A01干预24 h后,PCs中凋亡蛋白Caspase-3表达明显下降(t=9.163,###P<0.001),Bax的表达下降(t=3.638,#P<0.05),Bcl-2的表达明显上升(t=5.747,##P<0.01)。
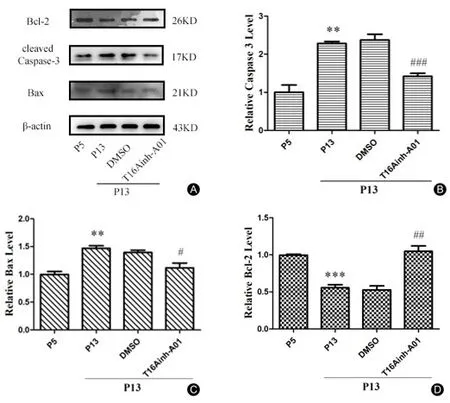
图8 PCs上Caspase-3、Bax和Bcl-2的蛋白变化。A:Western Blot条带;B:Caspase-3蛋白表达水平;C:Bax蛋白表达水平;D:Bcl-2蛋白表达水平。Fig.8 The changes of Caspase-3,Bax and Bcl-2 proteins in PCs.A:Expression of the protein bands.B:Densitometry analysis of Caspase-3.C:Densitometry analysis of Bax.D:Densitometry analysis of Bcl-2.
2.7 流式细胞术检测细胞凋亡率的变化
如图9结果显示,原代培养的衰老组(第13代)PCs与年轻组(第5代)PCs相比,细胞凋亡率明显升高(t=13.63,***P<0.001),衰老组(第13代)PCs给予30 μmol/L 的T16Ainh-A01干预24 h后,细胞凋亡率出现明显下降(t=7.640,##P<0.01)。
3 讨论
耳蜗血管纹PCs作为血迷路屏障(blood-labyrinth barrier,BLB)的重要组成,在维持血管纹稳态和调节BLB通透性中起重要作用[11-13]。目前对血管纹PCs的研究主要集中在形态学方面[4,13,14],对其具体机制方面的研究甚少。本实验成功建立血管纹PCs体外模型,选用连续传代法制备细胞衰老模型,研究发现衰老的耳蜗血管纹PCs凋亡增多,TMEM16A表达增多,TMEM16A特异性阻断剂(T16Ainh-A01)可以减少细胞凋亡。
在听力与TMEM16A的研究中发现,TMEM16A在耳蜗螺旋神经节细胞[15],耳蜗血管纹基底细胞[16]和耳蜗内支持细胞(ISCS)中高度表达[17]。前期本课题组在体研究发现,TMEM16A在豚鼠耳蜗血管纹PCs上广泛表达,且存在年龄相关性变化[10]。正如本实验结果显示,在连续传代后第13代衰老耳蜗血管纹PCs上TMEM16A表达上调,表明TMEM16A与衰老耳蜗血管纹PCs之间存在重要的关联。
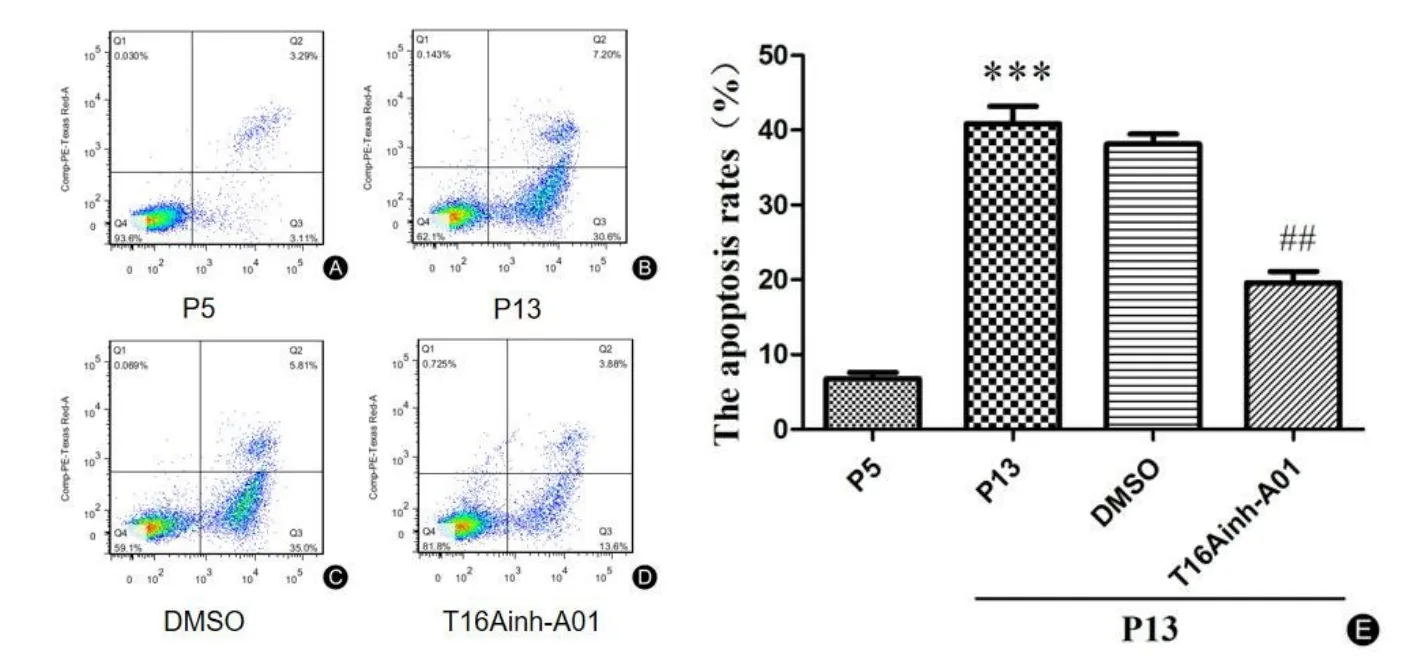
图9 各组PCs凋亡情况;A:第5代PCs凋亡率;B:第13代PCs凋亡率;C:DMSO溶剂组;D:第13代PCs给予T16Ainh-A01后细胞凋亡率。Fig.9 The apoptosis rate of PCs in each group.A:The apoptosis rate of P5 PCs.B:The apoptosis rate of P13 PCs.D:The apoptosis rate of P13 PCs after T16Ainh-A01 intervention.
TMEM16A的表达和功能因细胞种类而异,早先研究只发现TMEM16A与肿瘤细胞密切相关[18,19]。最近有研究表明TMEM16A还可通过线粒体途径促进脑基底动脉平滑肌细胞(BASMCs)的凋亡,使Caspase-9和Caspase-3活化,Bax表达增加[8]。许多研究发现老年性耳聋可引起耳蜗细胞变性,细胞自噬与凋亡增加[20,21],TMEM16A与细胞凋亡密切相关,但TMEM16A对老年性耳聋中耳蜗血管纹PCs凋亡的影响尚未报道。本实验研究发现与年轻组细胞相比,衰老组细胞凋亡率明显增多,凋亡蛋白Caspase-3、Bax的表达增多;在给与TMEM16A的特异性阻断剂T16Ainh-A01后,衰老组的细胞凋亡率下降,Caspase-3、Bax表达明显减少,提示TMEM16A可能与衰老耳蜗血管纹PCs的凋亡密切相关。
CaCCs具有Ca2+浓度依赖和电压依赖性的电生理特性[22],有学者研究发现,CaCCs通道开放可使I(Cl-)外流增多,细胞膜去极化,有利于 Ca2+通过电压依赖性钙通道(VDCC)进入细胞内,使细胞内Ca2+浓度升高[23,24]。本实验运用全细胞膜片钳技术,记录到原代培养的耳蜗血管纹衰老组PCs上CaCCs电流密度较年轻组有所增大,CaCCs开放增加,可能使Ca2+内流增加,耳蜗血管纹PCs内Ca2+浓度失衡可能造成耳蜗血管纹PCs的凋亡。
综上所述,TMEM16A可能作为耳蜗血管纹PCs凋亡的调节蛋白分子,促进PCs的凋亡进而影响耳蜗血管纹毛细血管的功能,但是其具体作用机制还有待进一步研究。
