玉米秸秆AFEX预处理纤维素酶解特性研究
2021-02-01李骏宝陆敏生张海燕韩鲁佳
李骏宝 陆敏生 张海燕 韩鲁佳
(中国农业大学工学院, 北京 100083)
0 引言
木质纤维类生物质年产量大、分布广,是制取纤维素乙醇的主要原料[1]。木质纤维类生物质主要由纤维素、半纤维素和木质素组成[2],纤维素被包裹在共价相连的木质素和半纤维素中,导致用酶水解法制取纤维素乙醇时降解率低,大大影响了乙醇的产率[3]。因此,在酶水解前需对木质纤维类生物质进行预处理,以降低其抗降解特性,提高纤维素的酶可及度,从而提高酶水解效率。
文献[4]指出,理想的预处理方法能最大限度地脱除木质素、减少多糖的改性,从而保留原始的微纤丝结构。木质素是对木质纤维类生物质酶水解效率影响较大的因素,其主要抑制机制是木质素填充在纤维素和半纤维素的网络中,在空间上阻碍了纤维素酶和纤维素的接触,并能与纤维素酶发生非生产性吸附[5]。木质素解聚后产生的水溶性酚类物质还会与纤维素酶形成沉淀复合物,从而不可逆地抑制纤维素酶的活性[6]。但是,不同原料及其预处理方法和预处理条件的产物往往不同,对木质素解聚产生的酚类物质的影响也不同[7]。
氨纤维膨胀(AFEX)预处理是一种有效的预处理方法,国内外已开展了大量系统的研究工作,研究表明,AFEX预处理能有效地破坏细胞壁的亚显微结构,切断木质素与多糖的连接,并使半纤维素和木质素部分解聚,对纤维素产生消晶作用,去除半纤维素侧链上的乙酰基,从而提高纤维素的酶可及度和酶水解效率[6-8]。此外,AFEX预处理工艺还具有固体加载率高、不需水洗、绝大多数氨可回收、残留在物料中的氨能为发酵过程提供氮源等优点[9-10]。文献[11]指出,虽然AFEX预处理后的木质纤维物料的木质素总量变化不显著,但木质素的溶解性显著提高。文献[12]研究分析了AFEX预处理柳枝稷木质素物化性质的变化及其对酶解的影响,结果表明,AFEX预处理柳枝稷木质素的分子量、聚合度、紫丁香基与愈创木基的比例均有所提高,木质素对纤维素酶的非生产性吸附降低,对酶解过程的抑制作用随之减小,从而使酶解效率提高。文献[13]采用超速离心、超滤、固相萃取技术对AFEX预处理上清液中不同分子量的产物进行分离,并分析了它们对纤维素酶的抑制作用,发现主要的抑制作用系由上清液中的低聚物(3~10 ku或0~3 ku)产生,并且大部分抑制物为疏水结构,其中含有许多酚类物质,推断酚类物质可能是AFEX预处理上清液产生抑制作用的重要成分。上述研究均未涉及AFEX预处理木质素对酶解的空间阻碍作用以及产生的酚类物质对后续酶解的影响。
本文以玉米秸秆为原料,进行高低两个温度条件的AFEX预处理,基于孔径分布、表面形貌、细胞壁结构和纤维素、木质素表面积的变化,研究AFEX预处理后木质素对酶解的空间阻碍作用以及产生的酚类物质对后续酶解的影响。
1 材料与方法
1.1 玉米秸秆及酶制剂
玉米秸秆取自中国农业大学上庄实验站(40°2′N, 116°20′E)。采集的玉米秸秆样品置于空旷通风处自然风干后进行机械粉碎(9ZP-0.4型粉碎机,辽宁凤城县东风机械厂),在40℃恒温干燥箱中干燥48 h,使用RT-34型锤片式粉碎机(香港荣聪精密科技有限公司)粉碎至秸秆粉末全部通过40目振动筛,得到玉米秸秆制备样品(CK),置于自封袋中在干燥通风处室温(20℃)保存备用。
试验所用纤维素酶(Celluclast 1.5 L)和β-葡萄糖苷酶 (Novozyme 188)均购自美国Sigma-Aldrich公司。纤维素酶酶活的测定参照美国可再生能源实验室的滤纸酶活法[14],β-葡萄糖苷酶的酶活测定参照文献[15]的方法,测得纤维素酶和β-葡萄糖苷酶的酶活分别为72.8 U/mL和385.5 U/mL。
1.2 玉米秸秆AFEX预处理
已有相关文献表明,AFEX预处理酶解的效果随着处理温度的上升(从90℃升至140℃)而显著增加[12,16]。为便于分析,本研究选取文献中的高、低两个极端AFEX预处理条件(90℃、5 min和140℃、15 min)进行试验设计[12,16],即:预处理在Parr 4523型反应釜(美国Parr Instruments公司)中进行。每1 g CK与0.6 g 水混合,氨的加载量为1 g/g(以单位质量玉米秸秆计),一组在90℃下恒温处理5 min(L-AFEX),另一组在140℃下恒温处理15 min(H-AFEX),然后迅速打开泄压阀排出氨气,取出样品置于通风橱中自然风干后于60℃干燥箱中干燥。干燥的AFEX预处理样品于自封袋中封存待用。
1.3 酶解试验
1.3.1AFEX预处理玉米秸秆的酶解试验
为了考察AFEX预处理对玉米秸秆酶解效果的影响,AFEX预处理玉米秸秆的酶解试验在pH值4.8的50 mmol/L柠檬酸缓冲液中进行,料液比为0.05 g/mL,纤维素酶加载量为20 U/g,β-葡萄糖苷酶加载量为40 U/g,为避免酶解过程中微生物的干扰,添加四环素盐酸盐至0.08 g/L。酶解72 h后,将样品取出置于沸水浴中10 min使纤维素酶灭活,利用抽滤进行固液分离,用适量的去离子水冲洗固体残余物3次,收集、混匀所有滤液(记为酶解液)并记录其体积。取部分酶解液用CaCO3调节pH值至5~6保存备用,用于葡萄糖得率的检测。酶解试验设置3组平行。
利用Hitachi L-7200型高效液相色谱仪(日本Hitachi公司)测定酶解液中单糖浓度,色谱柱使用Benson BP-800 Pb++型碳水化合物分析柱 (美国Benson Polymeric公司),流动相为超纯水,流速为0.6 mL/min,柱温为80℃,进样体积20 μL,洗脱时间为40 min。单糖得率计算公式为
(1)
式中mE——酶解72 h后产出单糖的质量,mg
mP——不同底物中可转化成单糖的最大质量,mg
1.3.2酚类物质对酶解的影响
不同分子量的酚类物质都会对酶解产生抑制效果[17],而这些酚类物质由于结构复杂很难定量[18],所以直接测定不同分子质量的酚类物质对酶解的抑制效果比较困难。故本文利用活性炭对各上清液中的酚类物质进行脱除,用活性炭吸附前后的预处理上清液稀释纤维素酶,并用稀释后的酶水解纤维素滤纸,测定产糖量来表征预处理过程中产生的酚类物质对纤维素酶水解能力的影响。取无磷活性炭(Activated carbon,AC,上海迪柏化学品技术有限公司),用大量去离子水和异丙醇冲洗[19],再于通风橱自然风干后置于105℃干燥箱中干燥至绝干。为了研究AFEX预处理产生的酚类物质对酶解的作用,分别将CK、L-AFEX和H-AFEX预处理玉米秸秆样品与pH值4.8的柠檬酸缓冲液按料液比0.05 g/mL混合,在50℃水浴中150 r/min振荡1 h,3 000 r/min离心15 min得上清液,并用0.22 μm的滤膜过滤。各上清液中的葡萄糖、甲酸、乙酸、乙醇、糠醛和羟甲基糠醛浓度的测定参照方法NREL/TP-510-42623[20]。取部分上清液与0.05 g/mL经清洗处理的AC(30℃,200 r/min,16 h)脱除酚类物质[17]。试验设置2组平行。参照文献[21]的方法测定脱除酚类物质前后上清液中总酚类物质(Total phenolic component,TPC)的含量,上清液中TPC的脱除率计算公式为
(2)
式中mi——脱除酚类物质前上清液中TPC质量,mg
mf——脱除酚类物质后上清液中TPC质量,mg
用脱除酚类物质前后的上清液将纤维素酶稀释70倍(约为10 U/g),以pH值4.8的柠檬酸缓冲液将纤维素酶稀释70倍作对照,分别将0.5 mL稀释的酶液、1.0 mL柠檬酸缓冲液和50 mg Whatman No.1滤纸于15 mL具塞试管中混合并于50℃水浴中恒温1 h,而后加入3 mL DNS(二硝基水杨酸)显色液终止反应并于沸水浴中恒温5 min显色,用蒸馏水将显色后的液体稀释一定倍数后用UV-2550型分光光度计(日本Shimadzu公司)在540 nm下测定吸光度。上清液对纤维素滤纸水解的抑制率计算公式为
(3)
式中PCBS——柠檬酸缓冲液稀释的纤维素酶水解滤纸产生的还原糖质量,mg
Ps——上清液稀释的纤维素酶水解滤纸产生的还原糖质量,mg
由于玉米秸秆的构成比纤维素滤纸复杂得多,且AFEX对玉米秸秆的结构造成了较大改变,故再用分散在柠檬酸缓冲液和AC吸附前后的预处理上清液中的CK、L-AFEX及H-AFEX预处理固体残余物的酶解葡萄糖得率来表征不同上清液中的酚类物质对酶解相应固体残余物的抑制作用。
每种提取上清液后的预处理固体残余物用柠檬酸缓冲液冲洗3遍并分成3组,分别被柠檬酸缓冲液及相应的AC吸附前后的预处理上清液冲洗3遍后再以0.05 g/mL的料液比分散。而后加入20 U/g 的纤维素酶和40 U/g 的纤维二糖酶。用不同上清液与酶的混合物做空白。将样品和空白置于50℃、150 r/min的恒温水浴振荡器中酶解72 h,取出后于沸水浴中恒温10 min灭酶,而后3 000 r/min离心15 min。收集上清液,用液相测定其中的葡萄糖浓度,抑制率的计算方法与式(3)相似。
1.4 木质纤维成分分析
纤维素、半纤维素、木质素含量的测定参照文献[22],测定前样品于105℃干燥箱中干燥至绝干。木质素含量为酸溶木质素含量和酸不溶木质素含量之和。每个样品分析设置2个重复。
1.5 微结构分析
1.5.1孔径分布
利用溶质排斥的方法对样品的孔径分布进行分析。以葡萄糖、葡聚糖T2000(Dextran T2000)和一系列的聚乙二醇(Polyethylene glycol,PEG)为分子探针,各探针分子的相对分子质量和直径如表1[23-24]所示,每个探针分子设置2个重复。试验步骤主要参照文献[23],并稍作修改:将CK、L-AFEX和H-AFEX预处理样品用大量去离子水冲洗至滤液无色中性,将样品抽滤至固体质量分数近20%的湿样,测定湿样的干质量。称取1.0 g湿样于离心管中,加入2 mL质量浓度为0.01 g/mL的探针分子溶液于室温下混合2.5 h,其间每0.5 h振荡30 s。将样品与探针的混合物于3 000 r/min下离心10 min,取上清液过0.45 μm的尼龙膜,每个样品设置2组平行,并以水与湿样混合后的上清液作为样品空白。上清液中分子探针的浓度用装备有Waters 2414型示差检测器(美国Waters公司)的Waters e2695型高效液相色谱仪检测,进样器和检测器之间用一个直通接头代替分析柱,流动相为超纯水,流速为0.4 mL/min,进样体积为10 μL。
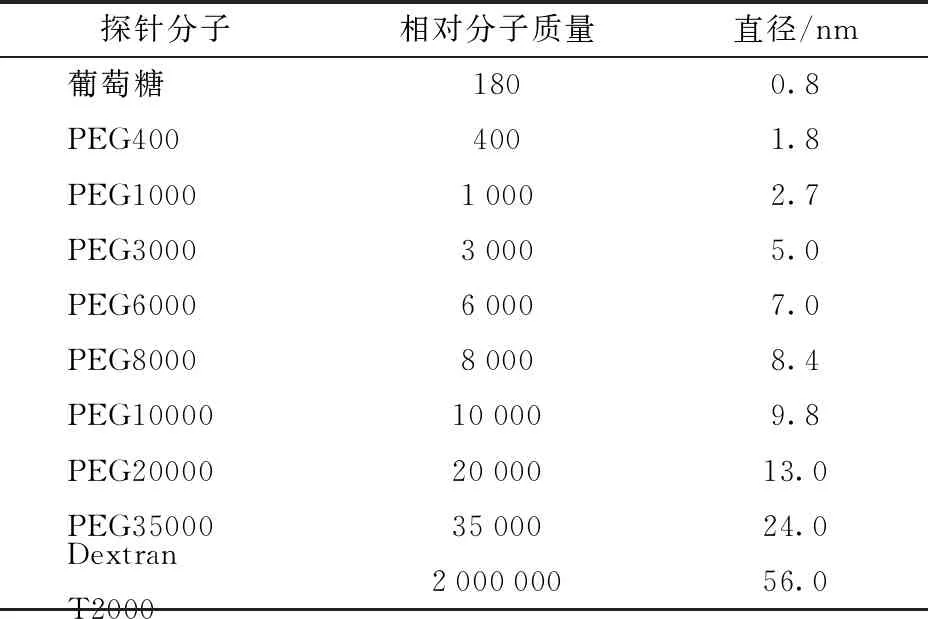
表1 探针分子的相对分子质量和直径Tab.1 Relative molecular masses and diameters of probes
单位干质量湿样中直径为i的分子探针不可进入的孔的体积di计算公式为[25]
(4)
式中W——探针溶液体积,mL
q——湿样中水体积,mL
p——湿样干质量,g
Ci——探针溶液的初始质量分数,%
Cf——上清液中探针溶液的质量分数,%
葡聚糖T2000的粒径为56 nm,d56nm被认为是总的不可进入的孔的体积,故单位干质量湿样中粒径为i的分子探针可进入的孔的体积Ai计算公式为
Ai=d56nm-di
(5)
1.5.2表面形貌
使用Hitachi SU-3500型扫描电子显微镜(Scanning electron microscope,SEM;日本Hitachi公司)分析不同样品的表面形貌。测试前需先将适量样品固定于粘有黑色导电胶的载物台上,并作喷Au处理,时间为60 s。测试时加速电压为15 kV。
1.5.3细胞壁结构
挑选各样品中包含有厚壁细胞包围的维管束结构的颗粒,利用Hitachi H-7650B型透射电子显微镜(Transmission electron microscope,TEM)观察这些颗粒的横截面,分析AFEX预处理后玉米秸秆细胞壁结构的变化。观察时,TEM的加速电压为80 kV。用于TEM观察的超薄切片样品的制作过程及超薄切片的乙酸双氧铀-柠檬酸铅双染色的操作流程同文献[26]。
1.5.4纤维素、木质素表面积
同文献[27],通过测定刚果红和天青B与样品的最大吸附量来估算样品中纤维素和木质素的表面积。两种染料与样品的最大吸附量在Matlab 2014a中用Langmuir等温线拟合而得。
1.6 数据处理
本文所列数据均为统计平均值,误差由计算数据的标准偏差得到,均值的差异显著性检验借助SPSS 20.0,基于Duncan单因素方差检验,检验水平为99%(P<0.01)。柱状图和折线图的制作均借助Origin 8.5。
2 结果与讨论
2.1 AFEX预处理玉米秸秆的酶解效果
如图1所示,酶解72 h后,CK、L-AFEX和H-AFEX预处理玉米秸秆葡萄糖得率分别为(26.18±0.57)%、(37.57±0.01)%和(74.74±0.07)%,木糖和阿拉伯糖得率分别为(5.59±0.17)%、(26.05±0.23)%和(76.63±0.20)%。可以看出,AFEX预处理对玉米秸秆酶解效果的改善随预处理条件的升高而增强。文献[16]用与本研究H-AFEX预处理相同的条件处理了玉米秸秆,再用优化的混合酶酶解72 h,得到了近80%的葡萄糖得率,结果与本研究相近。从图1中还可看出,经过AFEX预处理的玉米秸秆在酶解时的葡萄糖得率、木糖和阿拉伯糖得率均得到显著提高,而相对于葡萄糖得率,预处理条件的增强对酶解时木糖和阿拉伯糖得率的影响更为显著。这可能是由于半纤维素在AFEX预处理过程中会发生解聚[9],且半纤维素为非晶态,更容易在酶解过程中被降解。
2.2 AFEX预处理前后木质纤维成分的变化及其对酶解的影响
如表2所示,CK中纤维素、半纤维素和木质素质量分数分别为(35.16±0.10)%、(19.01±0.05)%和(18.82±0.58)%。AFEX预处理后,玉米秸秆中纤维素、半纤维素和木质素含量均无显著变化(P>0.01)。但是,随着预处理条件的增强,酸溶木质素含量显著升高(P<0.01),酸不溶木质素含量显著降低(P<0.01)。这与文献[11]的结果一致,其认为酸不溶木质素的降低可能源于AFEX预处理对木质素的化学改性。根据文献[28],酸溶木质素可能是由木质素降解产物和次生的亲水物质(木质素和碳水化合物形成的化合物)组成。这说明AFEX预处理会提高玉米秸秆中部分木质素的亲水性,由于疏水相互作用是木质素与纤维素酶之间发生非生产性吸附的主要作用机制[29],那么这部分木质素与纤维素之间发生非生产性吸附的能力也就变弱。此外,在各上清液中均未检出甲酸、乙醇、糠醛和羟甲基糠醛。AFEX预处理仅产生了少量乙酸(CK:(0.06±0.01) mg/mL;L-AFEX:(0.10±0.01) mg/mL;H-AFEX:(0.22±0.01) mg/mL)。根据先前的研究,乙酸对酶解几乎无影响[30]。
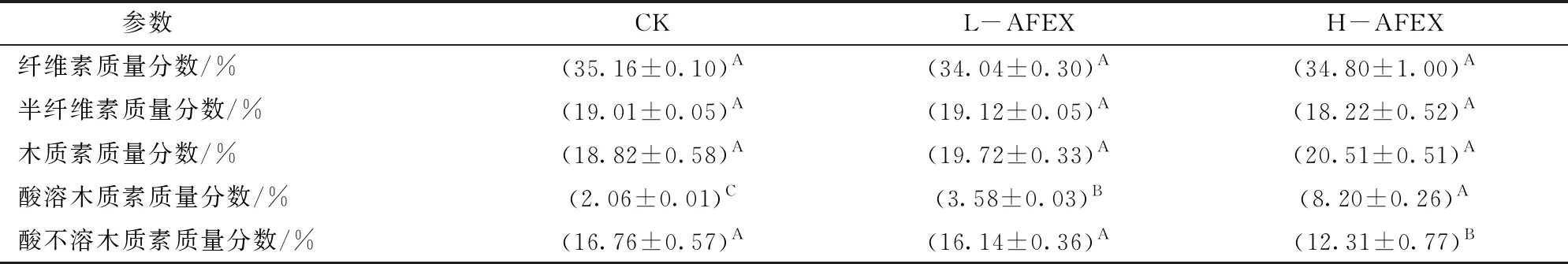
表2 AFEX预处理前后玉米秸秆的木质纤维成分含量Tab.2 Lignocellulosic composition contents of corn stover before and after AFEX pretreatment
2.3 AFEX预处理产生的酚类物质及其对酶解的影响
AC吸附前后,上清液中TPC的变化如表3所示。可以看出,AFEX预处理后上清液中TPC含量显著增加(P<0.01),且随AFEX预处理条件的增强,TPC含量也显著增加(P<0.01)。文献[31-32]中也得到了类似的结果。AC吸附后CK、L-AFEX和H-AFEX预处理样品上清液中TPC的脱除率分别为96.14%、98.72%和98.95%。
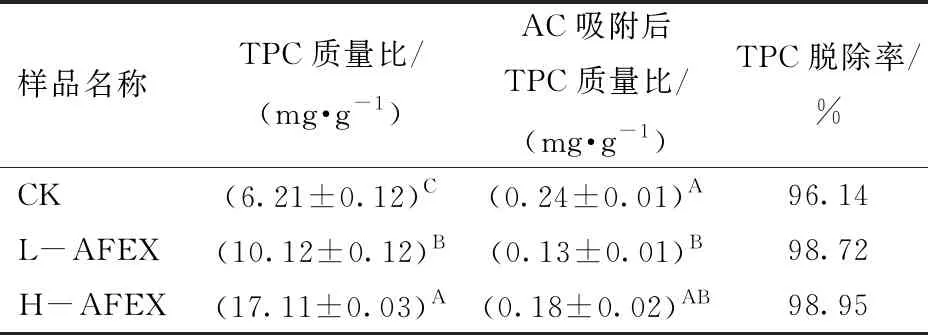
表3 AC吸附前后上清液中TPC含量Tab.3 TPC contents in different supernatants before and after AC adsorption
图2为AC吸附前后上清液对纤维素滤纸酶解效果的影响,“CBS”为对照组,为pH值4.8的柠檬酸缓冲液稀释的酶液,标有“S”的是纤维素酶与不同上清液混合,标有“AC”的是经AC脱除酚类物质的上清液稀释的酶液。以pH值4.8的柠檬酸缓冲液稀释的酶液作为对照,经计算得CK、L-AFEX和H-AFEX预处理上清液对纤维素滤纸酶解的抑制率分别为28.04%、4.10%和10.40%,差异极显著(P<0.01)。但是,上清液脱除酚类物质后,L-AFEX和H-AFEX预处理上清液对水解均未产生显著的抑制作用(P>0.01)。在不同预处理过程中产生的纤维素酶可溶性抑制物主要有可溶性糖(如葡萄糖、纤维二糖)、发酵产物(如乙醇)和酚类物质[33]。CK上清液中葡萄糖的质量浓度为(2.51±0.14) mg/mL,L-AFEX和H-AFEX预处理上清液中均未检出葡萄糖,且各上清液中均未检出乙醇。CK上清液中TPC含量最低但抑制率最高,可能是因为CK中有相当量的游离葡萄糖,这些葡萄糖作为酶解产物会抑制纤维素酶的水解能力[33]。以上表明,酚类物质是AFEX上清液中抑制纤维素酶水解能力的主要成分。脱除酚类物质后,CK上清液的抑制率降低为17.43%,但依然大于脱除酚类物质前L-AFEX和H-AFEX预处理上清液的抑制效果。
图3为不同上清液中酚类物质对相应固体残余物酶解效果的影响,“CBS”为对照组,为分散在pH值4.8的柠檬酸缓冲液中的玉米秸秆,标有“S”的是预处理固体残余物分散在不同上清液中,标有“AC”的是预处理固体残余物分散在经AC脱除酚类物质的上清液中。以“CBS”为对照,用与图2相同的方式计算不同上清液中酚类物质对相应固体残余物酶解效果的抑制率。可以看出,CK和L-AFEX预处理的上清液并未对其对应的固体残余物的酶解效果产生显著影响(P>0.01)。H-AFEX预处理上清液对H-AFEX预处理固体残余物的酶解效果表现出显著的抑制效果(抑制率8.07%)。AC吸附后,H-AFEX预处理上清液的抑制效果降低为3.01%。这说明在本试验条件下,H-AFEX预处理产生的酚类物质对酶解的抑制率为5.06%。根据统计分析的结果,分散在AC吸附后的H-AFEX上清液中的H-AFEX预处理固体残余物的酶解效果与分散在柠檬酸缓冲液中的无显著差异(P>0.01)。尽管CK的上清液对酶水解能力有较强的抑制力,当酶解底物换成CK固体残余物后,抑制作用并没有体现出来。这大概是由于CK固体残余物本身具有较强的抗降解特性,上清液的抑制作用被掩盖了。H-AFEX预处理固体残余物具有较理想的纤维素可及度,所以酶水解活性受到的影响就在酶解效果中体现了出来。
2.4 木质素、纤维素表面暴露程度的变化及其对酶解的影响
CK、L-AFEX和H-AFEX预处理玉米秸秆样品中不同粒径的分子探针可扩散进入的孔体积如表4所示,L-AFEX预处理玉米秸秆中葡萄糖可扩散进入的体积较CK无显著差异(P>0.01),在H-AFEX预处理后玉米秸秆中0.8 nm的探针可扩散进入的体积显著增大(P<0.01)。然而,在AFEX预处理玉米秸秆中,一系列PEG分子探针可扩散进入的体积总体上较CK并无显著差异(P>0.01)。0.8 nm的探针小到几乎可以进入所有的孔,这说明H-AFEX预处理增大了玉米秸秆中的孔的总体积,并对其中小孔体积的增加作用更为明显。
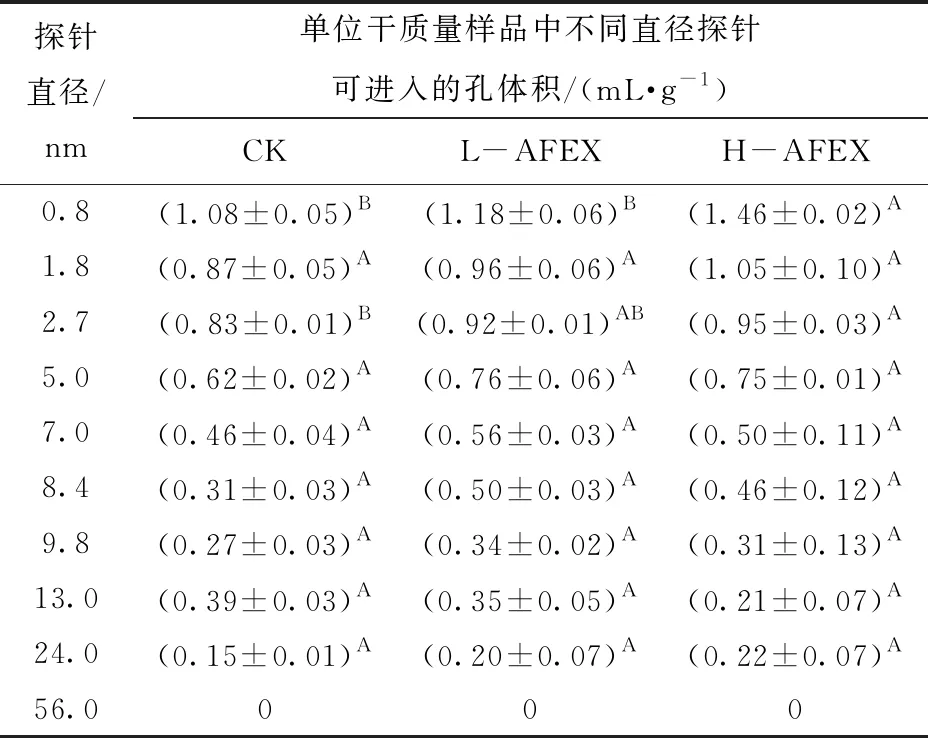
表4 AFEX预处理前后玉米秸秆的孔径分布Tab.4 Pore size distributions of corn stover before and after AFEX pretreatment
文献[34]用5.1 nm来代表产自里氏木霉的纤维素酶的粒径,并发现5.1 nm粒径的分子可及的孔体积与酶水解的初始速率呈线性正相关关系。而CK、L-AFEX和H-AFEX预处理玉米秸秆样品中粒径为5.0 nm的探针分子可进入的孔体积并无显著差异(P>0.01)。这说明,AFEX预处理并未使玉米秸秆中纤维素酶可及的孔体积(孔径小于56 nm)发生显著改变。
CK、L-AFEX和H-AFEX预处理玉米秸秆样品及其酶解72 h样品的SEM结果如图4所示。CK(图4a)的表面十分平整,结构完整紧凑。酶解72 h后(图4b),秸秆表面虽有些褶皱,但整体结构并未受到破坏。说明CK中由纤维素、半纤维素和木质素构成的致密完整的网络结构严重阻碍了纤维素酶的水解作用,致使酶解效率较低(酶解糖得率26.18%)。经过L-AFEX预处理后(图4c),玉米秸秆表面形貌的变化明显,完整紧凑的结构被破坏,比表面积升高。酶解72 h后(图4d),秸秆表面出现许多直径几微米的孔,但是整体结构较酶解前变化不大,这说明L-AFEX预处理虽然对玉米秸秆空间结构的影响作用显著,但是对酶解效率的提高仍有限(酶解糖得率37.58%)。经过H-AFEX预处理后(图4e),玉米秸秆的表面形貌发生了更大程度的改变,表面的破碎程度较L-AFEX预处理后的玉米秸秆更大,比表面积的升高也就更大。经过72 h酶解后(图4f),样品的结构被彻底破坏,这说明H-AFEX预处理大大提高了酶解效率(酶解糖得率74.73%)。
玉米秸秆中的各类多糖和木质素主要存在于细胞壁中,这些成分发生了显著变化一定会改变细胞壁的结构。CK、L-AFEX和H-AFEX预处理玉米秸秆样品的细胞壁结构表征结果如图5所示,皆为厚壁细胞。如图5a所示,CK的细胞壁结构完整清晰,初生壁(Primary cell wall,PCW)、次生壁(Secondary cell wall,SCW)、细胞角隅(Cell corner,CC)及胞间层(Middle lamella,ML)堆积紧密,无明显孔隙结构。又根据文献[35]的研究,在TEM下观察经过乙酸双氧铀-柠檬酸铅染色后的样品,木质素会被染液中的重金属染成深色,纤维素则颜色较浅或呈无色。CK中CC和ML的木质素含量显著高于PCW和SCW,这与文献[35]中报道的一致。相同部位的不同位置被重金属染色的程度都比较均一,说明相同部位中各组分排列均匀。L-AFEX预处理后(图5b),玉米秸秆细胞壁各部分的结构变化并不显著,但相同部位的不同位置被重金属染色的程度却不均一,尤其是PCW和SCW处均能看到明显较亮或较暗的部分。这可能是因为,经过L-AFEX预处理后,玉米秸秆细胞壁上原始的组分分布状态已被打破,木质素开始聚集,纤维素开始暴露。虽然从SEM结果看到L-AFEX预处理破坏了玉米秸秆的表面形貌,但从TEM结果来看此时细胞壁各部分的整体结构并未被破坏。H-AFEX预处理后(图5c),玉米秸秆细胞壁变得扭曲褶皱,甚至被撕裂,各部位之间出现错位,但并未产生更多的孔隙。这说明此时细胞壁各部位间的连接变得松散,这样的结构较CK和L-AFEX预处理玉米秸秆更容易在后续酶解过程中被进一步破坏,就可能有更多的纤维素暴露出来,被纤维素酶水解。另外,H-AFEX预处理玉米秸秆细胞壁相同部位不同位置的染色程度较L-AFEX预处理样品显得更不均一。从图5c来看,在CC处、不同部位的连接处和细胞壁断裂处能看到不同程度的木质素的聚集。而在细胞壁中的木质素组分发生了极为显著的聚集,形成了轮廓鲜明的黑点,此时木质素的比表面积显著缩小。
纤维素和木质素是木质纤维物料中吸附纤维素酶的两个主要成分[36-37]。通过测定刚果红和天青B在底物上的最大吸附量,得到CK、L-AFEX和H-AFEX预处理玉米秸秆样品中纤维素及木质素的表面积,如图6所示。CK的纤维素和木质素表面积分别为(316.08±7.01)m2/g和(293.13±1.47)m2/g,AFEX预处理后,玉米秸秆中纤维素的表面积显著增大(L-AFEX:(430.97±2.69)m2/g,H-AFEX:(422.27±6.64)m2/g)、木质素的表面积显著减小(L-AFEX:(271.25±2.75)m2/g,H-AFEX:(215.23±0.37)m2/g),而预处理强度对纤维素的暴露影响不显著(P>0.01),木质素表面积却随着预处理强度的增强而显著减小(P<0.01)。这可能与细胞壁结构表征结果中在H-AFEX预处理后木质素发生的形态和分布变化有关,此时木质素的比表面积减小,同时木质素在秸秆表面的聚集可能会覆盖部分暴露的纤维素。CK、L-AFEX和H-AFEX预处理玉米秸秆样品中纤维素与木质素表面积的比值分别为1.08、1.59和1.96,假设纤维素和木质素在玉米秸秆表面的暴露分布均匀,由此推断,随着AFEX预处理条件的增强,玉米秸秆单位面积表面上纤维素酶可及的木质素对纤维素的空间阻碍逐渐降低。
因此,AFEX预处理不仅增大了纤维素酶可及的表面积,还增大了纤维素酶可及的表面积中纤维素暴露的比例,从而有效降低了纤维素酶水解时的空间阻碍,提高了酶解效率。
3 结论
(1)从木质纤维组成、酚类物质和纤维素、木质素暴露程度3方面分析了AFEX预处理后玉米秸秆的变化及其对酶解效果的影响。
(2)随着AFEX预处理温度的升高和时间延长,玉米秸秆中纤维素和半纤维素含量不变,酸溶木质素增多,木质素亲水性增强,减弱了酶解时木质素与纤维素酶间的非生产性吸附,同时产生了更多的酚类物质。
(3)L-AFEX和H-AFEX预处理上清液中的TPC对纤维素酶水解能力的抑制率分别为4.10%和10.40%,TPC对H-AFEX固体残余物的抑制率为5.06%(P<0.01)。
(4)AFEX预处理显著增大了纤维素酶可及的表面积,将纤维素表面积从316.08 m2/g(CK)增大至430.97 m2/g(L-AFEX)和422.27 m2/g(H-AFEX),将木质素表面积从293.13 m2/g(CK)减小至271.25 m2/g(L-AFEX)和215.23 m2/g(H-AFEX),使纤维素与木质素表面积的比值从1.08(CK)增大至1.59(L-AFEX)和1.96(H-AFEX),有效降低了木质素对纤维素酶解的空间阻碍,提高了酶解效率。
