人粒细胞巨噬细胞刺激因子过滤工艺确认研究
2021-01-30魏荣华孔雯雯周茂德王维唯
魏荣华 孔雯雯 周茂德 王维唯
广州白云山拜迪生物医药有限公司生产部,广东广州 511495
人粒细胞巨噬细胞刺激因子(Recombinant Human Granulocyte Macrophage Colony Stimulating Factor,rhGM-CSF)是由基因工程菌发酵表达产生,经分离提纯后,制成无菌制剂。rhGM-CSF 主要用于治疗因放、化疗引起的白细胞减少以及预防化疗后中性粒细胞的减少症等[1-4],也可作用于皮肤损伤,促进皮肤损伤创面的愈合[5-6]。
rhGM-CSF 注射液的生产过滤工艺属于关键工艺,滤器的选型及材质直接影响最终药品的关键质量属性。根据美国注射剂协会(PDA)技术报告26号[7]及我国药品GMP 指南[8]对液体无菌过滤要求,及国内学者对无菌过滤确认研究,整个过滤工艺的确认研究至少应包括:过滤器的选型;细菌截留实验;完整性测试;过滤工艺模拟;吸附性测试;兼容性测试;可提取物分析等方面[9-16]。本研究将针对rhGM-CSF 注射液过滤工艺中采用的LAGL04TP6 滤器和MPGL 02G H2 滤器(两种滤器滤膜材质均为0.22 μm 亲水性聚偏二氟乙烯),考察滤器(滤膜)与药液的相互作用,对吸附性、可提取物、兼容性等影响项目进行确认研究。
1 材料与方法
1.1 仪器与试剂
rhGM-CSF 药液(批号:20160902,广州白云山拜迪生物医药有限公司);GVWP 过滤膜、MPGL 2GC A3滤器、MPGL 02G F2 滤器、Milli-Q 纯水系统、自动化完整性测试仪integritestR4(默克密理博);Agilent 1100 高效液相色谱仪(美国安捷伦科技有限公司);Sievers 900便携式TOC分析仪(GE公司);Nicolet 560 ESP型傅里叶红外分光亮度检测仪(美国Nicolet公司)。
1.2 方法
1.2.1 活性药物成分吸附试验
根据产品实际过滤的工艺参数,按照47 mm GVWP 膜片的规格等比例缩小流程工艺参数(如体积、压力),模拟吸附试验工艺参数如表1。

表1 吸附试验条件对照
采用3 批次过滤膜片(分别编为试验A、B、C)和1 批次rhGM-CSF 药液进行上述的模拟过滤吸附试验,对未过滤药液(过滤体积0 mL)、过滤体积5、10、15、20、25、30、35、40、45、50、60、80、92 mL药液进行连续取样及所有滤出液的汇集滤液共15个样点,测定药液中活性成分rhGM-CSF 浓度。按公式:浓度(%)=(样品浓度/未过滤药液浓度)×100%计算,在此测试中,未过滤药液浓度视为100%。
1.2.2 滤器可提取物试验
根据默克Millipore 公司开发的模型溶剂方法来检测可提取物,采用与实际工艺相同或更差条件进行,模型溶剂近似于实际药液。模型溶剂的选择与试验条件选择如表2~3。

表2 模拟溶剂选择分析

表3 可提取物试验条件对照
采用3 批次的过滤器按上述试验条件进行可提取物试验,对测试后的样品进行不挥发物(NVR)、总有机碳(TOC)、反向高效液相色谱(reversed phasehigh performance liquid chromatography,RP-HPLC)测定,当提取溶液的RP-HPLC 色谱图中出现峰高≥10 mAU 的色谱峰,而阴性样品中没有出现该峰,则将提取液用于傅里叶变换红外光谱(Fourier trans form infrared spectroscopy,FTIR)分析、组件分析进行标准品研究,进一步鉴定具有紫外吸收的化合物。
1.2.3 滤器兼容性试验
采取rhGM-CSF 药液在除菌过滤生产中的最高温度及最长过滤接触时间等最差条件进行,包括膜片兼容性测试和过滤器兼容性测试,试验条件如表4。
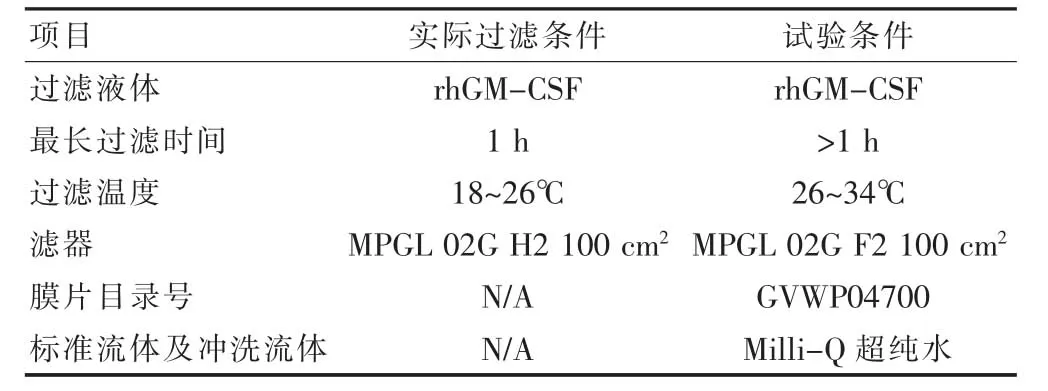
表4 兼容性试验条件对照
1.2.3.1 膜片兼容性测试 初始膜片称重后,用纯水在室温、10 psi 压力下进行过滤测试,并记录初始纯水的流速,再测试初始纯水的泡点值。之后用rhGMCSF 药液进行循环过滤,过滤温度26~34℃,膜片接触药液时间不短于1 h,之后测定产品泡点值,并观察膜片是否有膨胀、变色、脱落等可观察到的物理变化。膜片再用纯水冲洗干净,测定最终纯水的泡点值。最后用纯水在室温、10 psi 压力下进行测试,并记录最终纯水的流速,测试完成后,干燥膜片称重。进行3次重复测试。按公式计算:泡点率=产品泡点值/初始纯水的泡点值,预估的最低产品泡点值=标准流体最低泡点值×泡点率平均值。1.2.3.2 滤器兼容性测试 用rhGM-CSF 药液进行循环过滤,过滤温度26~34℃,接触药液时间不短于1 h,测定产品泡点值,并观察过滤器是否有膨胀、变色、脱落等可观察到的物理变化。产品的泡点值应大于预估的最低产品泡点率。
2 结果
2.1 吸附性试验结果
活性药物成分rhGM-CSF 过滤前后浓度测试结果见表5所示,未见明显吸附性损失,在产品工艺可控范围。
2.2 可提取物试验结果
滤器的模型溶剂可提取物试验,结果如表6所示,等比缩小后每个Millipak 20 过滤器可提取的NVR总量为0.5 mg,TOC 为0.3 mg。FTIR 和RP-HPLC 图谱见图1~2,分析鉴定的化合物为聚丙烯酸酯,为滤器的组成材料,经EMD Millipore 公司按照塑料的USP 六级生物安全测试和USP 小鼠安全测试标准,该材料无生物毒性。

表5 吸附试验样点浓度
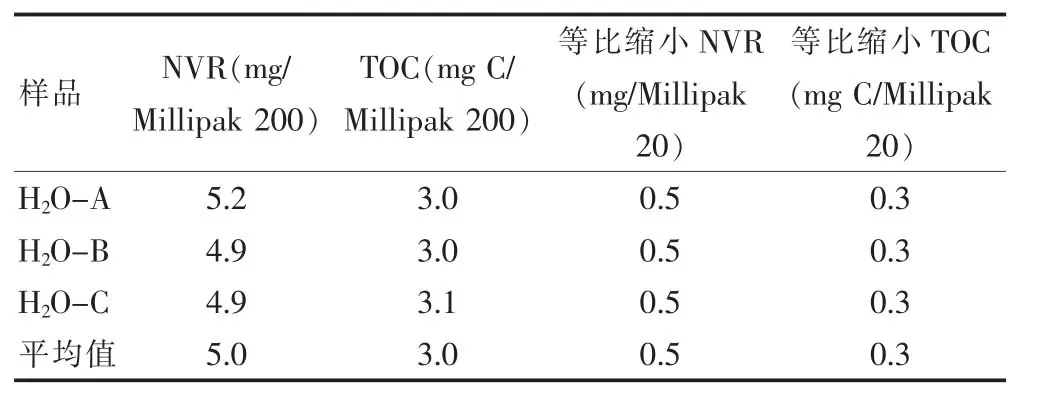
表6 NVR、TOC 的结果分析
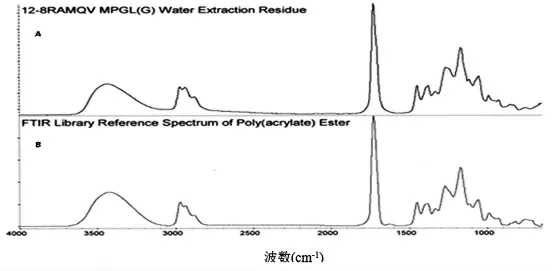
图1 水提取物残留与实验室标准品FTIR 光谱


图2 阴性对照和可提取物RP-HPLC 图谱
2.3 兼容性试验结果
膜片兼容性测试膜片泡点结果、重量变化、流速变化见表7~9,根据膜片泡点试验结果预估产品泡点最小值为46.4 psi,滤器兼容性测试中产品泡点值为48 psi,产品的泡点值大于预估的产品泡点最小值,且测试的膜片和滤器的外观均无明显变化,以上结果表明不存在兼容性问题。
3 讨论
过滤工艺过程影响因素较多,在考察药液和滤器的相互影响时,对关键工艺参数模拟接近生产或更差条件进行确认研究。吸附性试验关注目标药物成分被吸附的影响,采取缩小滤器规格,减少药液使用量,模拟过滤前后活性成分的含量变化,吸附效应越小,成分含量变化越小。由于实际药液中的成分会增加NVR、TOC、HPLC 等分析背景信号,从而很难准确检测出微量的可提取物成分,选择模拟溶剂可模拟实际药液的提取能力。本研究模型溶剂是根据药液溶剂为水相,药液(pH 6.5~7.5)与Milli-Q 超纯水(pH 6~8)相近,且超纯水比注射用水中的有机化合物含量更低的原则进行选择。在试验滤器方面也选择了放大,扩大过滤面积,尽可能富集模型溶剂的可提取物,便于检测分析。滤器兼容性试验主要考察过滤过程中药液与滤膜是否发生物理化学反应,从而引起滤膜的性质变化,采用单片滤膜测试,能更好地观察和测试滤膜相关性质。本研究结果提示,rhGM-CSF 注射液所采用的过滤器及滤膜材质在吸附性、可提取物、兼容性方面均符合公司药品的质量要求,能够为过滤工艺确认及评估提供一定的数据支持。

表7 膜片泡点的结果分析

表8 重量变化分析

表9 流速变化分析
本次研究由于模拟条件基于关键工艺参数选择、验证成本及检测手段局限性等多方面的原因,与实际药液的生产过滤条件仍存在差异。对于药液无菌过滤工艺的确认,不仅仅需要确认药液与滤器之间的相互影响,仍需证明过滤器在实际过滤条件下滤除微生物的能力,进一步在完成微生物挑战、细菌截留试验、完整性测试、产品实际生产过程的质控监测等一系列的控制手段,完整验证无菌过滤工艺的有效性[17-18],系统地为企业药品过滤生产工作的开展提供科学依据。
