线粒体膜Kir6.1/K-ATP通道对脑缺血预处理大鼠神经功能的修复作用及机制
2021-01-29宋笑雨刘开扬薛茜杨金水张宇胡雪霄邹玉安
宋笑雨 刘开扬 薛茜 杨金水 张宇 胡雪霄 邹玉安
脑缺血可诱发一系列生理病理变化,如能量障碍、氧化应激、炎症和凋亡等,最终导致脑组织发生级联性损伤[1-2]。线粒体作为主要能量代谢细胞器,其内存在大量的关键性酶,参与机体的氧化磷酸化等ATP合成过程,为机体活动提供能量;当机体受到凋亡信号刺激时,线粒体膜受损,进而导致线粒体膜电位和线粒体膜通透性发生改变,释放相应的细胞因子,诱导细胞凋亡[3-4]。ATP敏感性钾通道(ATP-sensitive potassium channel,K-ATP)是偶联细胞代谢与电信号的生物感受器,广泛分布于神经系统中,参与多种脑部疾病的发生。内向整流钾通道(inwardly rectifying potassium channel,Kir)亚基主要包括Kir 6.1和Kir 6.2,其中Kir6.1亚基主要表达于星形胶质细胞、小胶质细胞和神经干细胞,并于内质网和线粒体中高表达。研究表明Kir6.1/K-ATP在脑损伤过程中发挥重要作用[5-6],脑缺血预处理能够通过调节Kir6.1/K-ATP通道发挥神经保护作用,但其具体作用机制尚不清楚。本研究采用脑缺血预处理实验大鼠模型探讨Kir6.1/K-ATP通道在缺血性脑损伤中的作用及其作用机制,以期为治疗脑缺血所诱发的病理性损伤提供新的理论依据。
1 对象和方法
1.1 实验动物SPF级雄性SD大鼠72只,由北京华阜康生物科技股份有限公司提供,体重(220±20)g,许可证号SCXK(京)2017-0008。大鼠均饲养在恒温、恒湿环境下,自由饮食、饮水。将大鼠随机分为假手术组、脑缺血模型组和脑缺血预处理组,每组各24只。每组大鼠再随机分为造模术后12、24、36和48 h亚组,各时间点6只。
1.2 主要试剂和仪器Trizol试剂盒、荧光定量PCR购自Thermo Fisher Scientific公司,细胞色素C(Cyt-c)抗体、半胱氨酸蛋白酶-3(Caspase-3)抗体、B淋巴细胞瘤-2基因(Bcl-2)抗体、Bcl-2相关X蛋白(Bax)抗体和Kir6.1抗体购自Sigma公司,二喹啉甲酸(BCA)试剂盒购自南京建成生物科技有限责任公司,氯化三苯基四氮唑(TTC)试剂、线粒体分离试剂盒购自Sigma-Aldrich公司,线粒体膜通透性转换孔(mPTP)检测试剂盒购自北京百奥莱博科技有限公司,线粒体膜电位试剂盒(JC-1)为Abcam公司产品。主要仪器包括显微镜(OLYMPUS公司)、高速冷冻离心机(Thermo Fisher Scientific公司)、酶标仪(Bio-Rad公司)。
1.3 方法
1.3.1脑缺血模型的建立:采用改良Zea Longa线栓法[7]栓塞大鼠右侧大脑中动脉2 h。缺血预处理组则于造模前预先给予大鼠大脑中动脉栓塞10 min,然后从颈外动脉轻轻抽出栓线,完成预缺血,3 d后再次麻醉大鼠,按文献[7]方法进行大脑中脉栓塞2 h。假手术组则仅分离右颈总动脉。大鼠术后均注意保温。
1.3.2神经功能缺损评分:于造模术后大鼠清醒后,采用Zea Longa 评分法对大鼠神经功能损伤进行评价:0分为正常,无任何神经损伤症状;1分为不能够完全伸展对侧前爪;2分为向外侧转圈;3分为向对侧倾倒;4分为不能自发行走,意识丧失。
1.3.3大鼠脑梗体积测定:采用2,3,5-三苯基氯化四氮唑(MTT)法测定脑梗死体积。于造模术后12、24、36和48 h时间点处死大鼠并立刻取损伤侧脑组织,采用冷冻切片法取2 mm厚脑冠状切片,置于2%(体积分数)的TTC溶液中30 min,甲醛固定。利用Paxinos-Watson图谱,以第三脑室和侧脑室作为定位标志,取切片同一区域拍照,然后采用Image J图像分析软件进行数据分析,计算脑梗死面积百分比。
1.3.4Western blot检测脑组织凋亡相关蛋白:分别于造模术后12、24、36和48 h时间点处死大鼠并迅速取脑组织20 mg,采用液氮研匀后,加入细胞裂解液冰浴放置1 h,期间不断涡旋。4℃下以1006.2g离心15 min后取上清,采用BCA试剂盒法测定大鼠脑组织匀浆蛋白含量。然后加入缓冲液,进行凝胶电泳以分离目的蛋白,恒流转膜后加入一抗孵育过夜,TBST洗涤3次后加入荧光二抗,在37℃、避光条件下孵育2 h,经TBST洗涤3次后,采用Image J凝胶成像分析系统测量目的条带吸光度;以β-butulin为内参,计算目的蛋白的相对表达量。
1.3.5线粒体膜Kir6.1/K-ATP通道表达测定:分别于造模术后12、24、36和48 h时间点取大鼠脑组织,采用线粒体分离试剂盒提取脑组织中的线粒体,基于Western blot实验方法检测线粒体膜上Kir6.1蛋白的表达。
1.3.6线粒体膜电势及线粒体膜通透性测定:分别于造模术后12、24、36和48 h时间点取大鼠脑组织,匀浆后用差速离心法提取线粒体,用BCA法测量线粒体中蛋白含量,用线粒体保存液调整各样本浓度为1 g/L。使用酶标仪,按照线粒体通透性转化孔检测试剂盒和线粒体膜电位试剂盒说明书分别检测线粒体膜电势及线粒体膜通透性,于450 nm波长检测其吸光度值。
1.3.7荧光定量PCR测定脑组织miR-7水平:分别于造模术后12、24、36和48 h时间点取大鼠脑组织,按Trizol试剂说明书检测各组脑组织miR-7水平。提取大鼠脑组织总RNA,紫外分光光度计检测RNA纯度,使总RNA产物在260~280 nm波长处吸光度比值为1.8~2.0。用RT逆转录试剂盒逆转录成cDNA,以cDNA为模板,建立qPCR体系,检测miR-7表达量,从而预测miR-7是否与线粒体膜上Kir6.1/K-ATP通道之间具有相关性。引物序列由天根生物有限公司合成,miR-7引物序列如下:RT:5′-AGCATTCGTCTCGACACAGCAACAAAATC-3′,Forward:5′-TGACTCTGCTGGAAGACTAGTG-AT-3′,Reverse:5′-TAGAGCATTCGTCTCGACACAG-3′;内参U6引物序列如下:RT:5′-AAC-GCTTCACGAATTTGCGT-3′,Forward:5′-CTC-GCTTCGGCAGCACA-3′,Reverse:5′-AACGCTTCACGAATTTGCGT-3′。
1.4 统计学处理采用SPSS 20.0软件进行统计分析,对数据进行正态性和方差齐性检验,符合正态分布的计量资料以均数±标准差表示,多组间比较采用重复测量方差分析,两两比较采用LSD-t法。以P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠神经功能缺损评分假手术组大鼠无神经功能缺损症状,模型组和缺血预处理组大鼠出现不同程度神经功能缺损症状。模型组和缺血预处理组Zeal Longa评分变化存在组间与时间因素的交互作用(F=34.022,P<0.01),且两组大鼠随时间延长Zeal Longa评分均明显改善(P<0.05)。造模24、36、48 h时模型组Zeal Longa评分均高于缺血预处理组(P<0.05)。结果见表1。

表1 各组大鼠脑缺血造模术后不同时间Zeal Longa评分比较
2.2 各组大鼠脑梗体积比较假手术组未见脑梗死病灶,模型组和缺血预处理组大鼠可见明显脑梗死病灶。模型组和缺血预处理组脑梗死体积变化存在组间与时间因素的交互作用(F=69.034,P<0.01),模型组大鼠随时间延长脑梗死体积增大(P<0.01),而缺血预处理组各时间点间比较无统计学差异(P>005)。造模24、36、48 h时模型组脑梗死体积均高于缺血预处理组(均P<0.05)。结果见表2。
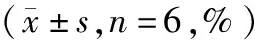
表2 各组大鼠脑缺血造模术后不同时间脑梗体积比较
2.3 各组大鼠脑组织凋亡相关蛋白表达假手术组、模型组及缺血预处理组大鼠脑组织Bax(F=20.089,P<0.01)、Caspase-3(F=40.121,P<0.01)、Cyt-c(F=48.092,P<0.01)蛋白水平变化存在组间与时间因素的交互作用,而Bcl-2蛋白水平未存在组间与时间的交互作用(F=1.908,P=0.391)。模型组和缺血预处理组大鼠Bax(F=5.023,P<0.05;F=3.800,P<0.05)、Caspase-3(F=13.792,P<0.01;F=3.121,P<0.05)、Cyt-c(F=12.156,P<0.05;F=9.023,P<0.05)蛋白水平在各时间点间比较均存在统计学差异,而假手术组大鼠Bax(F=0.986,P>0.05)、Caspase-3(F=0.871,P>0.05)、Cyt-c(F=1.134,P>0.05)蛋白水平在各时间点间比较无统计学差异。造模24、36和48 h时,模型组Bax、Caspase-3及Cyt-c蛋白表达水平均高于假手术组(均P<0.05),而缺血预处理组24、36和48 h时Bax、Caspase-3及Cyt-c蛋白水平较模型组低(均P<0.05)。具体结果见图1和图2。

注:Bax:Bcl-2相关X蛋白,Bcl-2:B淋巴细胞瘤-2基因,Caspase-3:半胱氨酸蛋白酶-3,Cyt-c:细胞色素C;图2同。Kir:内向整流钾通道,图3同

注:与假手术组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01
2.4 脑缺血预处理对线粒体膜Kir6.1蛋白表达的影响假手术组、模型组及缺血预处理组大鼠脑组织线粒体膜Kir6.1蛋白表达变化存在组间与时间的交互作用(F=22.674,P<0.01)。缺血预处理组大鼠Kir6.1蛋白水平在各时间点间比较存在统计学差异(F=3.102,P<0.05)。假手术组和模型组大鼠Kir6.1蛋白在各时间点间的比较无统计学差异(F=0.865,F=0.537,均P>0.05)。造模24、36和48 h时,模型组Kir6.1蛋白水平低于假手术组(均P<0.05),而缺血预处理组其水平均高于模型组(均P<0.05)。具体结果见图1和图3。

注:与模型组比较,aP<0.05
2.5 脑缺血预处理对线粒体膜电势及线粒体膜通透性的影响假手术组、模型组及缺血预处理组大鼠线粒体膜电位光密度及膜通透性转换孔平均光密度变化存在组间与时间的交互作用(F=18.888,
F=12.043,均P<0.01)。造模24、36和48 h时,模型组线粒体膜电位光密度及膜通透性转换孔平均光密度均低于假手术组(均P<0.05),且模型组低于缺血预处理组(均P<0.05)。具体结果见图4、5。

注:mPTP:线粒体膜通透性转换孔,图5同
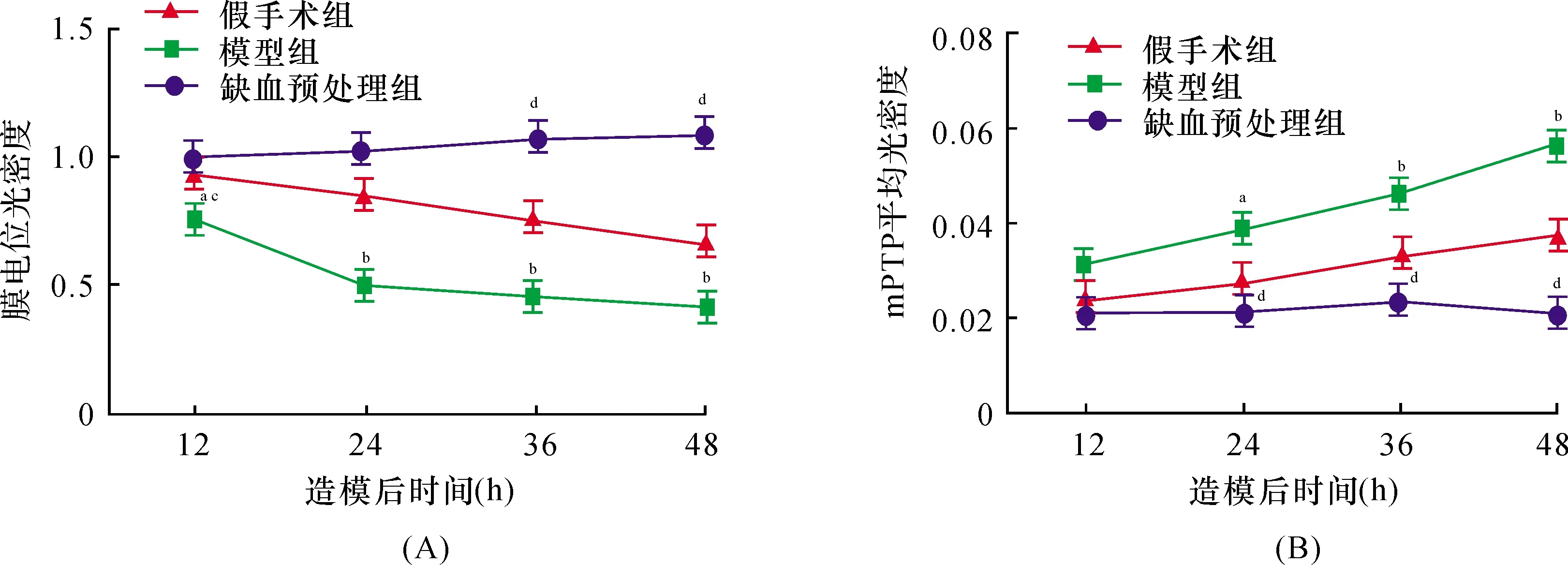
注:与假手术组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01
2.6 脑缺血预处理对脑组织miR-7表达的影响假手术组、模型组及缺血预处理组大鼠脑组织miR-7表达变化存在组间与时间的交互作用(F=6.003,P=0.007),但3组大鼠脑组织miR-7表达变化均无时间效应(均P>0.05)。造模12、24、36和48 h时,模型组miR-7表达水平均低于假手术组(均P<0.05),造模48 h时,缺血预处理组miR-7表达量高于模型组(P<0.05)。具体结果见图6。

注:与模型组比较,aP<0.05
3 讨论
脑组织对缺血、缺氧等极为敏感。脑缺血再灌注后诱发的神经元凋亡在脑缺血性损伤的病理过程中占据主导地位。研究表明,大鼠在大脑缺血再灌注后,其脑组织缺血、缺氧,进而导致能量代谢异常,诱发神经细胞过度凋亡,脑梗体积显著性增加。缺血性预处理能够激活机体脑部潜在的保护作用机制,减少由脑缺血所诱发的脑梗死面积和抑制神经元凋亡等过程,进而有效减轻脑缺血所导致的脑损伤[8-9]。本研究结果显示,缺血预处理能够明显改善脑缺血大鼠Zeal Longa评分,抑制脑梗死体积增大,并能调节大鼠脑组织凋亡蛋白异常表达。
线粒体是细胞活动的控制中心,是细胞呼吸和氧化磷酸化的中心,参与调节能量代谢和细胞内环境的稳态,在整合各种机体刺激信号、决定细胞功能及状态的过程中发挥重要作用。研究表明[10-12],线粒体功能障碍在神经元凋亡及缺血性脑卒中发展中起至关重要的作用,但其具体生理变化机制仍不明确。因此,学者们开始着眼于缺血性脑卒中线粒体功能变化与脑损伤的关联机制研究,旨在以为缺血性脑卒中临床治疗提供新的方向[13-15]。
Kir6.1/K-ATP通道广泛分布于哺乳动物各种组织器官中,在神经细胞功能及其稳态的维持过程中起重要作用,可参与神经元再生、凋亡及细胞周期调控等过程,具有调节线粒体代谢活动的功能[16]。Kir6.1/K-ATP通道与缺血后所诱发的神经炎症反应密切相关,当给予Kir6.1/K-ATP通道抑制剂时,则会导致脑缺血所引发的炎性级联反应加重,且能减弱Kir6.1/K-ATP开放剂抑制炎症的作用甚至使其无效[16]。脑缺血预处理能够诱发该离子通道开放,进而减弱小胶质细胞活化所诱发的炎症级联反应,发挥神经保护作用[17-19]。本研究结果显示,脑缺血性损伤导致Kir6.1蛋白表达异常降低,提示Kir6.1/K-ATP通道被异常活化,当经脑缺血预处理后,实验大鼠脑组织Kir6.1蛋白明显回调,表明脑缺血预处理与Kir6.1/K-ATP通道具有密切关联。
本研究亦发现,造模24、36和48 h时,模型组Bax、Caspase-3及Cyt-c蛋白表达水平均高于假手术组,而缺血预处理组其水平较模型组低,表明缺血预处理可改善神经细胞凋亡。多种凋亡途径均通过线粒体膜发挥作用。mPTP的开放与细胞凋亡具有密切关系[7]。本研究发现,模型组线粒体膜电位光密度及膜通透性转换孔平均光密度低于缺血预处理组。此外,miR-7与脑缺血性损伤也具有密切关系,其可调节神经元凋亡、炎症反应等过程,进而发挥神经保护作用[20]。本研究结果显示,脑缺血性损可导致大鼠脑组织miR-7表达降低,表明脑缺血性损伤与miR-7异常表达有关。
综上所述,本研究结果显示,脑缺血预处理能够有效阻止或减弱脑缺血所导致的神经功能损伤和神经元凋亡,并能有效改善线粒体跨膜电位和线粒体膜通透性,这可能与其调节Kir6.1/K-ATP通路具有密切关系。
