可视化RPA-LFD技术快速检测美人鱼发光杆菌
2021-01-28杨宇婷林如梦吴江春李奕娴
余 庭,蒋 晗,杨宇婷,林如梦,吴江春,李奕娴,朱 诚
(中国计量大学 生命科学学院 浙江省海洋食品品质及危害物控制技术重点实验室,浙江 杭州 310018)
美人鱼发光杆菌(Photobacteriumdamselae)是一种嗜盐的革兰氏阴性菌,呈杆状或者球状,它分为美人鱼亚种(P.damselaesubsp.damselae)和杀鱼亚种(P.damselaesubsp.piscicida),两者的重要区别是美人鱼亚种含有特异基因ureC。美人鱼发光杆菌分布范围广,致病性强,是养殖鱼类的重要致病菌[1-2]。此外,它还可以通过食物链或伤口感染等途径感染人类或哺乳动物,引起败血症,对公众健康造成重大危害[3-4]。近年来,国内外养殖鱼类感染美人鱼发光杆菌的病例逐渐增大,给鱼类养殖业造成巨大损失[5-6]。因此,建立一种快速、准确、有效的检测美人鱼发光杆菌的方法,对海水养殖业和食品安全管理具有重要意义。
目前,对美人鱼发光杆菌的检测,主要是采用传统的细菌分离鉴定、生理生化鉴定和基于PCR技术的分子检测[4,6-7]等方法。然而这些方法耗时长、操作复杂,且需要专业的仪器设备和技术人员。重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)是一种高效的恒温核酸扩增技术,可在常温条件下实现核酸指数扩增,具有反应灵敏、高效、性价比高的特点,一般在30 min以内即能获得可检出水平的扩增产物[7-10]。通过与荧光基团标记,RPA扩增产物可与侧流层析试纸条(lateral flow dipstick,LFD)相结合,实现扩增产物的可视化检测。RPA技术自2006年发明以来发展迅速,在动物疫病诊断、微生物及其耐药性检测等领域均得到了很好的应用。如RPA技术已成功应用到日本血吸虫、猪嵴病毒、布鲁氏菌和磺胺耐药基因等的检测中,并结合LFD,其检测结果在2~5 min内直接可视[11-14]。虽然RPA-LFD技术存在易因气溶胶污染导致假阳性等弱点,但其检测时间短、灵敏度高、无需仪器且常温下即可反应等优势,其在基层检测领域有较好的应用前景。
本项目以美人鱼发光杆菌特异基因bamB和美人鱼发光杆菌美人鱼亚种特异基因ureC为检测靶标基因[15],采用RPA技术进行核酸扩增,并结合侧流层析技术,建立一种快速、准确、有效的美人鱼发光杆菌及其亚种的可视化检测方法,这对美人鱼发光杆菌的快速检测、早期预警、保障水产养殖安全和公众健康具有重要意义。
1 材料与方法
1.1 菌株与试剂
金黄色葡萄球菌GIM 1.644、大肠杆菌GIM 1.173、肠炎沙门氏菌肠炎亚种GIM 1.345、副溶血性弧菌GIM 1.306、霍乱弧菌GIM 1.449、鲍曼不动杆菌GIM 1.650、绿脓杆菌GIM 1.220、嗜水气单胞菌GIM 1.551、美人鱼发光杆菌美人鱼亚种GIM 1.1032均购买于广东省微生物菌种保藏中心。其余美人鱼发光杆菌美人鱼亚种和杀鱼亚种为本实验室前期分离保藏菌种。营养琼脂、LB肉汤、血平板、3%NaCl碱性蛋白胨水均购买于青岛海博生物技术有限公司,细菌基因组提取试剂盒和Premix Ex Taq(Probe qPCR)试剂盒购买于TaKaRa公司,RPA相关试剂盒TwistAmp Basic Kit,LFD纸质条及金标抗体和缓冲液等侧流层析相关试剂购自英国TwistDx公司。
1.2 细菌培养及基因组DNA提取
各菌株按照菌株使用说明书进行复苏增菌,挑取单菌落至液体培养基中增菌,按照细菌基因组试剂盒使用说明提取细菌基因组,保存于-20 ℃备用。
1.3 浓度梯度样品稀释
取OD600为1.0的美人鱼发光杆菌及其亚种培养液1 mL,按照10倍梯度进行稀释并进行平板活菌计数,每组浓度3个平行,取平均值计算原液中的细菌数量。将经活菌计数的美人鱼发光杆菌及其亚种培养液进行10倍稀释,109~100CFU/mL的浓度梯度的菌液,分别用试剂盒方法提取DNA,获得浓度梯度标准品。
1.4 引物设计与RPA-LFD检测原理
根据NCBI中美人鱼发光杆菌的bamB(NZ_CP035780.1)序列及美人鱼发光杆菌美人鱼亚种特异基因ureC(NZ_CP035782.1)序列,利用Primer Premier 5.0软件设计RPA引物,利用Beacon Designer 7设计荧光定量PCR引物和Taqman探针。引物和探针序列见表1,由上海生工生物工程有限公司合成。

表1 RPA扩增和荧光定量PCR扩增引物与探针序列
RPA-LFD检测原理如图1。bamB基因上游引物bamB-LF标记Digoxin,下游引物标记FAM;ureC基因上游引物ureC-F标记Digoxin,下游引物标记Biotin。侧流层析试纸条C线标记有二抗,T1线标记有抗FAM抗体,T2线标记有抗Biotin抗体。bamB基因和ureC基因RPA扩增产物在试纸条层析时与标记的相应抗体结合,同时抗Digoxin金标抗体可与C线标记的二抗和带Digoxin标记的RPA扩增产物结合,从而实现试纸条的C线、T1线和T2线显示。
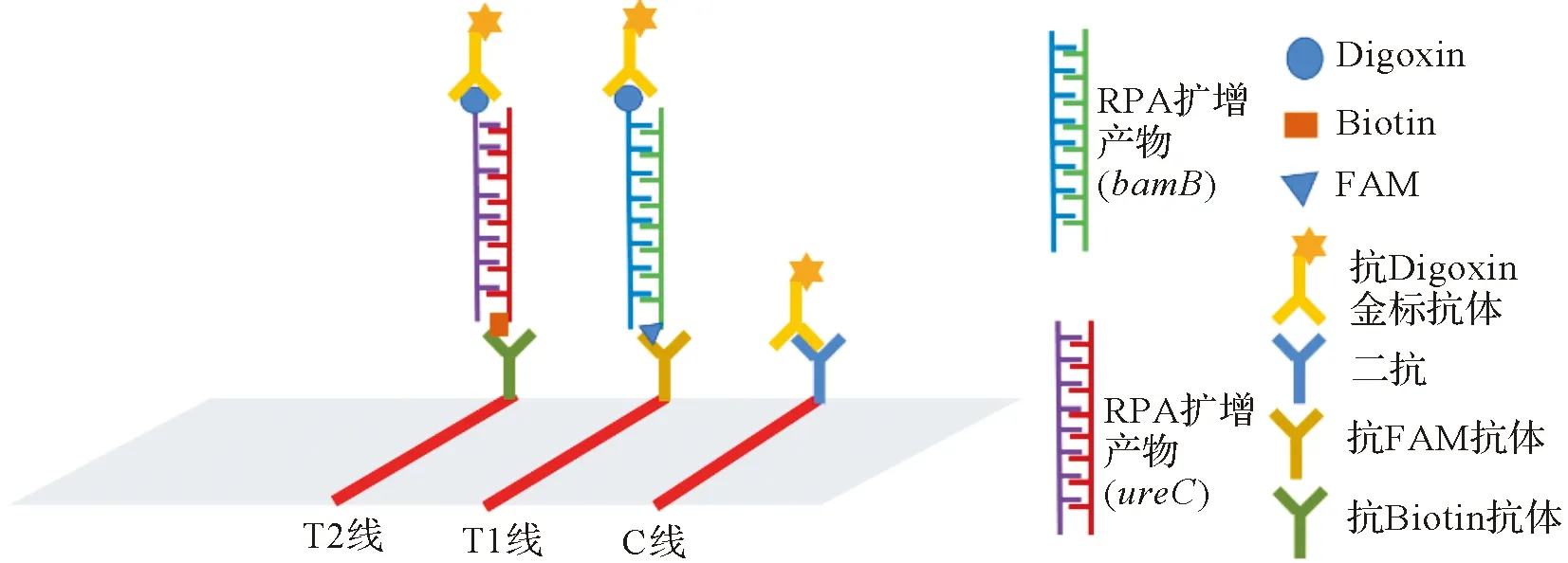
图1 RPA-LFD检测原理图Figure 1 Diagram of RPA-LFD detection principle
1.5 RPA-LFD的反应条件及优化
根据TwistAmp Basic Kit试剂盒使用说明,配制50 μL RPA反应体系:25 μL 2×RE reaction buffer、11.5 μL ddH2O、各2 μL引物(10 μmol/L)、2 μL酶工作液、1 μL DNA模板和2.5 μL的醋酸钠溶液(280 mmol/L)。在37 ℃反应20 min。取2 μL的反应产物加入到98 μL的PBST(0.05%吐温20)缓冲溶液中,将试纸条插入缓冲液中室温放置5 min后观察结果。为提高两个目标基因的扩增效率,对RPA-LFD试验的引物浓度、反应温度和反应时间进行了优化。根据试剂盒建议的RPA反应最优引物浓度范围,共设置了8组引物浓度比例优化获得最优引物浓度,bamB基因引物和ureC基因引物浓度(nmol/L)比依次为:200∶200;300∶200;300∶300;400∶300;400∶400;500∶400;500∶500和600∶600。在引物浓度优化的基础上对反应温度(35 ℃,37 ℃,39 ℃,41 ℃,43 ℃,45 ℃,47 ℃)、反应时间(5,10,15,20,25,30 min)进行优化。见图2。

注:(a)1—0∶0;2—200∶200;3—300∶200;4—300∶300;5—400∶300;6—400∶400;7—500∶500;8—600∶600;(b)1—35 ℃;2—37 ℃;3—39 ℃;4—41 ℃;5—43 ℃;6—45 ℃;7—47 ℃;8—阴性对照;(c)1—30 min;2—25 min;3—20 min;4—15 min;5—10 min;6—5 min;7—阴性对照
1.6 特异性试验
以金黄色葡萄球菌、大肠杆菌、肠炎沙门氏菌肠炎亚种、副溶血性弧菌、霍乱弧菌、鲍曼不动杆菌、绿脓杆菌、嗜水气单胞菌、美人鱼发光杆菌美人鱼亚种、美人鱼发光杆菌杀鱼亚种共10种菌种基因组DNA分别作为RPA模板,无菌水作为阴性对照,采用前期已优化的反应体系进行RPA-LFD试验,以评估其特异性。
1.7 灵敏度试验
分别将1.3节制备的浓度梯度标准品作为模板,采用优化后的RPA-LFD反应条件,进行美人鱼发光杆菌RPA-LFD方法的灵敏度试验。同时,与常规荧光定量PCR方法灵敏度进行比较分析。qPCR反应体系为25 μL∶12.5 μL 2×Premix Ex Taq(Probe qPCR) buffer,0.5 μL Forward Primer,0.5 μL Reverse Primer,1 μL Taqman Probe,1 μL 模板和9.5 μL无菌水。反应程序为:95 ℃ 30 s;95 ℃ 30 s,60 ℃ 30 s,40个循环。
1.8 实际样品试验
选取黄鱼养殖基地的50份病鱼样本和美人鱼发光杆菌阳性样品6份(美人鱼亚种5份,杀鱼亚种1份)。参考食品卫生微生物学检测国家标准进行样品处理,将样本均质液接种于营养琼脂上,30 ℃培养12 h,挑取单菌落接种于血平板上,30 ℃培养12 h,挑取有溶血环菌落于3% NaCl碱性蛋白胨水中进行增菌。取2 mL菌液离心后提取基因组。对比生化特性分析和常规荧光定量PCR方法,用建立的美人鱼发光杆菌RPA-LFD方法进行菌株鉴定,以结果的一致性评估该方法在实际样品的实用性[1,4,7]。
2 结果与分析
2.1 RPA-LFD反应条件优化
引物浓度优化、反应温度和反应时间优化结果如图2:不同引物浓度条件下进行RPA-LFD试验,在试纸条检测线上均可出现目标检测条带。其中,bamB基因引物浓度与ureC基因引物浓度均为400 nmol/L时,目标检测线较为清晰。在反应温度优化试验中,37~43 ℃的反应温度条件下,目标检测线较为清晰,综合考虑检测应用,选取37 ℃为最优反应温度。在反应时间优化试验中,反应5 min即可看到检测线,在15 min后检测线亮度无明显差别,选取15 min为最优反应时间。
2.2 特异性试验
对2种美人鱼发光杆菌和其他8种水产中常见病原菌进行特异性检测及美人鱼发光杆菌亚种分类检测试验中,美人鱼发光杆菌美人鱼亚种显示出2条检测线,杀鱼亚种显示1条检测线,其他菌株未出现检测线,显示阴性,检出结果与常规荧光定量PCR结果一致(图3)。结果表明本研究建立的美人鱼发光杆菌RPA-LFD检测方法特异性良好,且能鉴定到美人鱼发光杆菌美人鱼亚种。

注:M-TaKaRa DL 1000 marker;1—美人鱼发光杆菌美人鱼亚种;2—美人鱼发光杆菌杀鱼亚种;3—金黄色葡萄球菌;4—大肠杆菌;5—肠炎沙门氏菌肠炎亚种;6—副溶血性弧菌;7—霍乱弧菌;8—鲍曼不动杆菌;9—绿脓杆菌;10—嗜水气单胞菌;11—阴性对照
2.3 灵敏度试验
在最佳的RPA-LFD反应体系下,以109CFU/mL、108CFU/mL、107CFU/mL、106CFU/mL、105CFU/mL、104CFU/mL、103CFU/mL、102CFU/mL、101CFU/mL和100CFU/mL系列稀释度菌液的基因组DNA为反应模板进行RPA-LFD灵敏度试验。结果显示,本研究建立的美人鱼发光杆菌低浓度为101CFU/mL,如图4(a),4(b),与常规荧光定量PCR方法结果一致,如图4(c)。

注:M—DL2000 marker;1—109 CFU/mL;2—108 CFU/mL;3—107 CFU/mL;4—106 CFU/mL;5—105 CFU/mL;6—104 CFU/mL;7—103 CFU/mL;8—102 CFU/mL;9—101 CFU/mL;10—100 CFU/mL;11—阴性对照
2.4 实际样品检测
在本次留样样品的复检中,本研究建立的美人鱼发光杆菌RPA-LFD方法检出结果与生化特性分析和荧光定量PCR方法结果一致,均检出美人鱼发光杆菌杀鱼亚种阳性5份,美人鱼亚种1份,无假阴性情况(表2)。该方法与生化特性分析和荧光定量PCR方法相比,检测时间明显缩短,检测便捷性明显提高。生化特性分析方法需要过夜培养,荧光定量PCR方法需要扩增1.5 h以上,且均依赖于生化鉴定系统和荧光定量PCR仪等大型仪器。然而本文的检测方法可在15 min完成扩增、30 min内完成检测,且检测结果可直接通过试纸条判定,从而大大提高了检测效率,且适合基层推广。

表2 不同方法在实际样品检测中的应用
3 讨 论
本研究以RPA技术为基础,建立了美人鱼发光杆菌可视化的双重RPA-LFD检测方法。本方法以美人鱼发光杆菌特异基因bamB和美人鱼亚种特异基因ureC为靶标序列,当bamB、ureC引物浓度均为400 nmol/L,反应温度为37 ℃,反应时间为15 min时,该方法的扩增效率最高,且特异性好,检测灵敏度高。在实际样品检测应用中,该方法与细菌培养法和荧光定量PCR法检出结果一致,检测准确高。本研究将RPA-LFD方法应用到美人鱼发光杆菌的检测,实现了双检测靶标的可视化同步检测。本方法较传统生化特性分析和常规荧光定量PCR方法,大大缩短了检测时长,降低了对昂贵仪器设备及专业技术人员的依赖性,能很好满足基层检测。目前,水产高密度集约化养殖模式引发的水产疾病时有发生,而加强对水体环境和相关水产中致病菌的检测,对水产养殖业和人类健康具有重要意义。本文研究建立的美人鱼发光杆菌可视化RPA-LFD检测方法,可为水产品中其他致病菌微生物的快速检测研究提供借鉴。
