化湿汤对溃疡性结肠炎模型大鼠的治疗作用及机制研究※
2021-01-28刘会丽聂晓博李艳红陈艳从袁榴翼刘晓兰
刘会丽 聂晓博 李艳红 陈艳从 袁榴翼 刘晓兰
(石家庄医学高等专科学校中医基础教研室,河北 石家庄 050599)
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性免疫介导性疾病,其发病原因仍不十分清楚,临床上多以氨基水杨酸类药物或激素类药物进行治疗,疗效虽好却不良反应较多[1]。近年来,研究人员开始关注采用中医药治疗UC,并认为UC多为湿邪积滞所致,临床常以健脾行气利湿为法[2]。自拟化湿汤是我们治疗UC的经验方,由经典方剂胃苓汤加减而来,临床应用其治疗UC效果显著。为进一步研究其作用机制,本研究通过观察化湿汤对UC模型大鼠的治疗作用,并从抗炎、抗氧化损伤角度初步进行机制探讨。
1 材料与方法
1.1 实验动物 SD雄性大鼠60只,无特定病原体(SPF)级,体质量180~220 g,饲养于屏障环境,喂饲灭菌常规饲料,自由饮用去离子水,购自斯贝福(北京)生物技术有限公司,实验动物许可证号:SCXK(京)2019-0010。
1.2 实验药物 化湿汤(药物组成:炒苍术8 g,炒白术8 g,制厚朴5 g,茯苓8 g,泽泻5 g,陈皮5 g,炙甘草3 g,以上药材均由河北省中医院中药房提供,并水煎浓缩至生药含量2 g/mL);美沙拉秦缓释颗粒(上海爱的发制药有限公司,国药准字H20143164)。
1.3 实验试剂及仪器 白细胞介素1β(IL-1β)及IL-10酶联免疫吸附(ELISA)试剂盒(上海森雄科技实业有限公司);一氧化氮(NO)、丙二醛(MDA)、超氧化物歧化酶(SOD)及髓过氧化物酶(MPO)试剂盒(南京建成生物工程研究所有限公司);CMax Plus光吸收型单功能酶标仪(美国Molecular Devices公司);DM500生物显微镜(德国Leica公司)。
1.4 实验方法
1.4.1 模型制备 所有大鼠适应性饲养3 d后,随机取50只大鼠采用三硝基苯磺酸(TNBS)制作UC模型[3]。首先用10%水合氯醛大鼠腹腔注射麻醉,然后将直径0.4 mm的胶管用石蜡油浸润后探入大鼠直肠内部,深约7~8 cm,注入TNBS,给药剂量为100 mg/kg,并将大鼠倒置30 s,使药液充分渗入肠腔,最后将大鼠四肢捆扎,限制自由活动5 d。
1.4.2 分组与给药 第6 d造模成功后,将模型大鼠随机分为模型组、阳性药物组(0.036 g/mL)、化湿汤低剂量组(0.5 g生药/mL)、化湿汤中剂量组(1 g生药/mL)、化湿汤高剂量组(2 g生药/mL),每组10只。另设10只大鼠为空白组。各组大鼠均按10 mL/kg灌胃,空白组及模型组予蒸馏水灌胃,阳性药物组予0.036 g/mL美沙拉秦缓释颗粒药液灌胃,化湿汤低、中、高剂量组分别予化湿汤0.5、1.0、2.0 g/mL药液灌胃,每日1次,连续灌胃10 d。
1.4.3 取材 各组大鼠在末次灌胃后,禁食12 h,将大鼠腹腔麻醉后通过腹主动脉取血,并分离血清备用。然后脱颈处死大鼠,剪取结肠组织,部分以4%多聚甲醛固定,-80 ℃冷冻保存。
1.5 观察指标及方法
1.5.1 一般情况 从开始造模第1、3、6、9、12、15 d分别记录各组大鼠的体质量,并观察毛色、粪便性状等一般情况。
1.5.2 结肠组织病理形态学观察 将4%多聚甲醛固定的结肠组织取出,石蜡包埋,切成4 μm组织切片,二甲苯脱蜡,乙醇梯度洗脱,苏木素-伊红(HE)染色,最后于100倍显微镜下观察组织病理形态学变化。
1.5.3 血清炎症因子检测 对各组大鼠血清IL-1β、IL-10及NO水平进行测定,IL-1β及IL-10采用ELISA法进行检测,NO采用硝酸还原酶法进行检测,均按试剂盒说明书进行操作。
1.5.4 结肠组织氧化损伤检测 各组取500 mg结肠组织置于匀浆管中打成匀浆,对结肠组织中MDA、SOD及MPO含量进行测定,MDA采用硫代巴比妥酸法(TBA)检测,SOD采用WST-1法检测,MPO采用化学比色法检测,均按试剂盒说明进行操作。

2 结 果
2.1 各组大鼠体质量及一般情况 空白组大鼠体质量逐渐增加,大鼠状态正常,毛色光亮,粪便成形。模型组大鼠体质量增加缓慢,精神萎靡不振,毛色枯槁,粪便稀溏,提示造模成功。阳性药物组及化湿汤低、中、高剂量组大鼠在灌胃治疗后体质量增加情况、精神状态、毛色及粪便性状均好于模型组。各组大鼠造模后第1、3、6、9、12、15 d体质量变化比较 见表1。
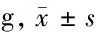
表1 各组大鼠造模后第1、3、6、9、12、15 d体质量变化比较
由表1可见,模型组大鼠造模后第3、6、9、12、15 d的体质量均低于空白组(P<0.05)。阳性药物组及化湿汤中、高剂量组造模后第15 d体质量均明显高于模型组(P<0.05),化湿汤低剂量组大鼠体质量虽较模型组也有增加,但差异无统计学意义(P>0.05)。化湿汤高剂量组大鼠造模后第15 d体质量明显高于化湿汤低剂量组(P<0.05),化湿汤中剂量组大鼠体质量虽较化湿汤低剂量组比较,也有升高趋势,但差异无统计学意义(P>0.05)。
2.2 各组大鼠结肠组织病理形态学变化 空白组大鼠结肠黏膜隐窝结构排列整齐,横截面可见杯状细胞。模型组大鼠结肠黏膜隐窝有分支,结构扭曲,表面不平整。阳性药物组大鼠结肠黏膜隐窝排列较整齐,仅上皮细胞有损伤。化湿汤低剂量组大鼠结肠黏膜隐窝排列杂乱,上皮细胞有明显损伤。化湿汤中剂量组大鼠结肠黏膜隐窝扭曲,上皮细胞损伤。化湿汤高剂量组大鼠结肠黏膜隐窝排列较整齐,但可见上皮细胞损伤。见封3,图1。
2.3 各组大鼠末次灌胃后血清IL-1β、IL-10及NO水平比较 见表2。
由表2可见,与空白组比较,模型组大鼠血清IL-1β和NO水平明显升高(P<0.05),IL-10水平明显下降(P<0.05)。与模型组比较,阳性药物组及化湿汤高剂量组大鼠血清IL-1β和NO水平明显降低(P<0.05),IL-10水平明显升高(P<0.05);化湿汤中剂量组大鼠血清IL-1β和NO水平较模型组明显降低(P<0.05),IL-10水平与模型组比较差异无统计学意义(P>0.05);化湿汤低剂量组大鼠血清IL-1β、IL-10及NO水平较模型组虽也都有改善,但差异均无统计学意义(P>0.05)。与化湿汤低剂量组比较,化湿汤高剂量组血清IL-10水平升高(P<0.05),NO水平降低(P<0.05),化湿汤中剂量组血清NO水平降低(P<0.05)。
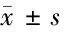
表2 各组大鼠末次灌胃后血清IL-1β、IL-10及NO水平比较
2.4 各组大鼠末次灌胃后结肠组织MDA、SOD及MPO水平比较 见表3。
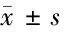
表3 各组大鼠末次灌胃后结肠组织MDA、SOD及MPO水平比较
由表3可见,与空白组比较,模型组大鼠结肠组织中MDA和MPO水平均明显升高(P<0.05),SOD水平明显降低(P<0.05)。与模型组比较,化湿汤中、高剂量组大鼠结肠组织中MDA和MPO水平均明显降低(P<0.05),SOD水平均明显升高(P<0.05);阳性药物组MPO水平降低(P<0.05),MDA和SOD水平与模型组比较差异均无统计学意义(P>0.05);化湿汤低剂量组大鼠肠组织MDA、SOD及MPO水平虽较模型组也都有改善,但差异均无统计学意义(P>0.05)。与化湿汤低剂量组比较,化湿汤高剂量组中MDA水平降低(P<0.05),SOD升高(P<0.05),化湿汤中剂量组MDA水平降低(P<0.05)。
3 讨 论
UC又称非特异性结肠炎,主要表现为大肠黏膜的慢性炎症和溃疡性病变。目前已知与UC有关的发病机制主要为氧化应激、肠通透性增高、某些炎症介质或硫化物生成增加、短链脂肪酸氧化或甲基化减少、黏膜变性、糖胺聚糖含量异常改变等[4],其中是氧化应激和炎症介质释放增加在临床研究中均被明确证实与UC的发病密切相关[5]。研究发现,在结肠炎症局部黏膜内的活性氧代谢物过量产生,如过氧化氢、羟基自由基及氧化剂衍生物等,可能是炎症性肠病的主要致病因素[6]。肠黏膜损伤与自由基的产生增多及内源性抗氧化物质浓度的降低有关[7]。自由基诱导的脂质过氧化是TNBS诱导的结肠黏膜损伤的机制之一[8]。MDA是氧化应激的标志产物,是脂质过氧化过程的最终产物,自由基活性的增加会导致MDA的过量产生[9]。SOD被认为是细胞内抑制氧自由基有害作用的重要的内源性因子[10],多项研究表明UC患者的结肠组织中SOD水平明显下降[11]。MPO活性检测对评价肠道炎症也有重要意义,MPO常见于中性粒细胞,其活性与中性粒细胞浸润呈线性相关,在UC活动期病例中,粪便中MPO水平显著高于缓解期患者及正常对照者[12]。
多种炎症细胞因子,如IL-1β、IL-10及NO在炎症性肠病的发病机制中也扮演着重要的角色。临床研究显示,与健康人群相比UC患者的IL-1β及NO水平明显增高,IL-10水平降低[13]。IL-1β作为促炎因子,广泛参与了人体组织破坏、水肿形成等多种病理损伤过程,UC发生时其水平可明显升高[14]。IL-10是具有免疫调节功能的抗炎细胞因子,主要由T淋巴细胞分泌,对炎性反应有非特异性的抑制作用,研究表明IL-10的水平与UC的炎症反应严重程度呈负相关,促进IL-10的表达能够明显减轻炎性反应[15]。NO在炎性反应过程中则扮演了双重角色,既有促炎作用也有保护作用,当组织细胞受到大量炎症因子刺激时,NO也会大量产生,并且生成具有较强毒性的过氧亚硝酸盐,对组织结构和功能造成破坏[16]。
目前治疗UC的首选药物是5-氨基水杨酸、柳氮磺吡啶等,美沙拉秦缓释颗粒是临床常用的药物之一,其可缓慢而匀速的释放5-氨基水杨酸,从而达到抗炎的作用,因此本研究以此作为阳性药物[17]。近年来,临床上采用中医药治疗UC的研究日益增多,并因其疗效显著、不良反应轻微而受到了医学界的广泛关注。UC属中医肠癖、泄泻等范畴,认为UC发病的中心环节在于脾虚湿困,多与湿邪侵及、恣食生冷、郁怒思虑、情志不遂等有关,脾胃受损,升降失司,运化失常,湿热内生,水湿聚集,下注大肠,肠络受损,腐败化为脓血而痢下赤白,故治疗应以健脾益气、祛湿止泻为原则。化湿汤是由《丹溪心法》中胃苓汤加减而来,方中苍术健脾燥湿,升阳散邪;白术燥湿健脾,利尿消肿;制厚朴温中止痛,行气化湿;茯苓利水消肿,渗湿健脾;泽泻利水渗湿泄热;陈皮理气燥湿,可助苍术、白术益气,使脾气以运,湿邪得除;炙甘草补脾益气,缓急止痛,调和诸药。诸药合用,共奏健脾行气、祛湿止泻之功。
以TNBS灌肠复制UC大鼠模型,依据的是TNBS在体内与蛋白结合后成为抗原,可引起免疫反应,诱导结肠炎症的发生。本研究结果也显示,与空白组大鼠比较,模型组大鼠血清中IL-1β及NO水平升高,IL-10水平降低,结肠组织中MDA及MPO水平升高,SOD水平降低。而经过化湿汤灌胃治疗后,大鼠血清中IL-1β及NO水平降低,IL-10水平升高,结肠组织中MDA及MPO水平降低,SOD水平升高,且高剂量效果更明显。综上所述,化湿汤治疗UC模型大鼠疗效确切,可明显改善大鼠临床症状,改善病变结肠组织病理形态,其作用机制可能与抑制炎性反应,减轻氧化损伤有关,且高剂量效果更好。
