光遗传学结合在体电生理在神经精神疾病研究中的实施策略及意义
2021-01-28
南京医科大学药学院,南京,211166,中国
1 光遗传学主要原理及应用方法
光遗传学(optogenetics)最早源于神经领域,是一种利用光学原理以及遗传学技术进行细胞生物学研究的新型技术,主要是在不同的目标细胞上或者目标器官中表达不同类型的光敏感通道蛋白,并通过对应波长的光照进行激活的方法从而完成对机体的不同生理病理的精密操控,以便进一步开展深度研究[1]。
与神经生物学领域传统的神经元研究方法相比,光遗传学最为突出的特点是细胞类型特异性[2],能够特异性操控目标神经元,而对相邻的其余类型神经元无影响。其另一个较突出优点是可以活体操作,具有独特的高时空分辨率。因而光遗传学弥补传统神经细胞调控手段的许多缺陷,已经成为神经药理学领域科学研究的重要钻研方向,越来越多的应用到神经精神疾病研究中[3-5]。
在中枢神经系统中,光遗传学可以利用光敏通道蛋白在微秒级别上控制某一特殊类型的神经元[6]。而且,近年来已经通过分子生物学的手段成功改造了许多的光敏通道蛋白,为激活或抑制神经元以及控制细胞下游信号分子提供了多样便捷的研究工具。
目前,光遗传学方法中光敏感蛋白主要是从单细胞微生物的视蛋白中获得的,按照特性的不同,主要有兴奋性和抑制性两种。其中,在最近的研究中兴奋性光敏感蛋白视紫红质通道 2(channel rhodopsin-2,ChR2)较为常用,通过470 nm 蓝光对ChR2进行照射引发快速的阳离子内流,从而使得细胞膜发生去极化反应得以兴奋,最终导致一系列的电生理效应[7]。目前,抑制性光敏感通道蛋白盐碱古菌嗜盐细菌视紫红质蛋白(natronomonas halorhodopsin,NpHR)和抑制性光敏蛋白T (archaerhodopsin-T,Arch T)较为常用,在利用黄光或者红光进行照射而激活后,可使得细胞内外发生氯离子流或质子流,导致细胞膜发生超级化,兴奋性降低,使得细胞活性被抑制。
2 在体电生理技术主要原理及应用方法
在体电生理技术也称为在体多通道记录法(in vivomulti-channel recording methods),是采用电生理的相应手段,通过记录大量神经元胞外放电情况监测中枢神经元群同步电活动的一种方法[8]。该技术的应用可同时对多个脑区的大量神经元的电活动进行监测。
在体电生理技术在记录原理上属神经元胞外电信号记录技术,当记录电极尖端距离神经元的胞体较近时,就能够检测到周围神经元的动作电位信号[9]。在记录时,记录到的信号是电极尖端所在位置的平均胞外场电位[10]。相比较于离体的电生理神经元记录手段,电生理技术的在体记录在神经科学研究探索中具有很多无可比拟的优点。首先,在体的研究方法,在记录神经元放电时,实验动物处于觉醒的状态,可以自主运动,因此记录的结果更贴近于机体“真实世界”情况。其次,由于多电极技术的应用,可以检测到机体不同脑区的同一时刻的神经元放电情况,避免了传统电生理技术在记录时的时空缺陷,极大提升了时空分辨率。最后,由于手术对实验动物的危害相对较小,除了进行急性动物实验外,还可以进行长时程的慢性实验,避免了离体电生理记录时间上的缺陷。总之,大脑对外界刺激作出的反应是多个脑区共同参与的结果,在体电生理在研究机体生理或者病理条件下的工作模式或者病理反应时有着不可替代的优势,在近些年神经科学研究中得到越来越多的应用,并逐渐走向成熟。
3 光遗传学结合在体电生理在神经精神疾病中的主要应用策略
3.1 解析癫痫的发病机制
癫痫是一种发生率相对较高的神经性疾病,实质上是因为脑内神经元非正常放电导致的短时间性脑功能紊乱。目前临床上该病还不能完全治愈,大部分患者通过服用不同类型的抗癫痫药来缓解病情,但是药物控制手段使用的增多同时伴随着耐药现象的普遍出现,约30%的患者对药物产生耐受成为难治性癫痫。其中,颞叶癫痫在癫痫患者中占有相对较高的比例,而且由于颞叶癫痫患者发生耐药现象有着更高的概率[11-12],因而近年来耐药型颞叶癫痫的有效治疗愈加引起重视。除药物治疗外,利用手术破坏异常放电病灶也是疗法之一。然而,手术作为一种创伤性治疗方案,存在着许多禁忌证以及术后后遗症和复发现象[13-14]。目前,在临床上对于耐药型癫痫依然没有理想的治疗方案,对其具体发作机制开展深入透彻的探寻并找合适的治疗方案仍然任重而道远。
颞叶癫痫是耐药型癫痫中较为常见的一种类型[15],病灶位于边缘区,主要为海马区。海马中来源于内侧隔核(medial septum,MS)的胆碱能神经元是海马兴奋性调节的关键[16-18]。Wang等[19]在癫痫发作期间对MS的胆碱能神经元的放电信号利用在体电生理技术记录,通过进一步分析发现在癫痫发作开始后胆碱能神经元就停止放电,并在发作后的一段时间内开始恢复,直接说明了颞叶癫痫开始发作时,MS的胆碱能神经元的放电活动受到抑制。为了明确MS胆碱能神经元在颞叶癫痫发作中的确切作用,研究者利用光遗传学技术特异性激活MS的胆碱能神经元,结合电生理等技术证明选择性激活MS胆碱能神经元可抑制海马癫痫发作。同样的方法,特异性抑制MS的胆碱能神经元进而证明选择性抑制MS胆碱能神经元可促进海马癫痫发作,从而充分说明MS-海马通路的胆碱能神经元活动在癫痫的发病机制中发挥的作用,为癫痫发作的控制治疗提供了新思路。
此外,已有研究揭示海马下托与颞叶癫痫以及难治型颞叶癫痫亦存在相关性[20-21]。Xu等[22]利用大鼠在杏仁核进行癫痫电点燃以及苯妥英钠耐药性筛选的方法进行难治型颞叶癫痫造模,通过在体神经元记录的方法,分别对海马下托区、CA1区、CA3区、DG区和EC区神经元的放电基线和苯妥英钠用药后的神经元放电进行记录,分析发现海马下托的兴奋性神经元放电发生显著性改变。而且,利用光遗传学对海马下托的兴奋性神经元进行特异性光激活或者抑制后也得到同样的结论。这提示海马下托的兴奋性神经元极有可能是治疗难治型癫痫的有效靶点。
3.2 阐明孤独症谱系障碍的发病机制
临床发现孤独症谱系障碍(autism spectrum disorders,ASDs)是一种神经相关性疾病[23],症状出现大多开始于婴幼儿阶段,患者主要具有社交能力缺陷、语言表达能力低下和刻板行为明显等特征[24-25]。ASDs的病因较为复杂,包括神经、免疫以及环境和遗传等多方面的因素[26]。近年来,ASDs的患病率迅速升高,成为患者沉重的负担,已经受到全球的重视,并且针对其病因和发病机制的进行持续深入研究。其中,神经网络发育异常相关导致自闭的病理机制一直是研究的热点。
3.2.1 情绪识别缺陷
ASDs患者突出的特点之一是社会认知方面的缺陷,其中情绪识别缺陷又是社会认知中最常见的一种。在研究初期,关于ASDs患者所表现的情绪识别缺陷的探索主要是通过行为学的方法。此外,传统的ASDs相关研究重点是对症状等表面特征的论述,并未进行深入的机制探索。近些年来,伴随神经药理学、电生理相关技术等的发展与成熟,更多地研究专注于情绪识别缺陷的神经机制探究。
传统研究揭示,ASDs患者在检查时出现事件相关电位的多种成份的改变,从而导致情绪识别缺陷的发生[27-28]。随着脑功能成像技术的逐渐成熟,研究者开始对情绪识别的内在机制进行大致脑部定位。研究表明,情绪识别的过程是正常人脑的一个分散式神经网络系统共同作用的结果[29]。经过进一步的脑部定位,研究发现ASDs患者情绪识别缺陷的发生主要与梭状回面孔区和杏仁核这两个脑区神经元的兴奋性降低有着紧密联系[30]。随着研究的进展,逐渐提出梭状回面孔区和杏仁核作为一个整体的系统,这一系统的异常是造成情绪识别缺陷的主要原因[31]。在这种假说下,研究进一步发现ASDs患者识别障碍可能不是某一个脑区异常导致的,更可能是多个异常脑区联合作用的结果,因而从整体水平上探讨ASDs患者情绪识别缺陷的联合神经网络机制成为当前研究的主要方向。
在体电生理技术具备的多脑区多通道同时记录的特点,以及光遗传学具有的特定神经元调控的特点,都使得在整体神经网络上对ASDs患者情绪识别缺陷相关的更具体的更多的脑区甚至是具体的神经元类型进行定位成为可能,从而能够进一步深入探究情绪识别缺陷的内在机制。例如,新近的研究发现,内侧前额叶皮层(medial prefrontal cortex,mPFC)损伤和情绪识别能力受损有着明显的相关性[32-33],兴奋性神经元与抑制性神经元的相互制衡作用决定着大脑皮层功能的正常与否[34-35],而ASDs就是由于这种平衡的紊乱导致的[36]。Diego等[37]为了探讨mPFC内的抑制性神经元亚群以及兴奋性锥体神经元在情感识别过程中发挥的作用,在mPFC中植入了线性多电极阵列,在进行情绪识别任务的过程中进行了长期的电生理记录,经过分析发现与兴奋性锥体神经元相比,抑制性中间神经元更多地参与到情感识别的过程中,在情感识别任务中有着更高的神经活动。在进一步的研究中,利用光遗传学的技术,选择性的激活或者抑制生长抑素(somatostatin,SOM)中间神经元、小清蛋白(parvalbumin,PV)中间神经元,进而比较不同调控方法下对情绪识别能力的影响,实验结果表明SOM 中间神经元的同步激活是影响情绪识别能力的重要因素,而PV 中间神经元不具有此种作用(Fig.1),从而进一步阐明了不同种类的抑制性中间神经元对于情绪识别过程中发挥的作用,为ASDs的情绪识别缺陷的发病原因提出了新的阐释。
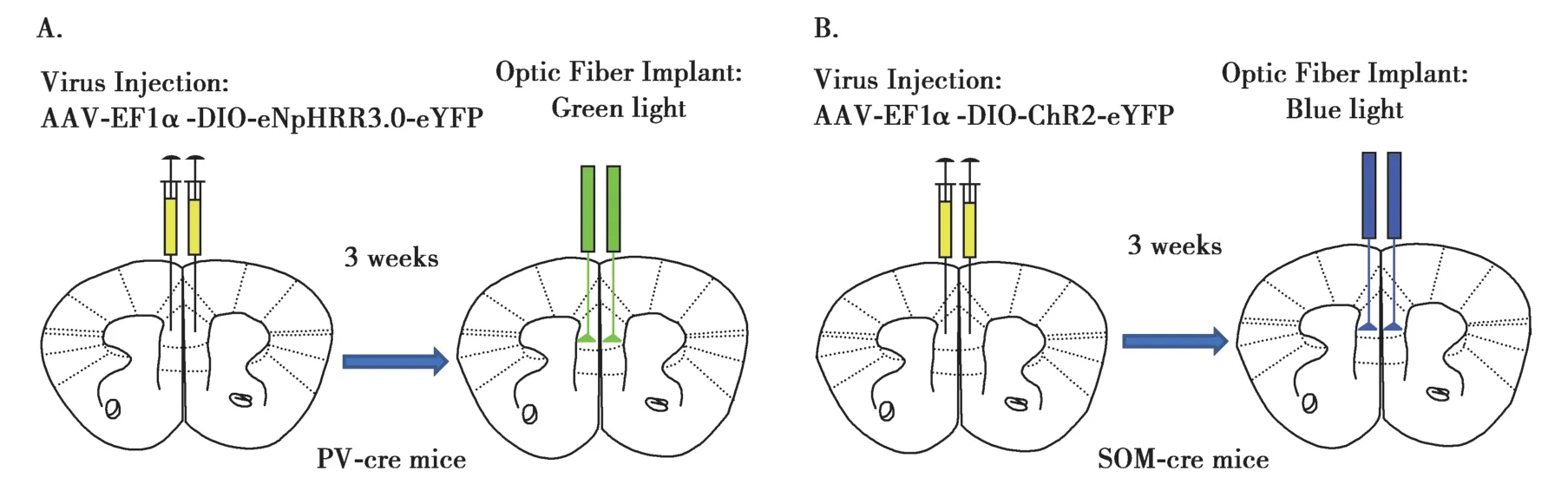
Fig.1 The strategies for the use of optogenetics combined with in-vivo electrophysiology
3.2.2 社交障碍
近年来,随着孤独症患病率的大幅度增加,社交障碍作为ASDs的核心症状之一也引起更多的关注,学者们对于社交相关的研究也日益深入。目前,越来愈多的研究表明mPFC是控制社交行为的关键脑区[38-40]。皮层神经网络活动是社交行为的基础,其兴奋性与抑制性神经活动平衡的打破则会导致社交障碍现象的发生。但是,其中具体的神经与网络机制仍然有待探索。已有研究发现,社交缺陷患者广泛存在γ氨基丁酸(γ-aminobutyricacid,GABA)能中间神经元的发育异常,而且GABA能中间神经元已被研究发现在皮层多种神经环路中发挥着重要的抑制性作用[41-42]。
基于此,Liu等[43]通过在体电生理对社交过程中mPFC神经元进行记录,结合光遗传学进行光鉴别的策略发现mPFC不同类型的中间神经元放电模式不同,在社交的过程中,PV中间神经元放电频率显著性增加,然而SST中间神经元放电频率不变,并且通过进一步光遗传学调控发现选择性激活PV或者SST中间神经元使其神经活动同步化增加,进而使得mPFC脑区场电位在低gamma 频段能值增加可以显著性增加小鼠的社交能力。与此相似,Cao等[44]通过神经调节蛋白R451C敲入鼠这一自闭模型研究发现社交障碍、社交新颖性缺陷的行为学表型,并且伴随着mPFC脑区中间神经元兴奋性降低和gamma振荡的下调。此外,进一步研究发现通过光遗传学手段光刺激mPFC脑区PV神经元可以改善社交障碍等行为学缺陷。总而言之,这些研究发现都为ASDs的治疗提供新的可能性靶点。
3.3 解析神经精神疾病中认知功能缺陷的发生机制
精神疾病的研究在传统上更多地集中于情感相关的症状,如抑郁、焦虑、妄想、幻觉等。但是,近些年来许多研究者发现,大部分精神障碍疾病伴随着认知功能的缺陷。临床上认知功能的控制不佳将严重影响精神障碍患者的生活质量,但是其认知功能缺陷产生的内在原因目前还没有明确。
研究发现认知障碍被认为是由遗传、表观遗传、发育和环境因素相互作用的结果。其病理上的变化包含基因、分子、细胞、神经网路等不同层次的改变[45]。例如细胞水平上包括神经元和神经胶质细胞等的变化。研究还发现某些分子相关的神经发育异常、神经可塑性改变也与认知缺陷相关[46-47]。
3.3.1 双向精神障碍
研究表明,精神障碍患者脑内异常的脑神经网络连接尤其是大脑皮层的功能与认知缺陷有着密切的关系,其中大脑皮层前额叶神经网络的功能障碍扮演着重要的角色[48]。实际上这种功能障碍出现在神经发育的早期,其早期破坏被认为是这些疾病特征的破坏性症状出现的基础。
在精神障碍的小鼠模型中,Chini等[49]利用在体电生理对新生小鼠前额叶皮层的神经元放电情况进行记录,通过对场电位(local field potential,LFP)的分析发现其浅层前额叶皮层β-γ频带振荡能值的降低,以及浅层前额叶皮层神经元放电频率的下降等现象,从而证明了在新生小鼠中早期出现的前额叶皮层神经网络的功能障碍。在进一步的研究中,利用子宫内电穿孔的方法向胚胎期的小鼠中转染了光敏感蛋白ChR2(ET/TC)以及红色荧光蛋白[50],从而对发育完成后的小鼠前额叶皮层的深层以及浅层的椎体神经元做出了区分标记;利用光照对锥体神经元不同程度的激活,同时利用在体电生理记录前额叶皮层的不同频段能值的变化,进一步直接证明在精神障碍的小鼠中β-γ频带振荡功能的异常是由于浅层锥体神经元的异常激活引起的,前额叶皮层浅层的锥体神经元在新生小鼠中产生β-γ振荡中起着生理病理调控作用。在成年后,gamma频率的协调活动有助于认知过程。以上研究对精神疾病中的认知功能缺陷的发生机制作出了进一步的阐释,同时为双向精神障碍患者存在的认知缺陷的有效治愈指明了新方向。
3.3.2 精神分裂症
认知障碍大多出现在精神分裂症的早期,是精神分裂症患者独立于阴性症状和阳性症状之外的又一重要症状[51]。在过去的几十年,认知障碍严重影响患者的生活质量,给患者造成沉重的负担,但在寻找新的治疗方案方面几乎没有取得进展[52],其中一个重要的限制因素是对认知相关神经网络的不完全了解。目前,精神分裂症患者的认知障碍这一核心症状在治疗过程中已逐渐被重视,相关的科学研究与药物开发也逐渐增多。同时,各种新兴精神疾病相关研究方法与技术的出现、发展与成熟极大地推动了精神分裂症中认知障碍的神经网络机制研究。
神经网络的gamma振荡的下降出现在大多的精神分裂症中[53-54],但是gamma振荡与认知障碍之间是否存在着直接的相关关系以及潜在的神经网络机制仍然有待于研究。对此,Kazuhito Nakao等[55]利用精神分裂症小鼠模型,通过在体电生理记录发现选择性地增加gamma振荡的强度并使之恢复至正常水平可以改善精神分裂症的认知障碍。Oana Toader等[56]利用光遗传学手段选择性地抑制前额叶皮层的PV中间神经元活性后,与已有的研究结果相一致,在体电生理记录结果显示了前额叶皮层神经活动的增强,多次实验显示神经活动同步性的降低。此外,通过进一步行为学实验的研究结果提示精神分裂症中认知障碍的病理机制不仅与PV中间神经元相关,还存在着其他的神经细胞群体的参与。这一发现也为精神分裂症中出现的认知障碍病理机制的研究拓展出新思路。
3.3.3 阿尔茨海默病
阿尔茨海默病是一种以认知障碍为核心特征之一的神经退行性疾病,病理学标记物主要有β淀粉样蛋白、Tau 蛋白等,此外神经元和突触的丢失也是重要的病理变化之一[57-58]。目前,阿尔茨海默病的临床治疗仍然缺乏有效的治疗药物主要原因是其病因学和发病机制仍不清楚。
近年来,关于阿尔茨海默病发病机制假说虽然很多,但是基于β淀粉样蛋白发病机制假说一直受到更广泛的重视[59]。Wang等[60]通过经典的阿尔茨海默病转基因小鼠模型,利用在体电生理的方法对阿尔茨海默病的早期病理学变化进行深入研究,重点关注了海马、齿状回的神经网络活动,研究结果发现β淀粉样蛋白的沉积逐渐削弱神经网络活动的theta振荡,同时使得theta和gamma振荡的相位同步性下降,进而导致神经网络功能障碍、认知障碍的出现。此外,通过进一步深入的研究,Ekta Kumari等[61]发现他克林可以改善阿尔茨海默病中海马相关的神经网络缺陷以及一定程度的认知障碍。此外,研究发现多奈哌齐对β淀粉样蛋白沉积导致神经网络功能障碍也有改善作用[62]。这些研究结果都为阿尔茨海默病的临床诊断及治疗提供了新靶标。
3.4 解析原发性震颤的发病机制
原发性震颤(essential tremor,ET)作为一种神经病变相关的运动障碍性疾病在临床上并不罕见,主要临床表现包括姿势性或动作性震颤,其中一定比例的患者会存在头部和声音震颤的现象[63]。过去的研究曾经指出原发性震颤患者单纯存在运动能力的缺陷,并没有发生实质上的病理变化。但是进一步的科学研究推翻了之前观点,在对特发性震颤研究时发现其患者小脑的一些部位存在特异性的病理结构改变,例如浦肯野细胞的减少以及轴索的病理性形态改变等[64-66],并且发现原发性震颤可能与小脑的功能失常有着极大的关系。近年来通过动物进行病理性震颤造模研究提示,原发性震颤的病理机制可能是由于大脑中枢神经系统内在的神经网络结构或者神经核团的一场神经节律振荡导致的[67]。
利用致幻剂哈马林注入动物体内进行震颤动物模型的造模,利用在体电生理技术对神经元放电情况进行检测,数据分析揭示出小脑下橄榄核部位存在异常同步的节律性神经元放电信号,放电频率与震颤同步,并且这种放电通过小脑和红核脊髓束传导到脊髓的运动神经元,最终导致震颤[68]。同时,研究也发现当小脑皮质神经元或丘脑受损后,震颤将消失,这些研究结果均表明这些结构都与原发性震颤的发病相关。因此,有研究者认为神经核团导致病理性震颤的起搏点是小脑下橄榄核,但仍然存在很多的争议。随着研究的进展,原发性震颤的脑部定位已包括小脑、脑干、红核、丘脑和基底神经节等。但是由于技术的限制等原因,原发性震颤的产生原因还未明晰,也进而导致目前临床的治疗手段有限。
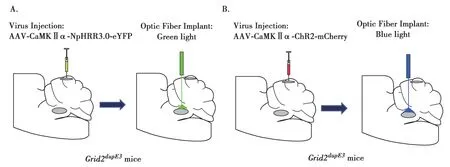
Fig.2 The strategies for the use of optogenetics combined with in-vivo electrophysiology
然而,随着光遗传技术以及在体电生理技术的出现与成熟,进一步推动了ET病理相关研究机制探讨的进程。已有研究表明,ET患者小脑中攀缘纤维(climbing fiber,CF)到浦肯野细胞(purkinje cell,PC)之间形成的突触存在修剪缺陷的问题,从而造成CF-PC突触数目的增加[69-70]。在此基础之上,Pan等[71]进行了更深入的研究,以原发性震颤的小鼠为模型,利用光遗传学的方法向PC中转染抑制性光敏感通道蛋白选择性特异抑制PC神经元,从而证明PC的神经元活动与ET的相关性(Fig.2A)。同时,利用在体电生理的方法对小脑的局部场电位以及相关神经元放电情况进行记录,并结合相位锁定等分析方法证明同步和有节律的PC活动、过多形成的CF-PC突触能够导致小脑的场电位的过度振荡,从而导致震颤。此外,为了进一步证明过度增强的小脑场电位振荡与震颤的因果关系,利用光遗传学的技术通过对PC轴突末梢给予节奏性的蓝光照射使得PC产生同步和节奏放电,结果导致了小鼠震颤(Fig.2B)。这些研究结果为原发性震颤的病理机制作出了新阐释,可能为其临床有效治疗提供新策略。
4 问题与展望
目前,光遗传学技术灵活巧妙地结合在体电生理技术的研究手段已经越来越多地应用到神经领域的研究之中[72-73]。在最近的研究中二者的结合应用主要在神经环路的发现及其功能方面[74],为感觉、行为、运动或者认知等相关环路的研究提供了有效的研究策略,也为获得完整的神经环路谱图做出了重要贡献。然而,光遗传学结合在体电生理技术在神经药理相关的研究应用领域仍然需要不断拓展,才能进一步推进治疗神经精神类脑病的创新药物筛选与作用机制解析。在光遗传学方面,存在光敏感通道蛋白特异性不高、照射光源高效性不足、重组病毒工具的低毒和稳定表达性不够等问题,依然亟待解决。在体电生理方面,提高实验数据质量、进一步开发更高级数据分析软件依然十分必要。这些问题的解决将会使得光遗传学技术与在体电生理技术的结合在神经药理相关的研究领域应用更加完善、广泛,从而推动对神经精神疾病的发病机制和治疗机制的深入研究。
