基于高通量测序研究锦屏极深岩层微生物多样性
2021-01-28李雪丹
李雪丹, 徐 绯, 王 璨,3, 徐 恒
(1.四川大学生命科学学院 四川省环境保护土壤生态保护与污染防治重点实验室, 成都610064;2.安阳工学院 生物与食品工程学院, 安阳455000;3.西南交通大学, 成都610064)
1 引 言
2010年12月12日,清华大学和二滩水电开发有限责任公司共同建设的中国首个极深地下实验室——“中国锦屏地下实验室”(CJPL)投入使用. 该地下实验室位于四川雅砻江锦屏水电站,实验室上层山体岩石厚度达2 400多米[1]. 锦屏地下实验室的宇宙线通量相当于地面宇宙线通量的亿分之一甚至更小. CJPL是目前世界上岩石覆盖最深的地下实验室,是世界上最好的超低本底实验室. 岩层极端微生物是CJPL自然区域的重要组成部分,研究岩层极端微生物资源,探索这些极端微生物的生命代谢对探索人类起源、寻找外太空生命具有重要意义.
极端微生物指在一般生物无法生存的极端环境中能够生存的微生物. 极端微生物由于其特有的遗传物质、生理生化响应和代谢途径对生命科学的研究具有重大意义. Dylan Chivian等在南非地下金矿2.8 km发现一种新物种细菌,因其生存环境类似土星六号卫星,所以命名此细菌为“大胆旅行者(The bold traveller)”,不同于其他生物体,具有生活在完全隔离环境中的能力,该菌生活环境处于极端状态:60 ℃、黑暗无光、无氧、无有机物、单一物种、与世隔绝;研究推测出该菌完整的代谢途径:能量源来自周围岩石铀的衰变,碳源来自 CO2及周围岩石 CO32-,氮源来自H+与岩石反应形成的 NH3,磷源来自岩石磷酸盐氧化还原形成的PO43-,该研究结果已发表在《Science》上[2]. 2014年Könneke等研究表明氨氧化古菌(泉古菌门和奇古菌门)通过改变羟基丙酸/羟基丁酸循环,使其代谢过程发生变化,促使该途径的能源效率远高于其他自养途径,促使氨氧化古菌能够在低营养环境下茁壮成长[3]. 2015年日本学者在《Science》报导:在海底1.5~2.5 km,温度40~60 ℃的地层中发现细菌并成功培养,每立方厘米沉积物中菌细胞数约10~10 000个,其中煤层处最丰富,分析显示这些微生物类似森林土壤细菌(包括产甲烷菌),推测千万年前因地质构造随森林一同埋入海底的土壤土著菌仍存活,它们以海底埋藏的森林为能源,是天然气形成的主要原因,此次发现微生物深度刷新了新记录,成为世界最深[4]. 同年Reitschuler等研究了阿尔卑斯山一个无人类活动痕迹洞穴表面的月奶石沉积物中微生物群落进,发现一种能耐受低温和营养匮乏的古细菌群落,优势菌株在亲缘上与氨氧化古菌接近,其可能在黑暗洞穴中仅靠氧化环境中的氨获得生存能量[5]. 大量研究表明,在岩石、沉淀物、高温泉水等极端环境中存在大量极端微生物,其数量和种类超出人类想象.
传统的微生物研究方法,如显微镜观察微生物形态、平板计数法、微生物纯种分离和生理生化反应鉴定微生物等存在很大的局限性. 越来越多的研究表明:环境中可分离培养的微生物种类所占比例不到微生物种类总数的1%,其中99%以上的微生物极难培养或不可培养[6-8]. 用传统的微生物研究方法仅能对环境中极少数的微生物种类进行研究,不能代表环境中复杂的微生物群体. 极端环境,盐湖(盐度)、热泉(高温)、冰川及冻土(低温)、酸性尾矿水(极酸)、碱湖(强碱)、深海(高压、贫营养、缺氧、少光等)、地下深部(无光、缺氧、高压、高温、高盐、高辐射、贫营养等)、沙漠(缺水、紫外辐射强烈、贫营养等)等中的微生物因生活条件苛刻、生长周期长等原因更难用传统方法研究. 基于非培养基础的分子生物学方法可以通过从环境样品中直接提取微生物的DNA,快速、系统地对环境样品中微生物组成、结构和多样性分析,较为全面、真实的反映微生物的状态. 16S rDNA序列总长度为1 540 bp,基因序列长短适中,结构中即有保守区域又有变异区域[9],是最常用的生物标记物,广泛用于细菌的分类、系统进化和多样性研究中.
由于“中国锦屏地下实验室”(CJPL)位于地下2 400多米,其极深的自然条件提供了完美的“洁净本底”. 本研究对CJPL原始极深环境中极端微生物资源进行研究,为后续研究其能量溯源提供研究基础. 本研究可向人类提供现在不完全了解的基因库,而且在生物学理论上也有极大意义,对于推动生物科学,探索新的可开发生物资源有着重要意义.
2 材料与方法
2.1 材 料
采样地点为2014年启动建设的“中国锦屏地下实验室”第IV组实验洞8#洞,轴线方位角N58°W,距离地表2 400 m. 2016年12月共采样11个用于分析微生物多样性,其中4个岩石样品(3.1 m处碎石S1,5 m处碎石S2,钻井附近对照样碎石S3,东北角60°方位碎石S4),7个洞内水样(东北角60°方位水样W1,泉眼处(1.2.3)水样W2a、W2b、W2c,洞内水池水样W3,气泡状岩石渗水样W4,洞池气泡附近水样W5),见图1. 采用岩芯钻机采集岩石样品后装入无菌采样袋,岩壁缝隙渗透水样收集至无菌采用瓶中,立即放入液氮中保存运输至实验室.

图1 样品采集位置
2.2 方 法
2.2.1 DNA提取与纯化 岩石样品表面消毒后于无菌环境下取出岩心用于总DNA提取,将岩心用无菌水浸泡,浸泡水用0.22 μm滤膜过滤. 水样在超净台用0.22 μm滤膜进行过滤,采用CTAB法进行DNA提取. 将提取的DNA置于-80 ℃保存,待测序.
2.2.2 高通量测序 提取样品总 DNA 后,根据细菌V3+V4 区设计得到引物(F: 5′-ACTCCTACGGGAGGCAGCAG-3′,R: 5′-GGACTA CHVGGGTWTCTAAT-3′),合并引物接头,进行 PCR 扩增并对其产物进行纯化、定量和均一化合成测序文库,对建好的文库进行质检,质检合格后在 Illumina MiSeq 2500 平台进行测序.
2.2.3 测序数据过滤及拼接 根据 PE reads之间的 Overlap 关系,将测序所得的双端序列数据拼接(Merge)成一条序列 Tags,同时对 Reads质量和 Merge效果进行质控过滤. 首先,使用 FLASH v1.2.7软件,通过 Overlap 对每个样品的 Reads 进行拼接,得到的拼接序列即原始 Tags 数据. 其次,使用 Trimmomatic v0.33软件,对拼接得到的 Raw Tags 进行过滤,得到高质量的 Tags 数据. 再使用 UCHIME v4.2软件,鉴定并去除嵌合体序列,得到最终有效数据.
2.2.4 OTU(Operational Taxonomic Unit)分析利用 QIIME 软件中的 UCLUST 对Tags在 97% 的相似度水平下进行聚类、获得 OTU,并基于 Silva 分类学数据库(Release128, http://www.arb-silva.de)对 OTU 进行分类学注释.
2.2.5 Alpha 多样性分析 Alpha多样性反映的是单个样品内部的物种多样性,使用 Mothur 软件,对样品 Alpha 多样性指数进行评估. 用计算群落丰度的Chao1 和 Ace 指数和计算群落多样性的 Shannon 和 Simpson 指数作为Alpha 多样性的衡量指标[10].
2.2.6 Beta 多样性分析 Beta多样性用来比较不同样品在物种多样性方面存在的差异大小. 基于Binary accard、Bray curtis、(Un)weighted unifrac (限细菌)多种算法呈现物种多样性矩阵[11]. 基于 R 语言平台绘制样本主成分分析(PCA)、主坐标分析(PCoA)以及环境因子与样本组成相关性分析(RDA/CCA).
3 结 果
3.1 基因组DNA提取与测序数据分析
样品宏基因组提取后,采用琼脂糖凝胶电泳检测DNA完整性,NanoDrop检测DNA纯度和浓度. 1%琼脂糖凝胶电泳检测结果显示样品均有目标条带出现,DNA完整性较好. NanoDrop结果显示样品浓度和纯度符合送样测序要求. 对样品DNA进行建库并在Illumina MiSeq 2500 平台进行测序,结果如表1所示:11个样品测序共获得 879 756 对 Reads,双端 Reads 拼接、过滤后共产生732 477 条 Clean tags,平均每个样品产生79 978条 Clean tags;样品的测序质量均较高, Q20值在大于96%,Q30值在94%以上;所有样品中细菌的GC含量均高于50%,S1细菌的GC含量最高(56.83%). Shannon多样性指数稀释曲线趋于平坦,表明测序数据量足够大,增加数据量并不会增加OTU,见图2. 基于97%相似性聚类获得OTU数1 318个(不同样品间取并集),其中S1样品中OTU最多,W2a、W2b和W2c样品中的OTU最少,见图3. 岩石样品与水样中共有OTU(共有微生物)数为873个,岩石中特有的OTU数为321个,水样中特有的OTU数124个,见图4.

表1 样品测序结果和拼接的Tags数
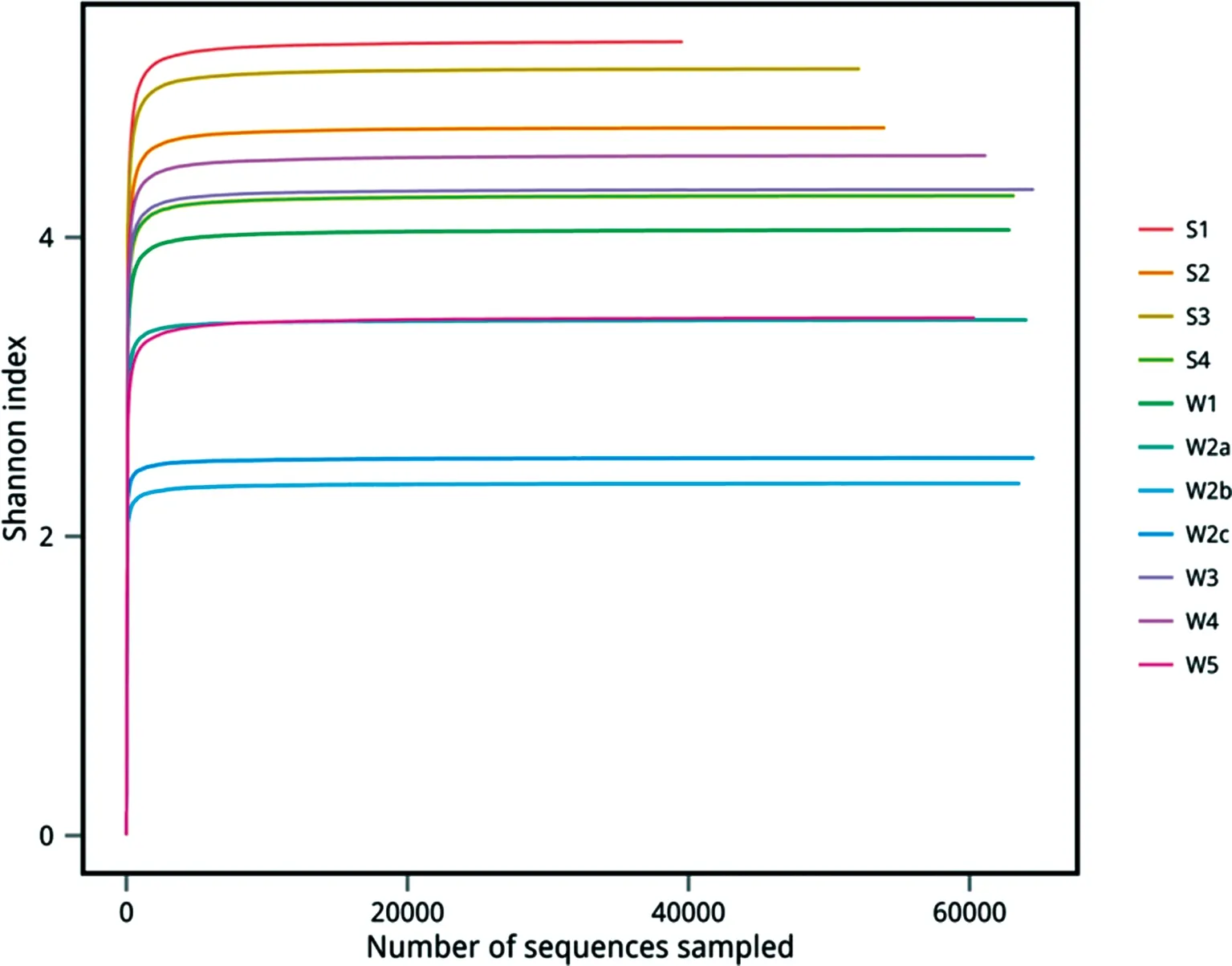
图2 样品Shannon index曲线

图3 样品OTU个数分布图
3.2 多样性分析
在 97% 相似度水平下,对样品 Alpha 多样性指数进行统计(表2). Chao1 和 Ace 指数简单指群落中物种的数量,而不考虑群落中每个物种的丰度情况. Shannon 和 Simpson 指数受样品群落中物种丰度和物种均匀度的影响,相同物种丰度的情况下,群落中各物种具有越大的均匀度,则认为群落具有越大的多样性. 由表2可以看出S1样品的Alpha多样性最高,其次为S3和W4,W2b和W2c样品的单个样品内部的物种多样性较低.
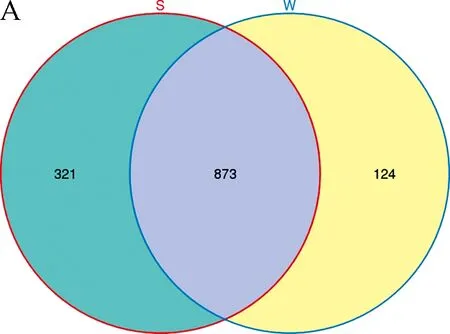
图4 不同样品间特异性细菌OTU数量
基于 UniFrac 的加权和非加权的主坐标分析其第一主成分和第二主成分的贡献率分别为41.88%、15.99%和35.92%、23.94%. 采用非加权组平均法进行聚类分析,分析结果表明S4和W1样品间间物种组成的相似性较高;W4和W5样品间间物种组成的相似性较高;W2b和W2a品间间物种组成的相似性较高,图5.
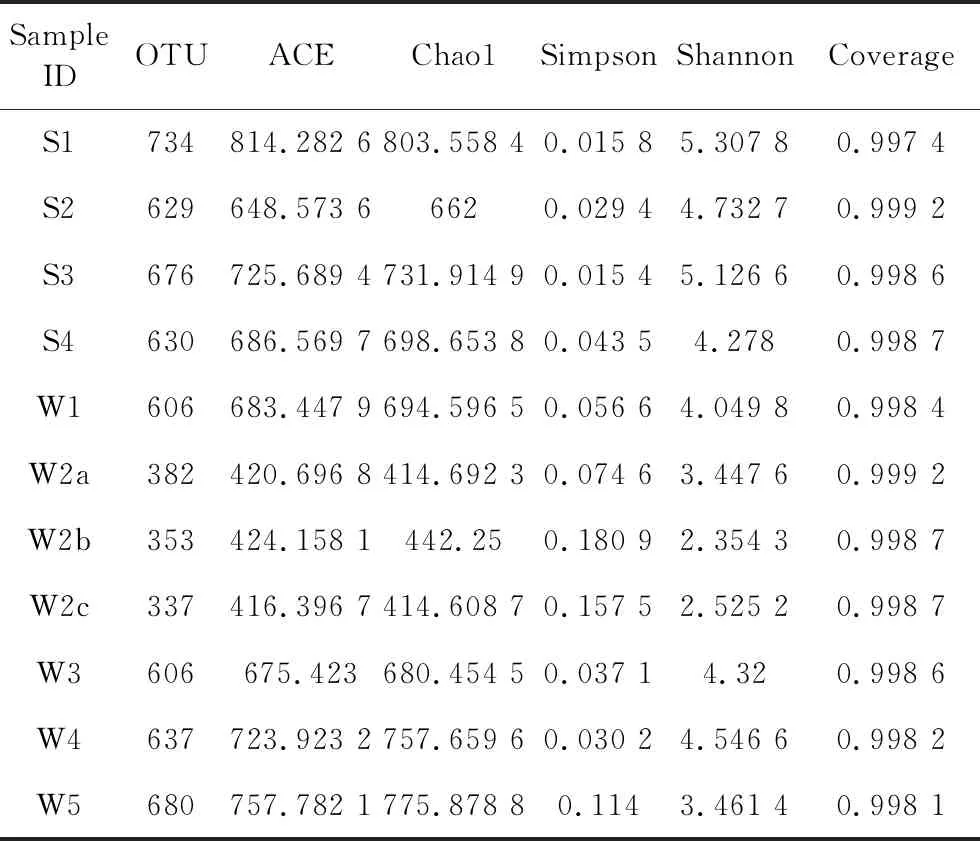
表2 样品Alpha多样性指数统计
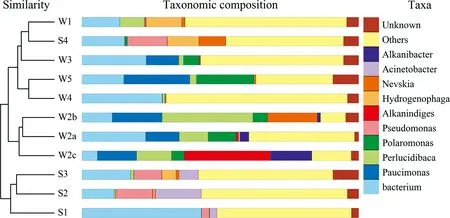
图5 样品UPGMA聚类树
3.3 物种注释及分类学分析
本研究对各样本进行了物种注释,详细的分类和整理了各个样品具体的菌群结构.各个样品在门和属水平上物种组成结构存在一定差异,见图6.
各样品细菌物种注释到24个门,11个样品中绝大数微生物属于变形菌门(Proteobacteria),除样品S4中有0.15%的微生物被鉴定为Unknown,其他样品中只有极小一部分微生物被鉴定为Unknown.拟杆菌门(Bacteroidetes)在各个样品中的相对丰度均大于1%,此外放线菌门(Actinobacteria)(W2b 0.86%)和厚壁菌门(Firmicutes)(S3 0.36%)在各个样品中的相对丰度均大于1%. 酸杆菌门(Acidobacteria)在岩石样品中的含量大于1%(除S2 0.43%),而在水样中均小于1% (W1 1.26%).
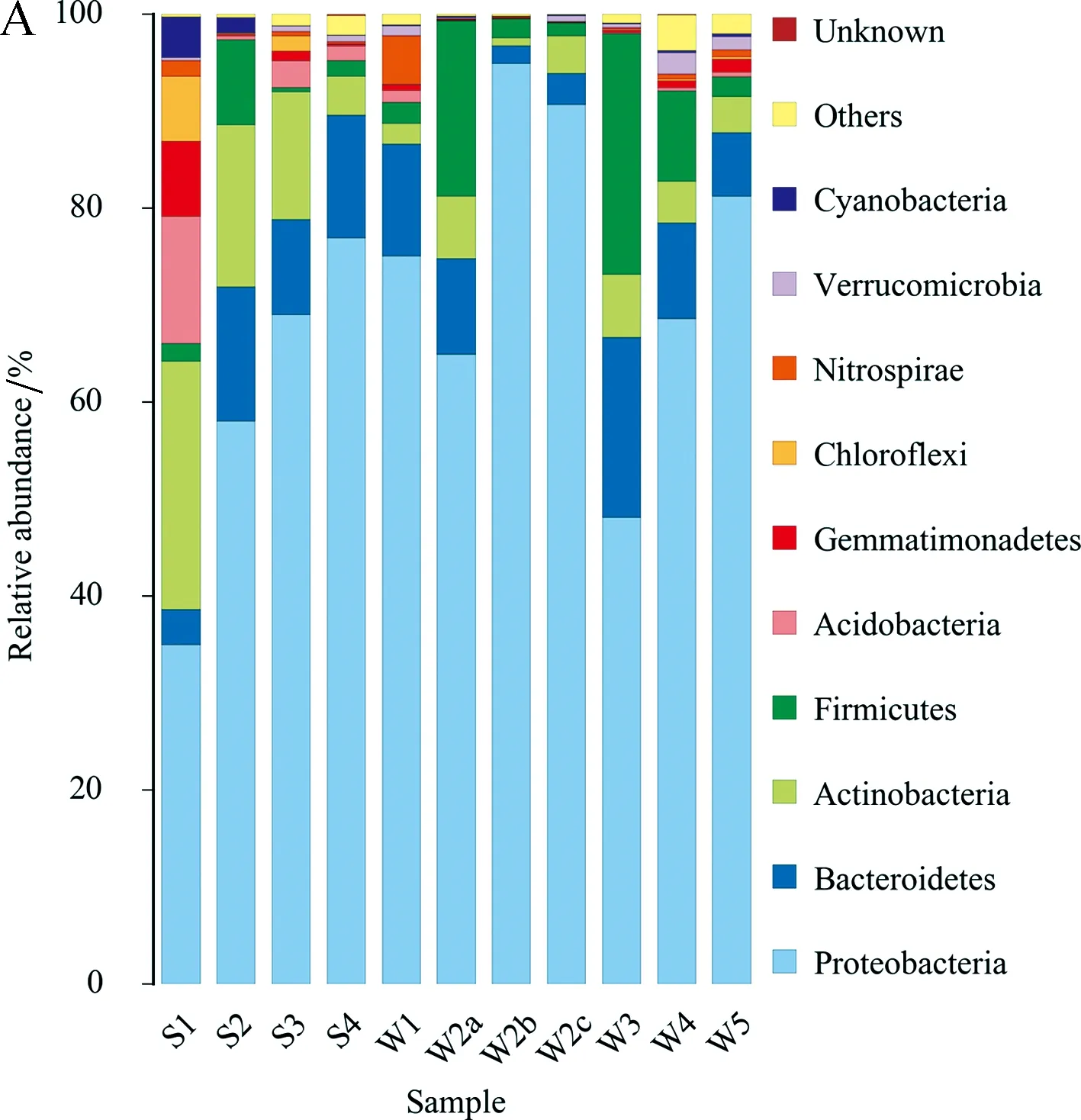
图6 不同样品细菌在(A)门和(B)属水平的相对丰度
在属水平上,共获得345个属. 在11个样品中含量均较高的是杆菌属(Bacterium),其次在岩石样品中相对含量较多的是假单胞菌属(Pseudomonas),在水样中含量较多的是Paucimonas. 位于前10的微生物属还有噬氢菌属(Hydrogenophaga)、涅瓦菌属(Nevskia)、不动杆菌属(Acinetobacter)、单胞菌属(Polaromonas)、γ-变形菌纲的Alkanindiges、Alkanibacter和Perlucidibaca.
3.4 功能预测
通过比对16S测序数据获得的物种组成信息,使用基因功能预测PICRUSt软件推测样本中的功能基因组成,从而分析不同样本在功能上的差异. KEGG分析显示共获得299个预测的KEGG,11个样品中丰度较高的代谢通路相同,涉及的代谢通路有:碳水化合物代谢、氨基酸代谢、能量代谢、辅助因子和维生素代谢、异源物质的生物降解和代谢、脂质代谢、核苷酸代谢、膜转运、翻译和信号传导等,见图7A. COG分析也表明11个样品中COG功能预测是相同的,包含氨基酸转运和代谢、转录、信号转导机制等,见图7B.
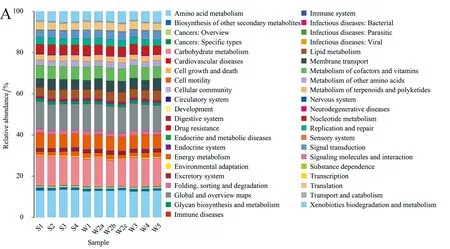
图7 基因(A)KEGG和(B)COG功能预测
4 讨 论
在自然环境中,99%以上的微生物不可在实验室纯化培养,这些不可培养微生物是研究环境微生物多样性的最大障碍. 传统的微生物形态观察、生理生化测定及分离纯化鉴定不仅周期长而且无法对这类不可培养微生物进行研究. 随着测序技术的发展,基于序列分析为微生物的鉴定提供了新的思路. 16 rDNA是根据97%的序列相似性水平来划分种属,能寻找到新物种且操作简便可行,相似性低于97%则可认为是一个新的物种. 16S rDNA v3+v4 区的序列差异性较大,含有丰富的信息,可根据序列信息快速的进行细菌的鉴定. 本研究采用Illumina MiSeq 2500测序技术,克服了环境中大部分细菌不可培养的难题,对锦屏极深岩层环境中的微生物进行了比较全面的检测. Shannon多样性指数稀释曲线已经进入平台期,达到实验需要的理想水平,更多的数据量对于发现新的 OTU 贡献很小,且覆盖率高于99%,说明此次测序数据比较全面的覆盖了样品中的微生物,能够真实全面的反映其组成情况.
在门水平上,样品中的优势菌群均为变形菌门. 在属水平上,样品S1、S3、S4、W2a、W3和W4的优势菌群均为杆菌属,S2的优势菌群为变形菌门不动杆菌属,W1的优势菌群为变形菌门Silanimonas属,W2b的优势菌群为变形菌门Perlucidibaca属,W2c的优势菌为变形菌门Alkanindiges属,W5的优势菌群属于变形菌门Paucimonas属. 在属水平进行Beta多样性分析,S4和W1样品间物种组成的相似性较高;W4和W5样品间间物种组成的相似性较高;W2c、W2b和W2a品间间物种组成的相似性较高. S4与W1取样位点一种,均在锦屏8#洞东北角60 ℃,W1为该处水样,S4为该水样附近岩石沉积物,W1和S4间有3个属的微生物相对丰度差异较大:变形菌门Silanimonas属(W1 16.2%, S4 0.34%)是存在于温泉中的嗜热的革兰式阴性菌,最适生长温度为50-55 ℃,可以分解几丁质获取营养[12];变形菌门涅瓦菌属(Nevskia)(W1 1.2%, S4 9.67%)为革兰式阴性严格需氧菌的化能有机营养型细菌,生活最适温度为20~25℃[13];假单胞菌属(Pseudomonas)(W1 0.29%, S4 14.41%)需氧的革兰氏染色阴性菌,大多菌的适温为30 ℃. W4与W5样品间物种组成的相似性较高是由于其取样位点相邻. W2c、W2b和W2a物种组成的相似性较高是由于其取样位点相同.
在种水平上,各个样品中杆菌(bacterium)占70%以上,本研究将装甲菌门、拟杆菌门、绿菌门、蓝细菌门、变形菌门、厚壁菌门等门中的杆菌统计到一起. 其次是可以在室温0 ℃以下(水温12℃以下)将铵态氮、NO2-转化为NO3-硝化菌属的Perlucidibacasp.[14],本研究中该菌只存在于水样中. 而噬碱属Aquiflexumsp. 只存在于岩石样品中,具有将硝酸盐还原成亚硝酸盐的能力[15],此外,从印度罗娜碱性火山口湖分离纯化的一株Aquiflexumsp. DL6可产生大量催化硝基芳香化合物为芳香胺的硝基还原酶和还原偶氮染料中偶氮键的NAD (P) H偶氮还原酶[16-17]. 硫氧化共生有机体细菌主要存在于W4样品中,大约占该样品总细菌数量的1%,在样品S2、S3、S4、W1、W3、W5也含有该菌,但数量较少. 硫氧化共生有机体细菌为自养型微生物,通过氧化环境中的还原态硫化物获得能量,能够固定二氧化碳满足自身和共生体的生长,研究发现海绵共生的硫氧化菌与其宿主发生了共进化,既能自养也能异养[18]. 从云南腾冲温泉酸性水样分离得到一株中度嗜热嗜酸硫氧化杆菌MTH-04,该菌能利用硫磺、硫代硫酸钠、四硫酸钾作为能源生长,不能利用硫酸亚铁、黄铁矿、蛋白胨、酵母粉、葡萄糖,在有硫磺作为能源时也不能利用这些有机质进行混合型生长[19].
岩石样本S1中发现的酸杆菌门Subgroup 6,在美国怀俄明州低凯恩洞穴(Lower Kane Cave, Wyoming, USA)、西班牙阿尔塔米拉洞窟(The subaerial non-sulfidic Altamira Cave, Spain)中也发现了该OTU,Subgroup 6与ε-变形菌、γ-变形菌和α-变形菌间存在功能上的相关性[20]. S1特有的放线菌门Gaiella属是非运动的杆状革兰式阴性菌,在葡萄牙中部的一家矿泉水公司的150米深钻孔中也发现该属细菌[21]. S1特有的芽单胞菌门Longimicrobiaceae是一种化学有机异养革兰氏阴性菌,首次发现于地中海森林土中,可在低营养条件下生存[22]. 在S4、W1、W4和W5中发现的变形菌门Oligoflexaceae科OTU在撒哈拉沙漠的东部边缘的砂碎石样品中也有发现,Oligoflexus细菌可在低营养条件下生长[23]. 在S4、W4和W5中均发现一个未知菌,有待进一步进行鉴定.
水样中特有的OTU 拟杆菌门Cryomorphaceae广泛存在于水生栖息地,如河流岩石、海水、海洋沉积物、海岸沙滩和内陆河水体等,贯穿热带和极地,通常存在于有机碳富裕的地方[24]. 水样中特有OTU 变形菌门Limnobacter属首次分离于淡水湖沿岸沉积物中,是一类硫代硫酸盐异养细菌,在日本营养匮乏的火山沉积中发现一株Limnobacter属菌株KP1-19T可利用硫代硫酸盐作为额外的能量来源[25-26].
W1样品特有的变形菌门PorticoccaceaeOTU主要存在于海洋环境中,该科的某些物种可运用视紫质将光能作为额外能源[27]. W1特有变形菌门Polynucleobacter属OTU是一些游仆虫属的内共生菌株,但也有些菌株可独立生存于淡水、池塘和河流[28]. W2样品中特有的变形菌门Alkanibacter属OTU是无孢子产生的革兰氏阴性菌,分离于炼油厂的Alkanibacter属细菌可以己烷作为唯一碳源,也可以羟基丁酸和琥珀酸盐为碳源,最适生长温度30 ℃,温度低于13 ℃或者高于45 ℃不生长[29]. W4特有厚壁菌门Desulfosporosinus属OTU广泛存在于环境中,如原始含水层、城市饮用水、水稻根部和永久冻土,该属菌株343T含有b-细胞色素并将乳酸盐作为电子供体还原硫酸盐和硫代硫酸盐[30].
本研究是世界首次对锦屏地下2 400多米“中国锦屏地下实验室”(CJPL)8号洞的微生物多样性进行研究,后续将对采样处地球物理化学环境进行研究,探索微生物多样性与地球环境间的关系,为研究极端微生物能量溯源奠定基础,对于推动生物科学,探索新的可开发生物资源有着重要意义.
