江西省5个规模化猪场健康猪群中猪链球菌的流行病学调查及耐药性研究
2021-01-27谭美芳曾艳兵李海琴
谭美芳,谭 佳,曾艳兵,杨 群,李海琴
(江西省农业科学院畜牧兽医研究所,江西南昌 330200)
【研究意义】近年来,随着我国养猪业快速发展,现代猪场逐渐趋于集约化,养殖密度不断扩大,猪的疫病特别是细菌性疫病的发生也逐渐频繁,给养猪业的发展带来了巨大危害,因此控制和消灭规模化猪场的常见细菌性疫病已成为当前能否促进养猪业发展的关键因素之一[1-2]。猪链球菌(Streptococcus suis,SS)是定植于猪上呼吸道的一种具有荚膜的革兰氏阳性球菌,主要引起猪的脑膜炎、全身性败血症、胸膜肺炎、关节炎和心内膜炎等,部分血清型的菌株可引起多发性浆膜炎、流产和局部脓肿,在世界范围内流行,病发率和病死率均居高不下,是当前严重困扰我国生猪养殖业的常见传染性细菌病之一[3]。因此,检测临床健康猪群猪链球菌的携带情况以及病原菌对抗生素的耐药情况,对于更好地监控猪链球菌耐药性、防治猪链球菌病以及有效防控猪链球菌的暴发具有重要意义。
【前人研究进展】表观健康猪的鼻腔、扁桃体等是猪链球菌自然感染部位,不同日龄阶段的猪对其均有易感性,其中新生仔猪、哺乳仔猪的发病率和致死率最高[4]。根据荚膜抗原成分,可将猪链球菌分为35个血清型(1~34、1/2),其中1、2、7 和9 型是猪的常见致病菌,而2 型猪链球菌被认为是分布最广、致病性最强的一种血清型,不仅给养猪业造成巨大的经济损失,也对人类的生命安全构成威胁[5]。目前,生猪产业主要通过灭活苗和抗生素来预防和控制猪链球菌的感染,但单价疫苗免疫不能对多种血清型产生交叉保护作用,所以通过抗生素治疗细菌感染仍是一种常见的手段。养殖户通过在饲料中长期添加抗生素药物或者直接肌肉注射来预防和处理未发病或已发病的猪群[6]。近年来,由于抗生素的滥用,特别是在动物饲料中添加抗生素及在疾病治疗过程中不合理用药,很容易造成细菌敏感性降低,产生耐药菌株,增加细菌病的治疗难度,严重影响养猪业的发展[7]。总结2000年以来的猪链球菌耐药的报道,目前我国猪链球菌对氧氟沙星、阿莫西林、多西环素、大环内酯类药物、万古霉素、林可霉素、红霉素、大观霉素等均表现差异耐药性[8]。【本研究切入点】猪链球菌在江西省规模化猪场中的流行和耐药情况尚不清楚。而且,当前对猪链球菌耐药性的报道主要是针对发病猪群,对临床上表观健康猪群中携带的猪链球菌的耐药性问题缺乏调查研究。【拟解决的关键问题】本研究选定江西省部分大型规模化猪场,调查临床表观健康猪群的猪链球菌流行率,对分离株进行耐药性测定,旨在掌握该菌在省内的流行现状,为养殖场合理用药提供科学依据和技术支持,以期科学有效地防控猪链球菌病在猪场中的蔓延和流行,降低养殖成本,促进经济效益最大化,同时从源头上减少耐药菌株的产生,降低耐药菌株传播的风险。
1 材料与方法
1.1 样本来源
1.1.1 健康猪群鼻拭子 样本来自2017—2019年江西省遂川县、南昌县、萍乡市和泰和县4个市县的5个规模化猪场。在临床健康的保育猪群中随机挑选猪只总计314 头,经体积分数75%酒精棉擦拭猪鼻表面后,用无菌棉签采集鼻液拭子总计314份。将鼻拭子保存在生理盐水中,4 ℃冷藏运输和保存。
1.1.2 参考菌株 本研究所用的阳性参考菌株为猪链球菌2型四川分离株SC19,由华中农业大学分离,本实验保存。根据美国临床与实验室标准学会(Clinical and laboratory standards institute,CSLI)推荐,药敏实验过程中的质控菌株为金黄色葡萄球菌标准菌株ATCC6538,购自上海奥陆生物科技有限公司。
1.2 主要试剂
PremixTaqDNA 聚合酶、DL2000 DNA marker 购自大连Takara 公司;胰蛋白胨大豆琼脂(TSA)、胰蛋白胨大豆肉汤(TSB)、哥伦比亚CNA 琼脂基础、5%脱纤维绵羊血购自青岛海博生物技术有限公司;新生牛血清(无噬菌体低内毒素)购自杭州四季青生物工程材料有限公司;细菌微量生化反应管和革兰氏阳性球菌药敏试纸盒购自杭州滨和微生物试剂有限公司。引物由深圳华大基因科技有限公司合成。
1.3 细菌分离培养及初步鉴定
用无菌接种环蘸取鼻拭子液,划线接种至含5%脱纤维绵羊血的CNA 平板上,37 ℃恒温培养24 h。选取具有溶血环、半透明、边缘整齐的针尖状小菌落进行革兰氏染色,观察形态。若镜检结果为散在的或短链状的革兰氏阳性球菌,则为可疑菌落,接种到新鲜的CNA血平板上继续划线纯培养。细菌经过纯培养后进行生化鉴定,用微量生化反应管进行糖发酵和其他生化实验,观察结果。选取部分疑似菌株,由武汉塞维尔生物科技有限公司通过扫描电镜观察细菌形态。
1.4 猪链球菌的PCR鉴定
用煮沸法制备细菌基因组DNA。鉴定猪链球菌16S rDNA 的引物、鉴定猪链球菌2 型cps2J基因的引物见表1。反应体系(20 µL)为:2×Taqmixture 10 µL,上游引物1 µL,下游引物1 µL,模板2 µL,ddH2O 6µL。PCR 反应程序为:95 ℃预变性5 min;95 ℃30 s,56 ℃30 s,72 ℃1 min,共28 次循环;72 ℃延伸10 min。扩增产物进行10 g/L 琼脂糖凝胶电泳。在所有的PCR 反应中,SC19 的基因组用作阳性对照,ddH2O 作为阴性对照。

表1 本实验所涉及的引物Tab.1 Primers used in this study
1.5 药敏试验
采用Kirby-Baner(KB)纸片扩散法检测猪链球菌的药敏情况:将细菌接种至含5%新生牛血清的TSA平板上,37 ℃恒温培养24 h;用无菌棉签蘸取3~5个单菌落,于1 mL生理盐水中稀释,将菌液浓度调整至0.5麦氏比浊度;另取无菌棉签浸润菌悬液,均匀涂布到新鲜TSA培养基表面;待平板室温干燥5 min,用镊子取药敏片贴在琼脂表面;贴好药敏片后15 min内,将平板在37 ℃条件下恒温倒置培养18 h。培养后取出平板,量取抑菌圈直径,抑菌环的边缘以肉眼看不见细菌为限,判读结果,以敏感(S)、中介(I)、耐药(R)报告。
2 结果
2.1 猪链球菌形态观察
细菌在含新生牛血清的TSA固体培养基上生长良好,形成透明、湿润、圆滑、边缘整齐的小菌落,具有淡蓝色荧光。在含5%新生牛血清的TSB培养基中培养12~24 h,呈均匀浑浊。在CNA血平板上呈现α溶血。革兰氏染色结果显示,猪链球菌在固体培养基上以单在和双球菌为主,部分呈短链状态(图1a),在液体培养基中则以长链形态为主。通过扫描电镜(50 000×)能观察到卵圆形的细菌形态(图1b)。
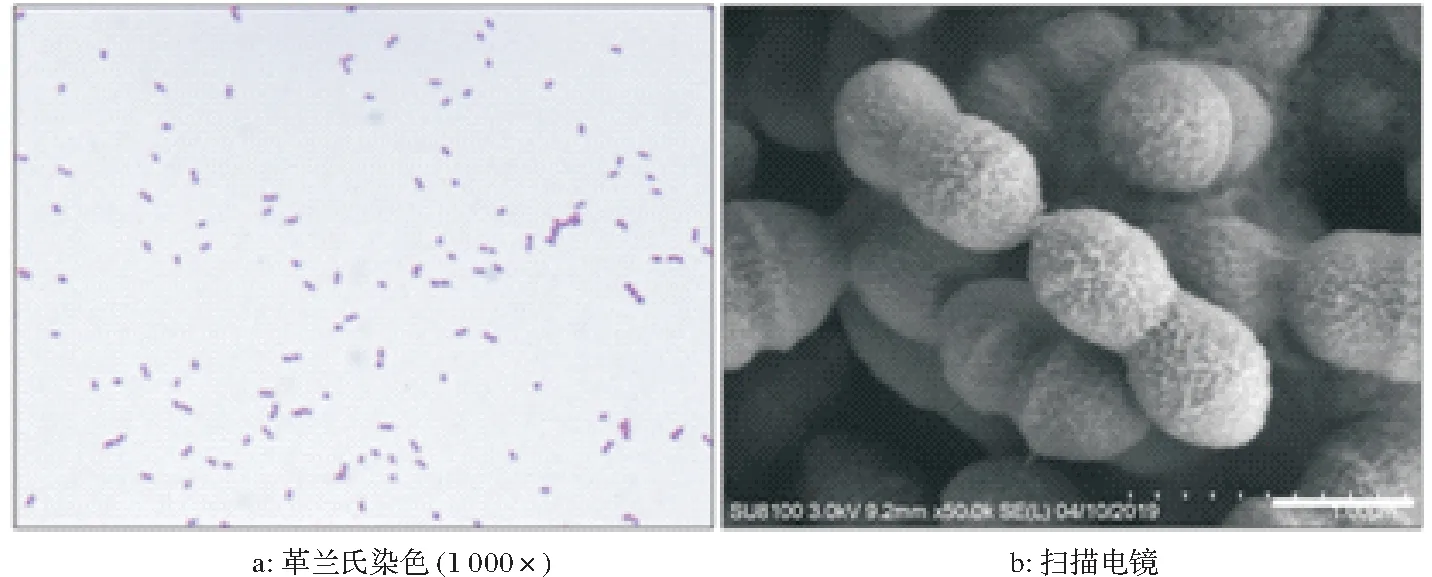
图1 猪链球菌形态(标尺:0.5µm)Fig.1 Morphology of S.suis
2.2 细菌的生化鉴定
实验结果显示,临床分离的猪链球菌菌株对葡萄糖、核糖、甘露醇、甘露糖、山梨醇、乳糖、棉籽糖、阿拉伯糖、七叶苷、精氨酸、MR和VP的生化反应结果差异很大,对糖的发酵不活泼,无规律不稳定,难以作为分类依据。
2.3 猪链球菌PCR鉴定
本研究共采集到314 份表观健康猪群的鼻拭子样本。通过对猪链球菌特异性基因(16S rDNA)的PCR 鉴定,共计有112 株疑似菌株扩增到了294 bp 的目的基因片段(图2),证实为猪链球菌,检出率35.67%。对这112株猪链球菌再次进行PCR 鉴定,目的基因是猪链球菌2型特异性基因cps2J,目的片段大小为500 bp(图3)。此次研究未检测到猪链球菌2型菌株,检出率为0%。

图2 猪链球菌16S rDNA扩增结果Fig.2 PCR amplification of S.suis 16S rDNA

图3 猪链球菌2型的PCR鉴定结果Fig.3 PCR identification of S.suis type 2
2.4 猪链球菌流行病学分析
本次调查中,表观健康猪群中的猪链球菌总检出率为35.67%,各个规模化猪场的检出率统计学差异显著(统计学方法:One-way analysis of variance,P<0.001)(表2)。其中,南昌的规模猪场检出率为62.86%,显著高于其他地区(P<0.001),萍乡和泰和的3家规模猪场的细菌检出率无明显差异(P>0.05)。不同地区的猪链球菌的检出率结果见表2。
2.5 耐药性监测
用苯唑西林、青霉素G、红霉素、大观霉素、克拉霉素、万古霉素、克林霉素、氯霉素、四环素、米诺环素、诺氟沙星、环丙沙星、左氟沙星、多粘菌素B、复方新诺明和呋喃妥因等16 种抗生素对分离鉴定出的猪链球菌菌株进行药敏试验,结果见表3。

表2 2017—2019年江西省规模化猪场中SS流行情况Tab.2 The prevalence of SS in large-scale pig farms in Jiangxi Province from 2017 to 2019
药敏试验结果显示,112株猪链球菌对数种抗生素的耐药情况严重,有96.43%的菌株对克林霉素耐药,91.96%的菌株对四环素耐药。其次耐药情况比较严重的是:克拉霉素耐药率66.96%、红霉素耐药率66.07%、大观霉素耐药率53.57%。对于其他抗生素,猪链球菌菌株表现出高度或者中度敏感性,如对万古霉素的敏感率可达99.11%,对青霉素的敏感率达96.43%,对米诺环素的敏感率为95.54%。

表3 SS分离株的药敏试验结果(n=112)Tab.3 The antibiotic susceptivity profiles of SS isolates
从统计结果看,地域因素对猪链球菌耐药的影响也非常明显(表4)。5个规模化猪场分离的菌株,除对克林霉素、米诺环素、四环素和万古霉素的耐药或者敏感情况一致外,对其余12种抗生素的耐药率差异较大。以红霉素为例,5个猪场的耐药率分别为58.33%、36.36%、75.00%、95.00%、92.86%,差异非常显著(统计学方法:One-way analysis of variance,P<0.001)。猪场A、猪场B、猪场D 与猪场E 都分离出对左氟沙星、环丙沙星、氯霉素、苯唑西林、诺氟沙星、复方新诺明耐药的菌株,猪场C 则未分离出对这6 种抗生素耐药的菌株。从该猪场分离出的菌株,对红霉素、大观霉素的耐药率也与其他四家猪场的差异显著。此外,在猪场B和猪场E均分离到对青霉素G耐药的菌株,其余3家猪场则没有分离到。

表4 不同规模化猪场的SS耐药情况分析Tab.4 Analysis of SS antibiotic-resistance results in different pig farms
2.6 猪链球菌多重耐药检测结果
表观健康猪群所携带的猪链球菌的耐药谱以多重耐药为主。如表5所示,检测的112株细菌中,5重耐药菌有26株,占比23.21%;6重耐药菌有28株,占比25.00%;7、8、9重耐药菌的占比也较高。在此次试验中,从猪场B分离出的编号为SS040的菌株,对左氟沙星、环丙沙星、苯唑西林、克林霉素、诺氟沙星、青霉素G、四环素、复方新诺明、多粘菌素B、红霉素、克拉霉素等11种抗生素耐药,对氯霉素和米诺环素2种抗生素中介。从猪场E分离出的编号为SS100的菌株,对左氟沙星、环丙沙星、苯唑西林、克林霉素、诺氟沙星、青霉素G、四环素、复方新诺明、多粘菌素B、红霉素、克拉霉素、大观霉素等12种抗生素耐药。
112 株猪链球菌中,地域因素对猪链球菌耐药谱的影响也非常明显,来自相同猪场的菌株的耐药谱比较接近,不同猪场间的耐药谱差异较大。5家猪场分离出的猪链球菌普遍对克林霉素和四环素耐药。除此之外,猪场A的12株分离菌主要对红霉素、克拉霉素和大观霉素耐药;猪场B的44株分离菌主要对左氟沙星、环丙沙星、苯唑西林、诺氟沙星、复方新诺明、呋喃妥因和大观霉素耐药;猪场C的8株分离菌主要对呋喃妥因、红霉素和克拉霉素耐药;猪场D的20株分离菌主要对左氟沙星、环丙沙星、呋喃妥因、红霉素和克拉霉素耐药;猪场E的28株分离菌主要对苯唑西林、诺氟沙星、复方新诺明、红霉素和克拉霉素耐药。
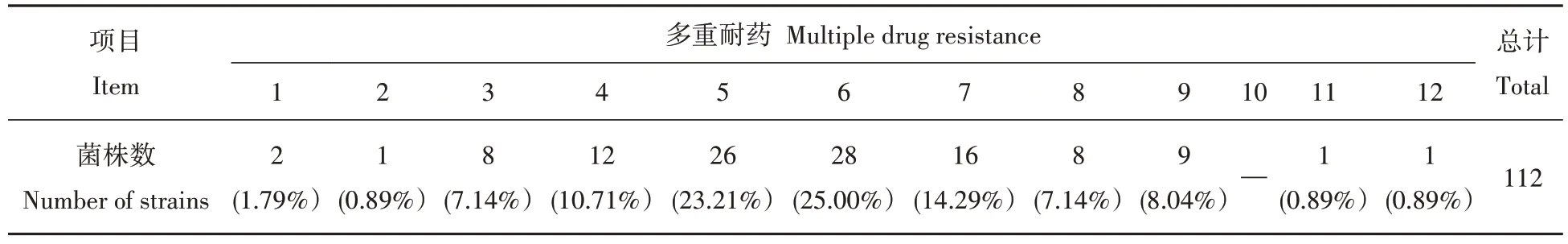
表5 SS菌株的多重耐药性情况分析Tab.5 Analysis of multiple drug resistance of SS strains
3 讨论与结论
伴随我国养猪业集约化程度越来越高,细菌性疾病的发生趋势逐渐复杂[1]。猪感染猪链球菌的病例也被频繁报道[5,9]。猪链球菌属于条件性致病菌,作为常在菌群可被感染猪、康复猪或健康猪携带。在一个被猪链球菌严重污染过的猪场,猪的带菌率可达100%,但该病的发病率不同时期各不相同,通常情况下低于5%[10]。近几年来,我国广大农牧区及许多养猪场出现了来势猛烈、传播快、病程短、死亡率高的败血型链球菌病,造成了重大的经济损失[10]。南京农业大学对华南地区屠宰群中猪链球菌的流行病学调查结果显示,401 份屠宰猪的扁桃体的阳性检出率38.4%[11]。华中农业大学动物疫病诊断中心对全国21 个省市送检的12 452 份临床病料进行细菌分离和鉴定,从中分离到致病菌3 926 株,其中猪链球菌占所分离细菌总数37.42%[12]。本研究对江西省省内规模化猪场进行猪链球菌的流行病学调查,发现猪链球菌在临床健康猪群中的检出率为35.67%,与上述大规模的猪链球菌流行病学调查数据一致。另外,本次调查中表观健康猪群的链球菌2型检出率为0%。2011—2012年,江西省疾病预防控制中心在曾发生过猪链球菌感染人的景德镇市和崇仁县开展健康猪携带猪链球菌的状况调查,从301份鼻拭子和扁桃体样品中分离2株猪链球菌2型,分离率也仅为0.66%[13]。据江苏省兽医研究所报告,江苏地区健康猪群对猪链球菌2型42.6%的携带率[14],这与上述两次江西省的调查数据差异较大,可能是因为地区差异。
从临床用药的角度看,猪链球菌菌株对万古霉素的敏感率最高,但是因为万古霉素对机体的副作用较大(神经损伤、肾功能损伤等),一般不建议作为抗生素疗法的首选。β-内酰胺类抗生素(青霉素G)作为临床上长期使用的杀菌药物,仍然对猪链球菌保持着高度敏感性,是理想的治疗或者预防猪链球菌病的抗生素。
过度使用抗生素而引起细菌耐药发展速度加快是一个共识,抗生素的常态化使用(饲料添加剂,消毒剂,食品和饲料的防腐剂或净化剂)被认定是耐药菌产生和耐药基因传递的主要因素[15]。研究数据表明,国内猪链球菌对临床使用频率较高的抗生素耐药情况严重,主要有四环素、大环内酯类、头孢菌素类、喹诺酮类以及磺胺类抗生素,并且出现了大量多重耐药株[16]。本次试验结果表明,省内猪链球菌的耐药情况已相当严峻。分离出的112株猪链球菌,至少对1种抗生素耐药,多重耐药菌株占大多数,甚至出现了11 重、12 重耐药菌株。几乎全部的菌株都对四环素耐药,可能是由于四环素类抗生素被广泛用于饲料添加剂,超标的剂量导致细菌选择性进化,耐药情况严重。此外,药敏试验结果显示,已有耐青霉素的菌株出现,不容乐观。耐药菌株往往在抗生素超标使用的“选择性压力”下出现,因此强化养殖从业人员科学合理使用抗生素的意识非常重要。
通过此次调查结果可以看出,各个规模化猪场的猪链球菌流行率和耐药率差异较大,从侧面反映出各个猪场养殖模式和管理的差异性,例如在日常生产过程中抗生素的选择、使用情况等。为预防猪链球菌的发生,猪场应注意改善环境条件,加强饲养管理,尽量减少致病的应激因素[17]。临床症状出现时,若选择了对细菌不敏感的抗生素,导致治疗过程费时费力,无效且增加成本,更易产生耐药性[12]。因此,有条件的规模化猪场可以考虑定期分离菌株,进行药敏试验,一旦发病,尽快选择敏感药物合理使用,同时在发病期间对整个猪群进行药物预防,使疫病得到有效控制,减少损失。规模化猪场应高度重视细菌耐药性问题,通过实验室摸清猪场致病菌种类,建立完善、合理的细菌性疾病监测方案,防患于未然。
致谢:华中农业大学胡巧博士和合作猪场对本研究给予了支持和帮助,谨致谢意!
