水力空化场下苯-甲醇低温烷基化制备二甲苯
2021-01-27陈吉超马凤云刘景梅李学宽魏贤勇殷双杰
陈吉超, 马凤云, 刘景梅, 钟 梅, 李学宽, 魏贤勇, 殷双杰
(1.新疆大学 化学化工学院 煤炭清洁转化与化工过程新疆维吾尔自治区重点实验室,新疆 乌鲁木齐 830046;2.中国科学院 山西煤炭化学研究所,山西 太原 030001;3.中国矿业大学 煤炭加工与高效洁净利用教育部重点实验室,江苏 徐州 221116;4.新疆大化富山化工有限公司,新疆 石河子 831300)
在中国,基础化工原料苯和甲醇的产能利用率约为77%和70%[1-3],产能严重过剩;而随着聚酯行业的迅速发展,二甲苯却供不应求。2018年,中国二甲苯的进口量超过总需求量的60%[4-5]。目前,二甲苯主要通过石脑油路线获得,通过石脑油加氢精制、催化重整、甲苯歧化、二甲苯异构化等多个反应和一系列分离单元得到[6-8],反应温度高达500~600 ℃。由于中国多煤少油的能源供应格局,仅通过原油获得的二甲苯难以满足需求。因此,若能以由煤制得的苯和甲醇为原料,通过烷基化反应一步制得二甲苯,将为二甲苯的生产开辟一条新的途径。
苯和甲醇烷基化反应的产物主要有甲苯、二甲苯等。目前,对该反应的研究主要集中于反应催化剂的改性,以提高反应物的转化率和目标产物的产率。Gao等[9]制备了Co3O4-La2O3/ZSM-5催化剂,在500 ℃下催化苯-甲醇烷基化反应,苯的转化率为51.36%,甲苯和二甲苯的选择性分别为52.29%和38.07%。Wang等[10]以ZSM-5-AT-OT为催化剂,在400 ℃下催化苯-甲醇烷基化反应,苯的转化率为57.61%,甲苯和二甲苯的选择性分别为44.75%和36.02%。陆璐等[11]制备了6%MgO/ZSM-5催化剂,在460 ℃下催化苯-甲醇烷基化反应,苯的转化率达到55%,二甲苯的选择性超过35%。Hu等[12]以ZSM-5为催化剂,在400 ℃下催化苯-甲醇烷基化反应,苯的转化率为59.5%,甲苯和二甲苯选择性分别为39%和49%。由上述研究可知,苯和甲醇烷基化反应均采用传统的固定床反应器,对反应温度要求较苛刻。
研究表明[13-16],很多在苛刻条件下才能发生的反应,通过水力空化场的强化,在温和条件下便可发生。陈辉等[13]在入口压力4 MPa下使用水力空化装置处理沙特重质原油,使其黏度降低了46.98%。Askarian等[14]在入口压力0.4 MPa下用水力空化装置处理稠油,反应15 min,稠油黏度降低33%,C—S键断裂,S含量降低。Ye等[15]利用孔板与文丘里管组合复合型空化管,提高洗油中萘的含量,结果表明,当反应终温为75 ℃时,萘质量分数提高了7.33百分点。同课题组的Liu等[16]在入口压力为2.4 MPa和反应终温为50 ℃条件下,利用该装置强化甲苯-水歧化反应,其甲苯转化率为19.66%,对二甲苯选择性为8.56%。
迄今为止,尚未见到利用水力空化场强化苯-甲醇烷基化反应的研究报道。笔者在水力空化场下进行苯和甲醇烷基化反应,考察了反应终温、苯摩尔分数、入口压力和反应时间等因素对苯、甲醇的转化率及各产物选择性的影响,并依据反应产物推导和验证了反应历程,探讨水力空化场强化苯-甲醇烷基化反应一步制备二甲苯的可能性。
1 实验部分
1.1 试剂与仪器
反应物苯和甲醇,分析纯,天津永晟精细化工有限公司产品。色谱分析用试剂:苯和正己烷,天津大茂化学试剂厂产品;甲醇和甲苯,天津市风船化学试剂科技公司产品;乙苯和邻二甲苯,上海麦克林生化公司产品;对二甲苯和正丁醇,上海阿拉丁生化技术公司产品;1,4-二甲基环己烷和1,3-二甲基环己烷,梯系爱上海化成工业有限公司产品;1,2-二甲基环己烷,东京化成工业株式会社产品;苯酚和乙基环己烷,赛默飞世尔科技有限公司产品;色谱分析试剂均为色谱纯。
空化反应装置由物料循环反应部分和循环冷却部分组成。前者由离心泵、主管路、旁路和空化管等组成闭路循环系统。空化管是循环反应部分核心,其收缩段长度为10 mm,扩张段长度为22 mm,内径为10 mm,孔径为2 mm。循环冷却部分由冷阱(SHZ-D(III)型,上海东玺制冷仪器公司产品)、管路和立式储罐的夹套等组成,冷却剂为乙二醇。
1.2 实验过程
配制苯摩尔分数(rB)为10%~50%的苯-甲醇混合液1 L,加入立式储罐;启动冷阱,将物料冷却至5 ℃;启动离心泵,通过旁路调节空化管的入口压力0.2~0.6 MPa,物料在空化反应装置内循环,反应时间10~60 min。每次实验的反应初温都为5 ℃,物料在装置中进行循环升温反应。在反应期间,不断调节冷阱功率,严格控制物料的升温速率,使物料在要求的反应时间内升至设定温度反应。反应完成后,关泵、排出物料、自然冷却至室温、取样、分析。
1.3 组分分析及其计算
采用GC-MS-QP2010气相色质联用仪(日本岛津公司产品)定性分析反应物系的组成,色谱柱DB-5MS,30 m×0.25 mm×0.25 mm。气相色谱条件:进样量1.0 μL,进样口温度250 ℃,分流比30:1,柱流速1.2 mL/min。色谱柱升温50 ℃,保持5 min;再以升温速率6 ℃/min升温至250 ℃,保持10 min。质谱条件:离子源温度250 ℃,接口温度250 ℃,溶剂延迟4 min,Scan模式,采集时间2~52 min。
采用GC7900气相色谱仪(上海天美科学仪器有限公司产品),以正丁醇为内标物,用内标法定量分析空化反应后物系组成[17]。通过式(1)~(4)分别计算物系各组分的相对校正因子(fis)、质量(mi,g)、产物选择性(si,%)[18]和反应物的转化率(x,%)。
fis=fi/fs=miAs/(msAi)
(1)
mi=fismsAi/As
(2)
si=(ni/nB)×100%
(3)
x=(m0-m1)/m0×100%
(4)
式(1)~(4)中:As和Ai分别为正丁醇和物系中i组分的峰面积;ms和mi分别为正丁醇和物系中i组分的质量,g;ni和nB分别为反应后物系中i组分和苯的物质的量,mol;m0和m1分别为反应物苯或甲醇反应前、后的质量,g。
采用紫外-可见分光光度计(UV2450型,日本岛津公司产品)对苯酚标准水溶液和水相产物进行紫外全波长扫描。苯酚标准水溶液质量浓度为50 mg/L;水相产物由65 ℃热水萃取反应后物系得到。采用卡尔费休水分测定仪(V20型,梅特勒仪器有限公司产品)测定空化反应后物系的含水量。
使用Materials Studio 6.1分子计算软件Dmol3模块(美国Accelrys公司产品),计算甲基取代苯环邻位、间位和对位等位置的氢生成相应烷基苯的反应活化能和烷基苯加氢生成相应烷基环烷烃的反应活化能。
2 结果与讨论
2.1 苯-甲醇水力空化烷基化反应历程
2.1.1 苯-甲醇烷基化反应产物组成分析
图1为苯-甲醇水力空化烷基化反应产物的气相色谱图;表1为反应产物的分子结构式及其校正因子。根据GC-MS谱中各峰的保留时间并检索标准谱库NIST05,结合图1可知,谱峰1至谱峰8依次为:甲苯、1,3-二甲基环己烷、1,4-二甲基环己烷、1,2-二甲基环己烷、乙基环己烷、乙苯、对二甲苯(p-X)和邻二甲苯(o-X)的特征峰。这表明在水力空化场强化下,苯与甲醇在低温下确实发生了烷基化反应。由表1可知,上述物质与其特征峰的匹配度均不小于90%,说明定性分析结果可靠;同时,各组分的相对校正系数均小于1.0,说明该混合物系为非理想性溶液,各组分分子间的相互作用不可忽略。

图1 苯-甲醇水力空化烷基化反应产物的GC-MS谱图Fig.1 Total ion chromatogram of reaction products of benzenewith methanol in the hydrocavitation field1—Toluene; 2—1,3-Dimethylcyclohexane;3—1,4-Dimethylcyclohexane;4—1,2-Dimethylcyclohexane; 5—Ethylcyclohexane;6—Ethylbenzene; 7—p-Xylene; 8—o-XyleneReaction conditions: T=40 ℃;p=0.4 MPa; rB=10%; t=30 min
2.1.2 苯-甲醇烷基化反应历程分析
依据水力空化原理:在苯-甲醇水力空化烷基化反应中,当反应料液流过文丘里空化管喉部处,流速增至最大,使动压头增至最大,静压头减至最小,并接近或低于料液的饱和蒸汽压,致使料液发生汽化,产生大量的空泡,且逐渐长大。随着料液流向空化管下游,流道截面逐渐扩大,料液流速逐渐降低,动压头减小,静压头增加。当静压头增至大于料液的饱和蒸汽压后,空泡瞬间溃灭。溃灭点不仅产生高温高压“热点”,且产生高能微射流,对反应物分子形成强烈的冲击,使苯和甲醇分子化学键断裂,产生相应的自由基,进而发生烷基化反应。
依据图1所示的水力空化烷基化反应产物的组成,推测苯-甲醇烷基化反应历程,如图2所示。由图2可知,首先,苯解离产生·C6H5和·H,甲醇解离产生·CH3和·OH(反应(1))[17]。继而,在空化场强烈湍动影响下,这4种自由基激烈碰撞发生如下反应:·OH与·C6H5生成苯酚(反应(2)),·OH与·H生成H2O(反应(3)),·CH3与·C6H5生成甲苯(反应(4))。由于反应(2)和(3)的发生,使物系中·CH3相对过剩,进而促发了·CH3取代甲苯上苯环氢或甲基氢的反应,对应生成p-X和·H(反应(5))、o-X和·H(反应(6))、m-X和·H(反应(7))或乙苯和·H(反应(8))。同理,由于反应(5)~(8)的发生,物系中·H相对过剩,又促发了二甲苯和乙苯与·H的加氢反应,生成相应的二甲基环己烷(反应(9)、(10)和(11))和乙基环己烷(反应(12))。另外,上述反应均为可逆反应,最终达到动态平衡。
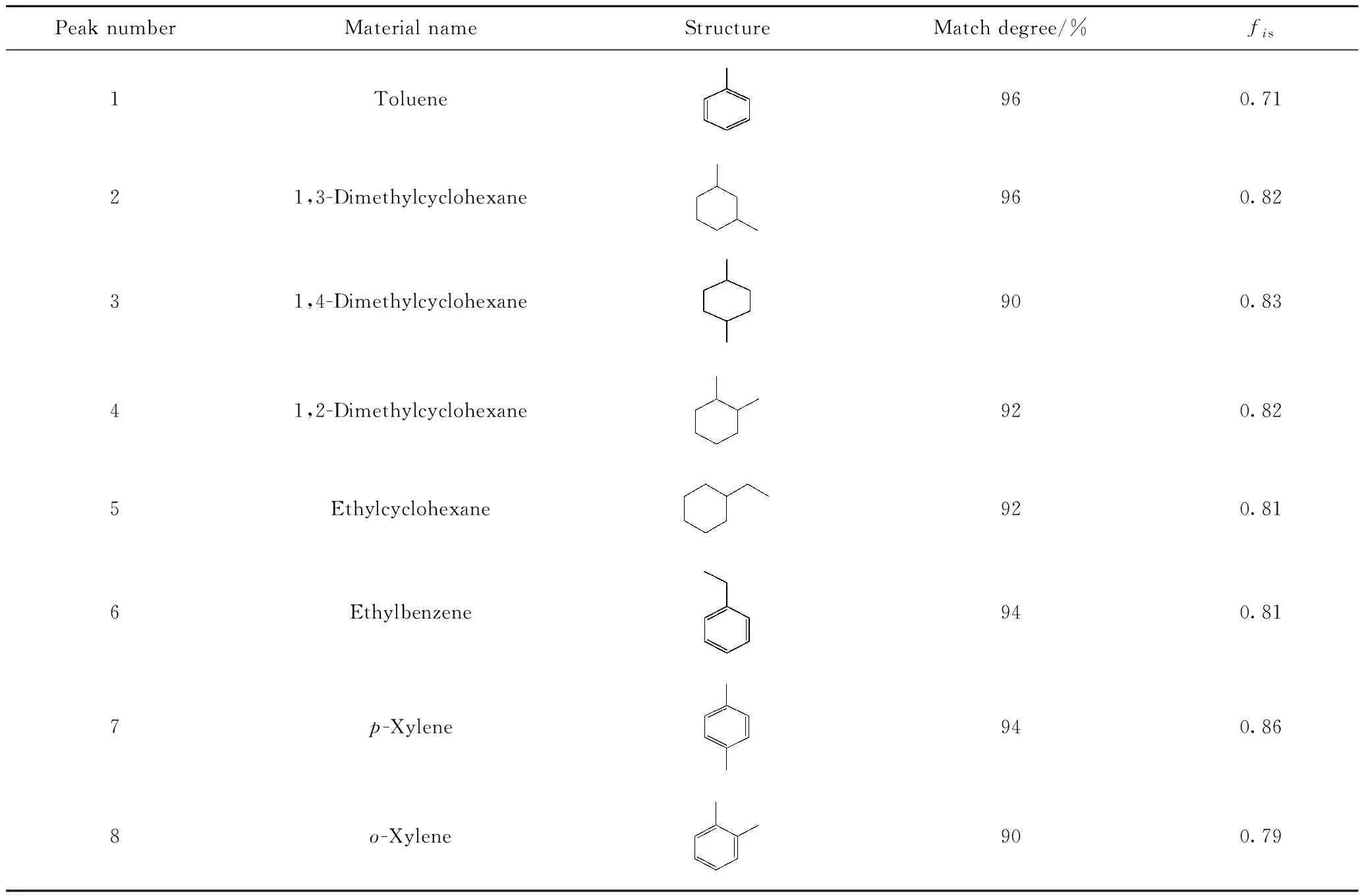
表1 苯-甲醇水力空化烷基化反应后体系组分的结构式及其相对校正因子Table 1 Structural formula and relative correction factor of alkylation reaction products

图2 苯-甲醇水力空化烷基化反应历程推测Fig.2 Alkylation reaction process of benzene with methanol in the hydrocavitation field
但是,图1中并未出现m-X的特征峰。此现象在笔者所在课题组前期研究水力空化场强化甲苯-水歧化反应中也曾出现过[17]。分析其因应该是甲苯上的甲基为给电子基团,属于邻、对位定位基。当甲苯发生取代反应时,·CH3更易进入邻位和对位[19]。为进一步定量认识此现象,借助于Materials Studio 6.1中的Dmol 3模块,对该烷基化反应进行了过渡态搜索计算。结果表明,甲苯与·CH3生成p-X、o-X和m-X等的反应活化能分别为67.3、96.4和286.5 kJ/mol,即生成m-X的反应活化能分别是生成p-X和o-X的4.26倍和2.97倍。相对于p-X和o-X生成,m-X不易生成。而p-X、o-X和m-X 加氢对应生成1,4-二甲基环己烷、1,2-二甲基环己烷和1,3-二甲基环己烷等的反应活化能分别为25.74、18.45和25.35 kJ/mol,仅为生成p-X、o-X 和m-X反应活化能的38.24%、19.13%和8.85%。这说明相对于反应(7),反应(11)非常容易发生,即使生成少量的m-X,它也会迅速生成1,3-二甲基环己烷。
依据反应(2),产物中应该有水生成,故采用卡尔费休法定量测定了体系中含水量。结果测得产物中水的质量分数为3.98%。
依据反应(3),产物中应该有苯酚存在。笔者采用紫外-可见分光光度计法,检测样品中是否有苯酚存在。苯酚标准溶液和空化烷基化反应产物体系水相的紫外全波长扫描结果如图3所示。由图3可见,苯酚标准水溶液与水相产物在270 nm波长处均出现最大吸收峰,且曲线形状相似,表明反应产物中有苯酚存在。图1中之所以未出现苯酚的特征峰,是因苯酚与水易形成分子间氢键而溶于水相,有机相中苯酚含量过低所致[16]。
由此,也从三个方面充分表明图3所推测的苯-甲醇水力空化烷基化反应历程是合理可信的。
2.2 反应工艺条件的优化
以提高苯和甲醇的转化率及产物中二甲苯的选择性为目标,采用单因素实验法,通过考察反应终温(T)、苯摩尔分数(rB)、空化管入口压力(p)、反应时间(t)等因素对目标值的影响,确定了最佳的水力空化苯-甲醇烷基化工艺条件。

图3 苯酚标准水溶液和苯-甲醇烷基化空化反应水相产物紫外谱图Fig.3 UV spectra of phenol standard aqueous solutionand aqueous phase of alkylation products
2.2.1 反应终温的影响
在空化管入口压力0.4 MPa、反应时间 30 min、苯摩尔分数10%条件下,考察反应终温对反应物转化率和产物选择性的影响,结果如图4所示。由图4可知:当反应终温从20 ℃升至60 ℃时,苯和甲醇的转化率及二甲苯的选择性均先升高后降低,甲苯的选择性先降低后升高;在40 ℃时,苯的转化率为27.68%,甲醇的转化率为4.71%,二甲苯的选择性为35.25%,均达到最大值,而甲苯的选择性最低,为37.71%;乙苯、二甲基环己烷、乙基环己烷和苯酚的选择性随温度变化不大。
水力空化场的空化状态可用空化数(Cv)半理论半经验描述,如式(5)[20]所示。
(5)
式(5)中:p2为流场下游的恢复压力,Pa,因流场下游出口位于液面上方,则p2为大气压;pv为反应温度下苯-甲醇混合液的饱和蒸汽压,Pa;ρ为苯-甲醇混合液的密度,kg/m3;u0为物料通过空化管缩口处的流速,可由连续性方程(6)计算得到。
A0u0=A1u1
(6)
式(6)中:A0和A1分别为空化管缩口和主管路的截面积,m2;u1为主管路流速,取u1=1.176 m/s,故u0=29.4 m/s。
水力空化场空泡溃灭强度可用空泡溃灭时所产生“热点”处的最高温度(Tmax)和最大压力(pmax)定量表征[21-24],见式(7)和(8)。
Tmax={(Tend+273.15)[p∞(γ-1)/pv]-273.15}
(7)

图4 反应终温对反应物转化率和产物选择性的影响Fig.4 Effects of reaction final temperature on the conversion of reactants and selectivity of products(a) Conversion of reactants;(b) Selectivity of productsReaction conditions: p=0.4 MPa; t=30 min; rB=10%
pmax=pv[p∞(γ-1)/pv]γ/(γ-1)
(8)
式(7)~(8)中:Tend为反应终温,℃;p∞为远离汽泡处的压力,Pa,可由Fluent计算得到,该反应过程的p∞=2.0×105Pa;γ为苯-甲醇混合液汽化产生蒸汽的绝热指数。由于水力空化过程在几十微秒内完成,时间非常短,故可视其为绝热过程;且设混合溶液汽化所产生的蒸汽为多原子理想气体,则γ=1.315。
温度对水力空化反应效果的影响,来自于内因和外因两个方面。内因在于物系的饱和蒸汽压和密度受到温度的影响,导致空化场的空化数(Cv)[25-27]随温度变化;外因即温度影响空化场内空泡溃灭的强度(Tmax和pmax)[21-23]。显然,Tmax和pmax的值越大,表明空泡溃灭的强度越大,所产生的微射流能量越高,空化效果越好[24]。
依据式(5)~(8),可计算出该文丘里管空化场的Cv、Tmax和pmax随反应终温变化的变化曲线,如图5所示。虽然Cv随温度的变化为单调减小,但文献[28-29]认为,Cv对空化效果的影响却是非线性的。当Cv趋近于0.5时,体系处于初始空化态,空泡数量不足,空化效果显然较差;当0.5>Cv>0.15时,随着Cv的减小,空化场充分发展,空泡数不断增加,且空泡发育迅速,大小适中,形成云状空化态,空化效果较为理想,而且当Cv处于0.25附近时,空化效果最好[30];当Cv<0.15后,进入超空化状态,空泡形成过量,导致其尺度过小,空化效果又变差。

图5 反应终温对文丘里管缩口处Cv、Tmax与pmax的影响Fig.5 Effects of reaction final temperature on Cv, Tmax and pmax at shrink of the venture tube(a) Cv; (b) Tmax and pmax
由图5(a)可知:当反应终温从20 ℃升至40 ℃时,空化场Cv从0.27缓慢降至0.24,空化场一直处于云状空化态,空化效果增强;当反应终温为 40 ℃ 时Cv=0.24,产生的空化效果最佳;当反应终温从40 ℃升至60 ℃时,空化场Cv从0.24降至0.15,空化状态由云状空化转向超空化态变化,空化效果减弱。所以,该反应的最佳反应终温为40 ℃。而温度对空泡溃灭的强度(Tmax和pmax)的影响是单调减小的(图5(b)),即随着温度的升高,空泡溃灭的强度是减弱的。当反应终温从20 ℃升至60 ℃时,空泡溃灭点局部的Tmax从2365 ℃迅速降至137 ℃,pmax从67 MPa迅速降至0.12 MPa。反应终温为40 ℃时,Tmax为692 ℃,pmax为2.25 MPa。
2.2.2 苯摩尔分数的影响
在空化管入口压力0.4 MPa、反应时间 30 min、反应终温40 ℃条件下,考察苯摩尔分数的变化对反应物转化率和产物选择性的影响,结果见图6。由图6可知:随着苯-甲醇混合液中苯摩尔分数的增加,苯的转化率不断下降,甲醇的转化率逐渐升高(图6(a)),但反应产物的选择性变化并不明显,其中二甲苯的选择性先升高后降低,而甲苯的选择性先降低后升高(图6(b))。当苯摩尔分数为20% 时,甲苯选择性最小为38.06%,二甲苯选择性达到最大37.96%。这是因为随着混合液中苯摩尔分数的增加,甲醇摩尔分数相对降低,反应体系中·OH和·CH3浓度相对降低,使反应(6)、(8)、(9)、(10)和(11)的反应速率有所减小,但其对乙苯、二甲基环己烷、乙基环己烷和苯酚等产物的选择性影响不大。因目标产物为二甲苯,故选择混合溶液中苯的摩尔分数为20%。

图6 苯摩尔分数(rB)对反应物转化率和各产物选择性的影响Fig.6 Effects of mole fraction of benzene (rB) on the conversion of reactants and selectivity of products(a) Conversion of reactants; (b) Selectivity of productsReaction conditions: p=0.4 MPa; T=40 ℃; t=30 min
2.2.3 空化管入口压力的影响
在反应时间30 min、反应终温40 ℃、苯摩尔分数20%条件下,考察空化管入口压力对反应物转化率和产物选择性的影响,结果如图7所示。由图7 可知:当空化管入口压力从0.2 MPa增至0.6 MPa 时,苯和甲醇的转化率及二甲苯和甲苯的选择性均先升高后降低,且均在0.4 MPa时达到最大值;而乙苯、二甲基环己烷、乙基环己烷和苯酚等的选择性受入口压力的影响不明显。
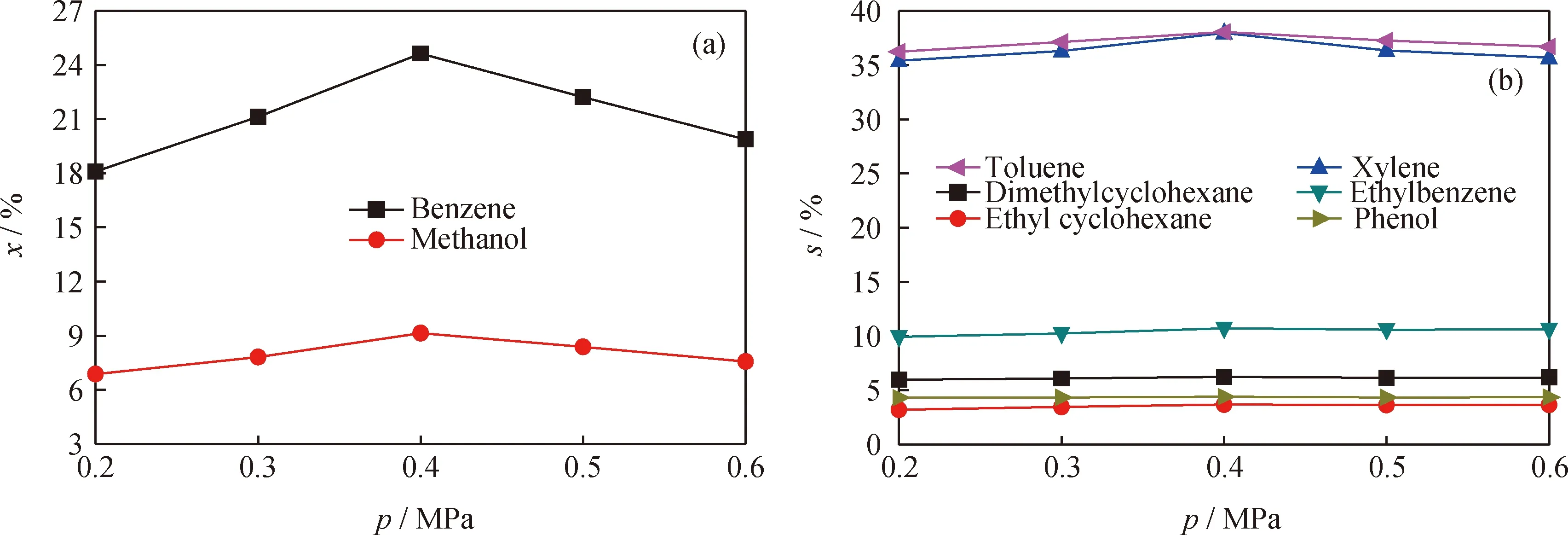
图7 入口压力对反应物转化率和各产物选择性的影响Fig.7 Effects of inlet pressure on the conversion of reactants and the selectivity of products(a) Conversion of reactants; (b) Selectivity of productsReaction conditions: T=40 ℃; t=30 min; rB=20%
图8为空化管入口压力对物料通过文丘里管喉口的流速和空化场空化数的影响。如图8所示,当空化管入口压力从0.2 MPa增至0.4 MPa时,空化管喉口处的空化数从0.38减至0.23,处于空化效果最理想的云状空化。但当入口压力由0.4 MPa增至0.6 MPa时,空化数从0.23减至0.16,即空化状态从云状空化转向超空化状,空化效果减弱。故此,该体系最适宜的空化管入口压力为0.4 MPa。
2.2.4 反应时间的影响
在空化管入口压力0.4 MPa、反应终温40 ℃、苯摩尔分数为20%条件下,考察反应时间对反应物转化率和产物选择性的影响,结果如图9所示。由图9可知,在反应前期的20 min内,苯的转化率快速增至23.36%,甲醇的转化率增至8.82%。之后,二者均缓慢升高,反应40 min后苯和甲醇的转化率基本维持稳定,分别为25.96%和9.89%,而各产物的选择性几乎不受反应时间的影响。这表明反应(1)~(12)均为可逆反应,随着反应时间的延长,每个反应都逐渐达到动态平衡。故而,适宜的反应时间为40 min。

图8 入口压力对物料流过空化管喉口处的流速和空化数(Cv)的影响Fig.8 Effects of inlet pressure on velocity and Cvat shrink of the venture tubeReaction conditions: T=40 ℃; t=30 min; rB=20%
综合上述研究结果,苯-甲醇水力空化烷基化反应的适宜条件为:空化管入口压力0.4 MPa,反应终温40 ℃,苯摩尔分数20%,反应时间40 min。
2.3 反应动力学计算

采用由式(9)和(10)表示的Coast-Redfern反应模型[30],计算苯-甲醇水力空化烷基化反应的动力学参数。
dx/dt=Ae-E/R(T+273.15)×(1-x)n
(9)
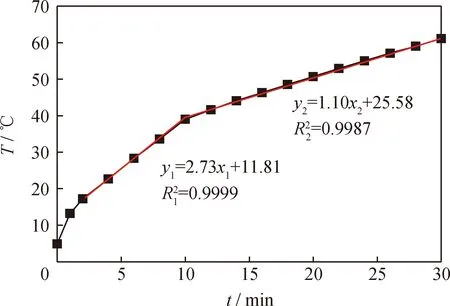
图10 苯-甲醇水力空化烷基化反应温升曲线及其回归方程Fig.10 Temperature rise curve of alkylation of benzenewith methanol in the hydrocavitation fieldReaction conditions: p=0.4 MPa; t=30 min; rB=10%; T=60 ℃
(10)
式(9)和(10)中:x为苯的转化率;t为反应时间,min;n为反应级数;E为反应活化能,kJ/mol;T为反应温度,℃;η为苯的转化程度;xT为反应温度T时苯的转化率;由图4可知,苯的最大转化率在40 ℃时达到,故xmax,40 ℃为反应温度40 ℃时苯的转化率;R为气体常数,R=8.314 J/(mol·K);A为指前因子,min-1。假定n=1,对式(9)积分,得:
ln[-ln(1-x)/(T+273.15)2]=
ln{AR/ψE×[1-2R(T+273.15)/E]}-
E/[R(T+273.15)]
(11)
假定2R(T+273.15)/E≪1,简化得:
ln[-ln(1-x)/(T+273.15)2]=
ln[AR/ψE]-E/[R(T+273.15)]
(12)
式(11)和(12)中:ψ为反应过程的温升速率,℃/min。
针对后2个温度段,分别以ln[-ln(1-x)/(T+273.15)2]对(T+273.15)-1×103作图,见图11。由图11可知,在20~40 ℃段和40~60 ℃段动力学曲线的拟合系数分别为R32=0.9971,R42=0.9972,均接近于1。这表明2个温度段的反应动力学方程拟合度均高,回归方程可靠。依据拟合方程可得:在20~40 ℃段,指前因子和活化能分别为1.043×106min-1和54.21 kJ/mol;在40~60 ℃段,指前因子和活化能分别为6.070×10-16min-1和71.53 kJ/mol。在20~40 ℃段,取T=40 ℃,2R(T+273.15)/E1= 0.096;在40~60 ℃段,取T=60 ℃,2R(T+273.15)/E2=0.077,均远小于1,表明2R(T+273.15)/E≪1假定成立,故该反应为1级反应。2个反应温度段对应的动力学方程分别为:
v1=dx/dt=1.043×106e[(-6.521×103)/(T+273.15)]·
(1-x)
(13)
v2=-dx/dt=6.07×10-16e[(8.603×103)/(T+273.15)]·
(1-x)
(14)
式(13)和(14)中:v1和v2为反应速率,mol/(L·s)。
此外,文献[31]以磷钼杂多酸改性MCM-56 分子筛为催化剂催化苯-甲醇烷基化反应,反应温度为460 ℃时,其表观活化能为163.9 kJ/mol;而笔者研究苯-甲醇烷基化反应在20~40 ℃下的表观活化能为54.21 kJ/mol,显然大幅下降。这是由于水力空化的强烈湍动强化了反应的传热和传质过程,大幅减小了反应物系的热量和质量扩散阻力,显著降低了反应的表观活化能。
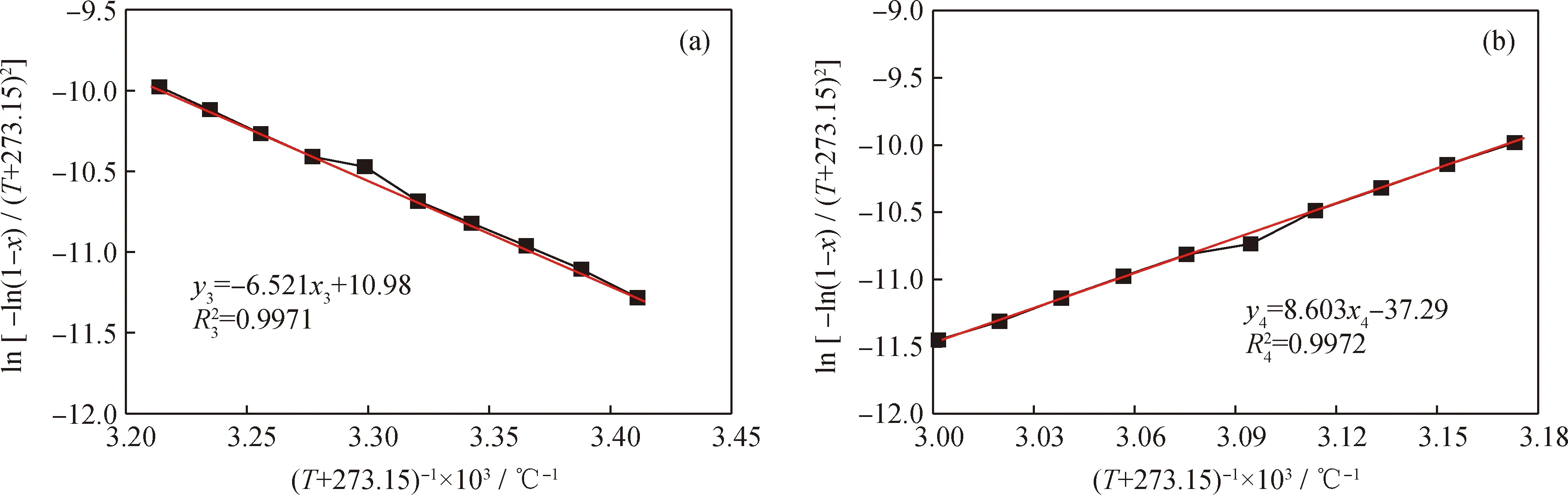
图11 苯-甲醇水力空化烷基化反应动力学曲线及其拟合结果Fig.11 Kinetics curves and fitting results of alkylation of benzene with methanol in the hydrocavitation field(a) 20-40 ℃; (b) 40-60 ℃
3 结 论
通过文丘里型水力空化场强化,苯与甲醇烷基化反应可在低温下(20~60 ℃)进行。这是由于水力空化的强烈湍动强化了反应的传热和传质过程,大幅减小了反应物系的热量和质量扩散阻力,显著降低了反应的表观活化能。
苯-甲醇水力空化烷基化反应生成甲苯、二甲苯、乙苯、二甲基环己烷、乙基环己烷、苯酚和水。依据反应产物推测其反应历程为:首先苯与甲醇解离产生·C6H5、·H、·CH3和·OH;继而·C6H5与·CH3或·OH发生自由基反应生成甲苯或苯酚,·H和·OH生成水;之后甲苯与·CH3反应生成二甲苯、乙苯和·H;二甲苯和乙苯与·H发生加氢反应,生成二甲基环己烷和乙基环己烷。
苯-甲醇水力空化烷基化反应最为适宜的条件为:入口压力0.4 MPa,反应终温40 ℃,混合液的苯摩尔分数20%,反应时间40 min。此时,苯和甲醇的转化率分别为25.96%和9.89%,甲苯和二甲苯的选择性分别为38.35%和37.86%。动力学研究表明该反应为1级反应,其反应表观活化能仅为54.21 kJ/mol。
