干扰素和Toll样受体在重症肌无力发生发展中的研究进展
2021-01-27黄学洙
李 萌 黄学洙 金 丹
(延边大学附属医院,延吉 133002)
1 重症肌无力概述
重症肌无力(myasthenia gravis,MG)是一种抗体靶向外周神经系统突触后膜乙酰胆碱受体(acetylcholine receptor,AChR)的自身免疫性疾病[1]。临床表现包括部分或全身骨骼肌无力,活动后症状加重,休息后缓解[2]。MG一般涉及眼球和近端肢体肌肉,严重时可影响呼吸肌。该疾病以急性或亚急性起病,常反复发作[3]。女性患病率是男性的1.5倍,各年龄段均有发病,以1~5岁儿童居多。具体来说,MG病人全身骨骼肌均可受累,可表现以下症状:①眼皮下垂、视力模糊、复视、眼球转动不灵活等眼部症状;②表情淡漠、苦笑面容等表情障碍;③咀嚼无力、饮水呛咳等吞饮困难;④颈软、抬头困难,转颈、耸肩无力等肌肉无力表现;⑤抬臂、梳头、上楼梯、下蹲困难等运动障碍[4]。一般来说,MG患者总体预后较好,小部分患者经治疗后可完全缓解,大部分患者可药物维持改善症状,绝大多数疗效良好的患者能进行正常的学习、工作和生活。然而,部分患者病情反复、症状持续,且对药物不敏感,需要长期随访和支持治疗[4,5]。
目前,根据MG发病机制和临床特点,2016年李海峰研究组[5-8]在Lancet Neurology提出新建议,将MG分为4个亚型:①儿童MG,可按发病时间分为青春期前/后型;②伴胸腺瘤的成人MG;③不伴胸腺瘤AChR抗体阳性的成人MG,可按照发病时间分为早发型重症肌无力(EOMG)和晚发型重症肌无力(LOMG),亦可按照发病部位分为眼肌型和全身型;④不伴胸腺瘤AChR抗体阴性的成人MG,其具体病理类型可按照血清学特异性抗体进一步细化,具体分类如图1所示。
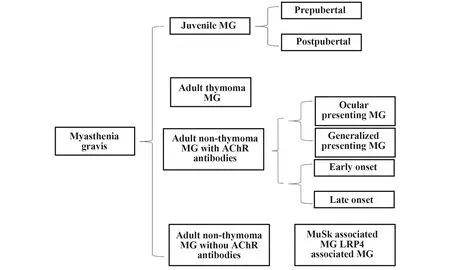
图1 MG亚组分类[7,8]Fig.1 Classification of MG[7,8]
2 MG免疫特点
MG的免疫学异常主要为血清中特异性抗体滴度升高,包括抗AChR抗体、抗肌肉特异性酪氨酸激酶受体(muscle-specific kinase,MuSK)抗体,抗低密度脂蛋白受体相关蛋白4(low density lipoprotein receptor related protein 4,LRP4)抗体等[9]。过去,MG研究重点主要在特异性免疫中,研究发现,T淋巴细胞和B淋巴细胞的协作异常,辅助性T细胞(helper T cells,Th)1、Th2、Th17细胞和调节性T细胞(regulatory cells,Tregs)失衡,免疫系统耐受异常,细胞因子和抗体的分泌异常,以及补体系统的激活等都参与了MG的发生发展[10]。总的来说,特异性免疫紊乱导致神经肌肉接头信号传导异常是MG发病的主要原因,然而,固有免疫在MG发生中的作用尚不明确[11]。研究发现,胸腺慢性炎症,Toll样受体激活,持续的病毒感染等固有免疫因素或可导致MG的发生。
3 固有免疫和MG
固有免疫系统是机体抗击感染的第一道防线,特点包括:①非特异性;②瞬间激发且无免疫记忆;③主要是由自然杀伤细胞(natural killer cells,NK cells)、巨噬细胞、中性粒细胞和树突状细胞等表达模式识别受体(patter recognition receptors,PRR)细胞所介导[12,13]。虽然特异性免疫紊乱是导致MG的主要原因,但是固有免疫系统激活是启动特异性免疫的先决条件,亦参与了MG病程。研究发现,对于LOMG患者,胸腺中固有免疫系统的激活可导致MG的发生。在过度增殖的胸腺上皮和髓质细胞中,干扰素(interferon,IFN)分泌过多和Toll样受体(Toll-like receptor,TLR)的激活可上调α-AChR表达[11]。同时,异常的固有免疫应答会导致胸腺炎症,使得对AChR敏感性增加并导致特异性免疫的激活[14]。以下,将详细阐述IFN和TLR在MG中的作用。
3.1IFN在MG发病中的作用 IFN是一类分泌性细胞因子,具有广谱抗病毒、抗肿瘤和免疫调节功能。在MG发病过程中,大量非特异性炎性细胞因子促进胸腺细胞对AChR敏感性增高,从而增强患者血清中特异性抗体的表达[15,16]。研究发现IFN-Ⅰ水平在LOMG患者血清中明显上调,说明IFN-Ⅰ或许参与了MG的发病过程。不仅如此,利用高通量转录组测序,研究发现IFN-Ⅰ通路相关基因在MG胸腺组织中明显高表达[17]。同时,IFN-Ⅰ还可通过调控α-AChR表达来调控胸腺上皮细胞(thymus epithelial cell,TEC)的免疫耐受[18]。目前,IFN-Ⅰ研究尚处于起步阶段,其功能和作用方式有待进一步挖掘。
不仅如此,IFN-β也在MG患者血清中显著高表达,并在MG发病过程中亦起着重要作用[19,20]。IFN-β的主要作用靶点也是胸腺上皮细胞。同时,IFN-β还可促进胸腺免疫的异常激活以及增加机体对AChR的敏感性[21,22]。目前认为,IFN-β促进MG发病主要由胸腺局部免疫微环境失衡以及IFN-β介导的趋化因子表达异常所致[20]。首先,IFN-β可促进TEC异常表达AChR,并增强树突状细胞(dendritic cell,DC)的吞噬功能[23,24]。不仅如此,IFN-β处理后的TEC的细胞坏死和凋亡比例增加,加重了胸腺部位的局部炎症[20]。更重要的是,IFN-β可激活TEC分别分泌BAFF和CXCL13,使得B淋巴细胞和DC细胞异常活化[25]。同时,IFN-β可作用于淋巴管内皮细胞,促进CCL21的分泌并激活单核细胞[26]。因此,IFN-β在MG的免疫调控中起着重要作用(图2)。
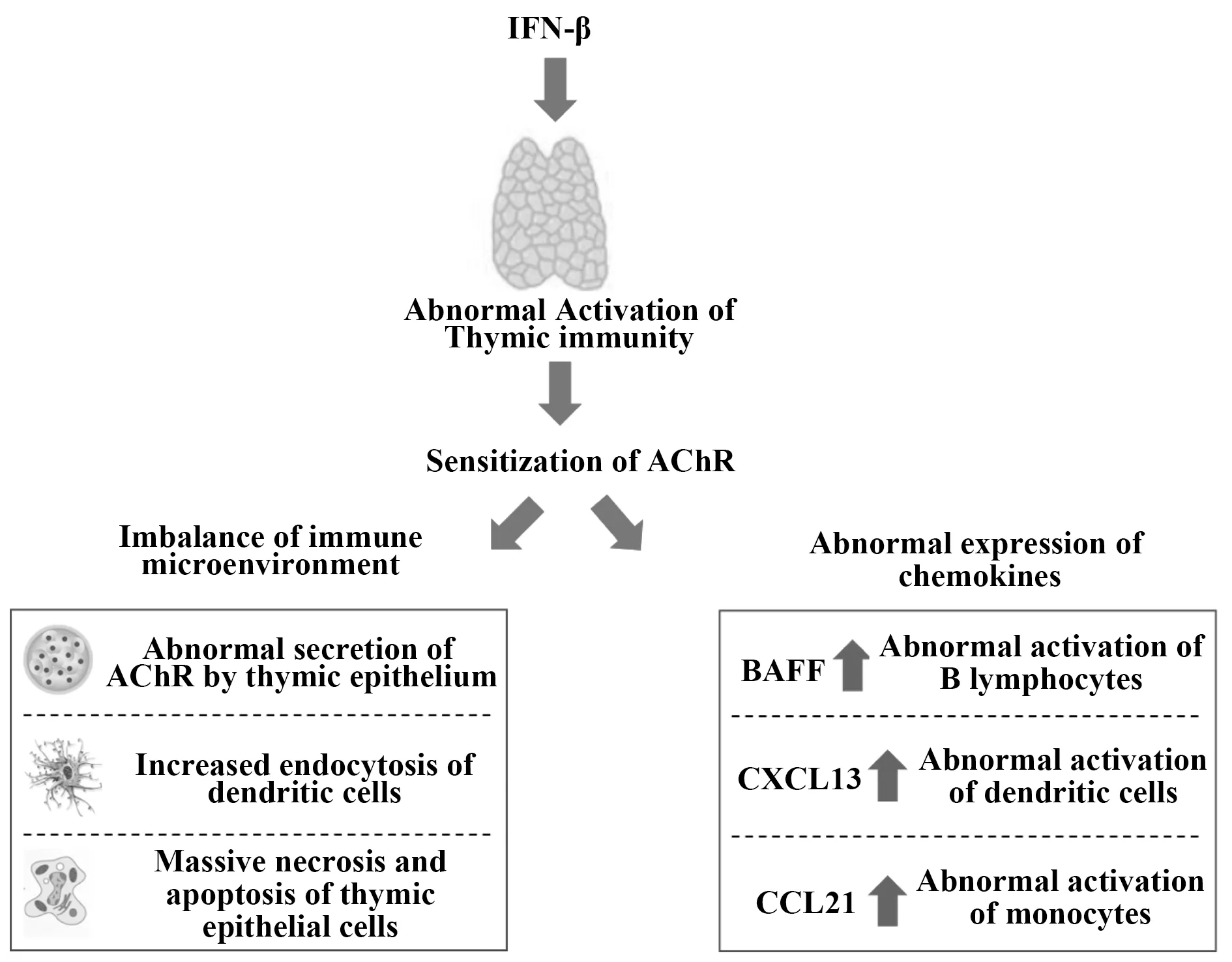
图2 IFN-β促进MG发生发展Fig.2 IFN-β contributes to pathogenesis of MG
IFN-γ也是干扰素家族的一员,IFN-γ可以通过促进免疫细胞表面的人类淋巴细胞抗原(human lymphocyte antigen,HLA)一类和二类分子的表达和调节Th1细胞分化来调节免疫过程[27,28]。研究发现,IFN-γ也参与了MG的发病过程,在IFN-γ敲除鼠中,研究者发现IFN-γ的缺失导致了胸腺中α-AChR明显下调[14],MG的指标得到显著缓解。同时,过度表达IFN-γ促进T细胞增殖分化,从而加速了MG的发病过程[29]。不仅如此,IFN-γ还可通过诱导细胞因子风暴,加重胸腺细胞尤其是上皮细胞的坏死和凋亡,促进MG由轻症向重症转变[21]。因此,IFN-γ成为治疗MG的理想靶点,其作用和有效性有待后续临床实践进一步证实。
3.2TLR在MG发生发展中的作用 TLR广泛表达于固有免疫细胞(巨噬细胞、DC细胞等),通过识别病原体相关分子模式(pathogen-associated molecular patterns,PAMP)或损伤相关分子模式(damaged-associated molecular patterns,DAMP),从而启动细胞内免疫信号转导[30]。研究表明,TLR分子家族在MG患者的胸腺中的表达有差异,TLR1、TLR2、TLR3、TLR7、TLR8、TLR9在胸腺中显著高表达[31,32],同时,研究显示TLR9表达直接与临床严重程度相关。TLR分子家族在MG胸腺组织中表达情况如表1所示。

表1 TLR分子家族在MG的表达情况[31,32]Tab.1 Expression of TLRs in MG[31,32]
值得一提的是,几乎所有TLR(除TLR3外)均与髓系分化初级响应基因88(Myeloid differentiation primary response gene 88,MyD88)相互作用并激活下游信号通路[33]。TLR3和TLR4通过TIR结构域诱导产生的IFN-β的过量表达(TIR domain-containing adapter-inducing interferon-β,TRIF),从而激活NF-kB、p38、JNK等信号通路,进一步激活炎性细胞因子表达,促进MG病程发展[34]。不仅如此,TLR3、TLR4、TLR7、TLR8和TLR9激活可促进Th1型免疫应答,而TLR2和TLR5发出免疫信号则更有利于Th2型免疫应答。Th1细胞一般参与体液免疫,而Th2细胞一般参与细胞免疫。MG患者产生Th1细胞因子如IFN-γ的CD4+T细胞比例高于健康对照组,而产生Th2细胞因子如IL-4和IL-13的CD4+T细胞低于健康对照组[35]。同时,研究发现TLR的异常表达还可影响Tregs和Th17细胞的发育[36]。Treg正常状态下抑制性T细胞作为T细胞一个亚群,在建立免疫耐受中起着重要作用。同时,病情稳定的MG患者中Treg细胞较正常对照者明显增高,而病情不稳定患者较正常对照组稍有下降。同时全身型MG患者评分与Th17和IL-17两者间存在明显相关,并伴有TLR的异常激活[12,13]。此外, TLR的活化(主要由TLR3、TLR7和TLR9介导)为B细胞的增殖、成熟和存活提供额外的共刺激信号,从而降低B细胞的耐受性,异常产生AChR抗体,加重MG发病过程[33,36]。因此,靶向纠正异常表达的TLR或为治疗MG的新策略。
4 结论
MG是一种自身抗体介导的神经系统疾病,涉及遗传、环境、免疫等因素。不同的MG患者,常由于自身抗体特征、疾病严重程度、发病年龄和胸腺受累情况差异,在病因上和临床表现上有很大的差别,治疗策略也不一样。一般认为,MG主要是由于特异性免疫产生的多种自身抗体(抗AChR-Ab、抗MuSK-Ab、抗LRP4-Ab等)导致的。然而,固有免疫作为特异性免疫的上游事件,受到的关注较少。近来已有研究发现固有免疫细胞的TLR激活、细胞因子IFN的高表达与MG高度相关,同时EB病毒感染和脊髓灰质炎病毒也可参与MG的发生发展。是否会有更多的固有免疫紊乱参与MG的发病过程?是否可以通过调节固有免疫开发出新型MG治疗药物?这些都是MG基础研究和诊治中亟待解决的问题。
