副猪嗜血杆菌4型分离株耐药表型及耐药基因分析研究
2021-01-27王治方徐引弟张青娴朱文豪焦文强李海利白红杰王克领
王治方,徐引弟,张青娴,朱文豪,焦文强,李海利,白红杰,许 峰,王克领
(1.河南省农业科学院畜牧兽医研究所,河南 郑州 450002;2.河南省畜禽繁育与营养调控重点实验室,郑州 450002;3.河南省农业科学院,郑州 450002)
副猪嗜血杆菌病是当前规模化猪场常见的细菌病之一,由副猪嗜血杆菌(Haemophilus parasuis, HPS)引起的,各种年龄阶段的猪均可感染,主要发生在断奶后和保育阶段,主要感染2周龄到4月龄的猪,发病率一般在10%~15%,严重时死亡率可达50%[1-3],该病已成为近年来断奶仔猪、保育猪死亡的主要原因之一,是临床混合感染的主要细菌性病原。该病临床症状主要表现为咳嗽、呼吸困难、消瘦、跛行和被毛粗乱;病理变化以纤维素性胸膜炎、心包炎、腹膜炎、关节炎和脑膜炎等为主要特征[4]。副猪嗜血杆菌血清型较多,目前共鉴定了15种血清型,临床上还有15%~20%的不可分型菌株[5-6],该病原呈世界性分布,各地流行菌株血清型不一,世界范围内包括日本、德国、加拿大、美国、西班牙、丹麦、中国,流行的主要血清型为4、5和13型[7-8]。
目前抗生素仍然是临床上预防和治疗副猪嗜血杆菌病的常用方法。抗生素的不规范使用及长期滥用,使得副猪嗜血杆菌对各类抗生素的耐药性逐渐增强,甚至出现多重耐药,给临床治疗带来了困难[9-10]。副猪嗜血杆菌病已成为影响全球养猪业的典型细菌性疾病,该病的发生已严重影响了全球养猪业的健康发展,造成了较大的经济损失。
研究表明从不同国家或地区分离获得的副猪嗜血杆菌菌株,对抗生素耐药性表现不同。由于细菌受到抗生素强大的选择,逐渐产生了不同的耐药机制。研究表明,同一种抗生素可能存在多种耐药机制,一种耐药机制也可能在不同种抗生素中发挥作用[11]。副猪嗜血杆菌的耐药机制产生的因素较多,主要包括遗传因素、化学因素及环境因素等。因此了解副猪嗜血杆菌的耐药性及耐药机制,从根源减少耐药菌株的产生具有重要意义。
本试验对10株2019年分离获得副猪嗜血杆菌4型菌株,通过纸片扩散法和PCR技术检测了菌株的耐药性及相关耐药基因,以期为副猪嗜血杆菌4型的预防和临床治疗提供参考,减少或延缓耐药菌株的出现。
1 材料与方法
1.1 菌株
本试验的副猪嗜血杆菌菌株,是2019年1—12月由河南省农业科学院畜牧兽医研究所传染病研究室从河南省多个地区规模化猪场采集疑似副猪嗜血杆菌病例的发病猪只肺脏、气管、心血样品,分离纯化、生化鉴定、PCR鉴定及分型,获得4型副猪嗜血杆菌10株。菌株信息见表1。
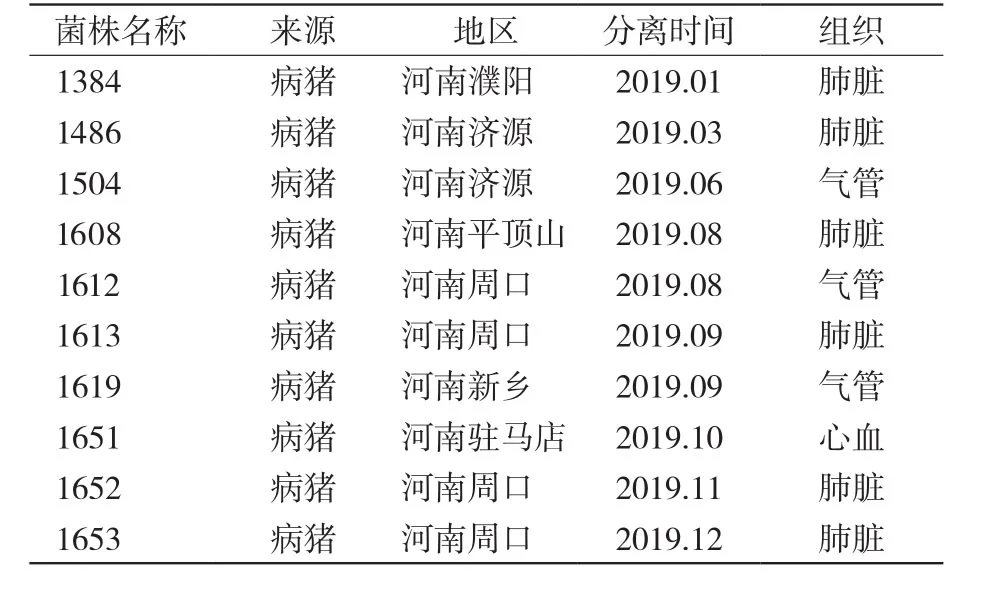
表1 菌株来源
1.2 主要仪器与试剂
Thermo 5020 PCR扩增仪、Thermo 1300SERIES A2生物安全柜购自赛默飞世尔科技(中国)有限公司;电泳仪(DYY-6型)购自北京市六一仪器厂;凝胶成像系统购自沙船(天津)生物科技发展有限公司;TK-15台式高速冷冻离心机购自SIGMA公司。胰蛋白胨大豆琼脂(TSA)购自美国Difco公司;新生犊牛血清购自生工生物工程(上海)股份有限公司;烟酰胺腺嘌呤二核苷酸(辅酶Ⅰ,NAD)购自Roche公司;微生物DNA提取试剂盒、Tap PCR master mix、DL 2 000 DNA Marker等PCR试剂均购自北京擎科新业生物科技有限公司。常用抗生素标准药敏片[头孢他啶(CAZ)、阿莫西林(AML)、青霉素(P)、卡那霉素(KAN)、新霉素(NEO)、阿米卡星(AMK)、壮观霉素(SPT)、红霉素(E)、替米考星(TIL)、阿奇霉素(AZM)、四环素(TE)、强力霉素(DO)、诺氟沙星(NOR)、左氟沙星(LEV)、氧氟沙星(OFL)],购自杭州滨河微生物试剂有限公司;头孢噻呋(EFT)、土霉素(OT)、氟苯尼考(FFC)药敏片购自Sigma公司。
1.3 培养基的配制
TSA琼脂平板:称取TSA琼脂粉4 g,溶于100 mL超纯水中,于121 ℃高压灭菌15 min,冷却至约45 ℃左右,添加新生犊牛血清5 mL和1 mL的0.01%NAD,充分混匀后倾倒平皿,4 ℃保存备用。
1.4 菌株培养
将10株冻存的副猪嗜血杆菌4型菌株分别接种TSA平板,于37 ℃ 5% CO2培养箱培养24~36 h后,再分别挑选单个典型菌落传代接种于TSA平板,37 ℃5% CO2培养箱培养24~36 h,备用。
1.5 药物敏感性试验
参考文献[12-13]采用琼脂扩散法(K-B法)分别对HPS4每个菌株进行药敏试验。挑取复壮纯化过的TSA平板上若干单个菌落,置于0.9%灭菌生理盐水中,制成菌悬液,浓度为0.5麦氏单位(比色仪比色),用灭菌的棉拭子或棉签蘸取制成细菌悬液,均匀涂布于TSA平板上,稍干后,用灭菌镊子分别取药敏纸片均匀贴于TSA平板上,并用镊子轻按纸片中心,使药敏纸片与平板培养基附着紧密,放置于5% CO2培养箱37 ℃培养36 h。取出观察并记录药敏片抑菌圈直径。判断标准参照药敏纸片说明书。
1.6 耐药基因检测
1.6.1 引物设计 参考文献[14],设计10个耐药基因包括氨基糖苷类[aadA1、aadA2、strA、strB、aadB、aacC2、aac(3)-IV、aphA1]和喹诺酮类(gyrA、parC)的引物,用于每个菌株的耐药基因检测扩增,10对耐药基因引物序列及相关信息见表2。

表2 耐药基因引物序列及相关信息
1.6.2 模板DNA的提取 用接种环挑取传代复苏好的HPS4典型菌落放入装有50 μL纯水的EP管中,按照DNA提取试剂盒上的步骤严格操作,DNA于-80 ℃保存备用。
1.6.3 反应体系 反应体系为25 μL:2×Taq Mix 13 μL,10 μM/L上、下游引物各1 μL,模板DNA 2 μL,加ddH2O至25 μL。反应条件:95 ℃预变性5 min;95 ℃变性1 min,适宜温度下(表2)退火1 min,72 ℃延伸30 s,共35个循环;最后72 ℃延伸10 min,PCR产物4 ℃保存备用。取10 μL PCR扩增产物于1.0%琼脂糖凝胶电泳检测,凝胶成像系统中比照DNA Marker DL 2 000确定条带大小。
2 结果
2.1 药物敏感性检测结果
10株HPS4菌株的药物敏感性检测结果如表3所示,试验菌株对氨基糖苷类(卡那霉素、阿米卡星)、喹诺酮类(诺氟沙星、左氟沙星、氧氟沙星)耐药均在60%以上;对大环内酯类、四环素类、氟苯尼考敏感;对β-内酰胺类药物较敏感,但对β-内酰胺类的阿莫西林、青霉素G的耐药性不容乐观,分别是30%、40%。
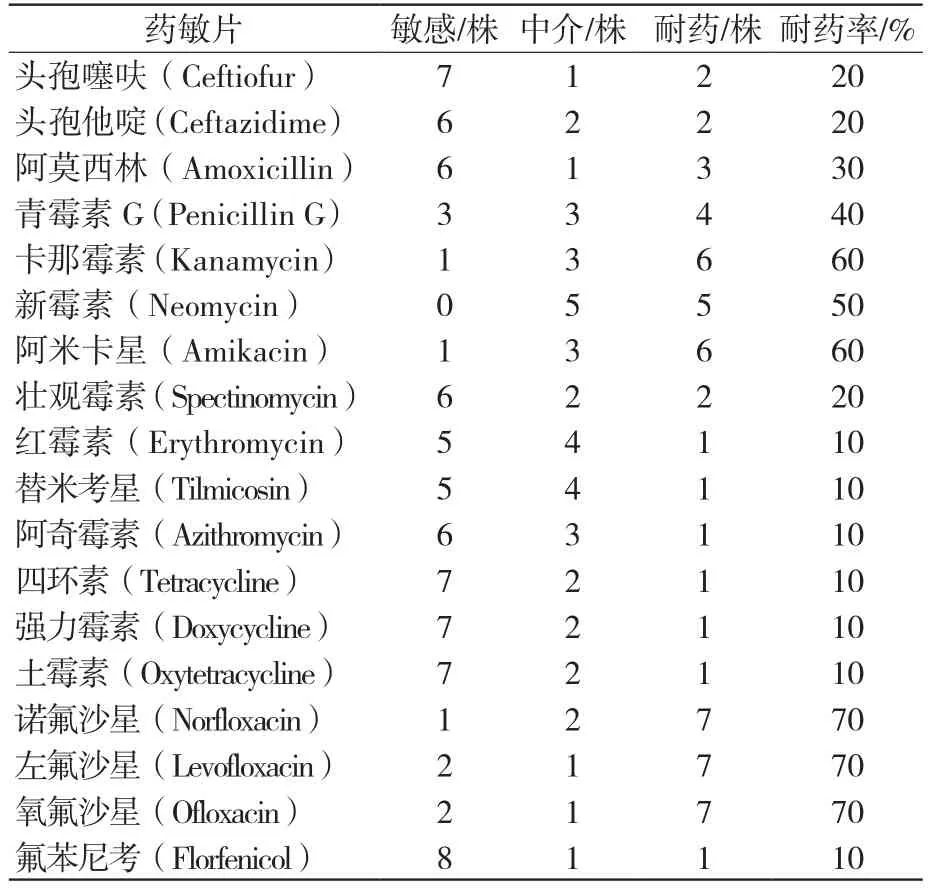
表3 10 株 HPS4 型菌株药敏统计
2.2 菌株耐药谱
10株HPS4菌株对18种常用抗生素药物敏感性结果显示,10菌株均表现出多重耐药现象,共表现出9种耐药谱,其中有2株耐受3种药物(诺氟沙星、左氟沙星、氧氟沙星),为3重耐药;1株表现出8重耐药,同时对头孢他啶、头孢噻呋、阿莫西林、青霉素、卡那霉素、阿米卡星、新霉素和壮观霉素表现耐药。结果如表4所示。

表4 HPS4 菌株耐药谱
2.3 耐药基因检测结果
用10对耐药基因引物分别对10株HPS4进行耐药基因检测,其中有1株未检测到耐药基因,其余9个菌株检测出了4种耐药基因,分别是strB、aphA1、gyrA、parC耐药基因,其中有8个菌株都检测出喹诺酮类耐药基因gyrA、parC阳性,检出率达80%(图1、图2);有6个菌株检测出氨基糖苷类耐药基因aphA1阳性,检出率60%(图3),有5个菌株检测出氨基糖苷类耐药基因strB阳性,检出率50%(图4)。
3 讨论
本试验针对10株副猪嗜血杆菌4型河南临床分离菌株进行了表型耐药检测及耐药基因检测研究,发现10株HPS4菌株对18种临床常用抗菌药物均表现出不同程度的耐药现象。总体情况,HPS4菌株对红霉素、阿奇霉素、替米考星、四环素、土霉素、强力霉素和氟苯尼考有很好敏感性,耐药率均为10%;和忽占利等报道的浙江菌株对四环素耐药率高达75%有明显差异[15],这可能是菌株区域性差异引起的。虽然本试验HPS4菌株对β-内酰胺类药物(头孢噻呋、头孢他啶)和壮观霉素较敏感,耐药率为20%,但和作者2018年检测30株副猪嗜血杆菌株对头孢噻呋100%敏感结果[16]有所不同,说明副猪嗜血杆菌临床菌株耐药性在逐渐增强。HPS4菌株对青霉素G和阿莫西林耐药性不容乐观,耐药率分别为40%、30%。HPS4菌株对氨基糖苷类卡那霉素、阿米卡星、新霉素和喹诺酮类诺氟沙星、左氟沙星、氧氟沙星表现出较高耐药性,耐药率均在50%以上;与董永军等[17]、蒋增海等[6]试验分离株对诺氟沙星、氧氟沙星等喹诺酮类高敏有明显差异。试验菌株对18种常用抗生素均表现出多重耐药现象,耐药谱多达9种,最少为3重耐药,最多为8重耐药。充分说明,不同地区、猪场分离获得的HPS4菌株耐药性有一定差异,耐药现象较普遍,而且有增强扩大的趋势。本试验HPS4菌株的耐药表型为建立副猪嗜血杆菌河南分离株耐药谱积累了一定的数据材料,为河南省规模化猪场预防控制副猪嗜血杆菌病临床选择药物提供了科学依据。
细菌的耐药机制复杂,不同细菌及同一细菌对不同类药物均能表现出不同的耐药机制。细菌对氨基糖苷类药物耐药的机制主要有:1)产生一种或多种功能修饰酶,使药物降低或失去活性,氨基糖苷类修饰酶有乙酰转移酶、磷酸转移酶和核苷转移酶3类;2)药物作用靶位的核糖体碱基发生改变或与核糖体结合的核蛋白编码基因发生突变,药物的结合位点发生改变,无法发挥抗菌作用;3)改变细胞膜的通透性,主动外排机制增强。第一种是氨基糖苷类药物耐药的普遍机制,细菌能够产生50多种分别编码乙酰转移酶,腺苷转移酶和磷酸转移酶的基因[18-19]。耐药基因aphA1和strB都是与编码磷酸转移酶有关的基因,本次试验对10株HPS4菌株进行耐药基因检测,6株检测出aphA1基因,5株检测出strB基因,说明aphA1和strB是HPS4河南分离菌株对氨基糖苷类药物产生耐药性的主要原因。
喹诺酮类药物主要通过与细菌不同部位上的靶位蛋白结合,发挥杀菌、抑菌作用的,DNA回旋酶和拓扑异构酶Ⅳ是喹诺酮类药物的主要作用靶位[20]。耐药基因gyrA、parC则分别与DNA回旋酶和拓扑异构酶Ⅳ的基因编码有关。本次试验10株HPS4菌株进行耐药基因检测,8株都检测出gyrA、parC基因,表明gyrA、parC是HPS4河南分离菌株对喹诺酮类药物产生耐药性的主要原因。
结合本次研究的耐药表型结果和耐药基因检测结果,表明HPS4河南分离菌株对临床常用药物耐药表现明显;耐药菌株表型耐药和其携带的耐药基因表现出很大的相关性,临床菌株之间很可能存在耐药性的遗传传递情况,在临床防控副猪嗜血杆菌时,尽可能规范或减少氨基糖苷类和喹诺酮类药物的使用。
