不同灭活温度对新型冠状病毒核酸检测的影响
2021-01-27陈小凤熊金萍蒋佳辰夏凤霞何九宏
严 谨,陈小凤,熊金萍,蒋佳辰,夏凤霞,何九宏
重庆市渝北区疾病预防控制中心微生物科,重庆 401120
在开展新型冠状病毒(SARS-CoV-2)核酸检测的工作中,生物检材有极强的传染性,给实验室操作人员带来较大的生物安全隐患和心理压力。冠状病毒不耐高温,严重急性呼吸综合征(SARS)病毒在56 ℃、30 min,70 ℃、15 min时已经失活[1],这提示可以采取高温方式灭活SARS-CoV-2来保护实验操作人员的生物安全。SARS-CoV-2和SARS病毒同属β属冠状病毒,理化性质具有参考性,但温度过高可能会对核酸完整性产生破坏,降低PCR检测效果,另外,考虑到温度传导速度,本研究选择56 ℃、35 min和65 ℃、15 min两组试验条件。已有研究显示,使用56 ℃、30 min处理咽拭子标本灭活病毒对后续SARS-CoV-2核酸检测无明显影响[2],但由于标本量少且循环阈值(Ct值)较低,无法对Ct值较高的标本是否具有相同的一致性进行评价。因此本研究将探讨不同Ct值标本,特别是Ct值较高的标本在不同灭活温度处理后对检测SARS-CoV-2核酸的结果是否存在影响。
1 资料与方法
1.1一般资料 收集本中心2020年1月25日至2月25日采集的SARS-CoV-2核酸检测阳性标本14份。
1.2试剂与仪器 达安基因SARS-CoV-2核酸检测试剂盒(PCR-荧光探针法,批号:2020018),达安基因核酸提取和纯化试剂(DA0633),达安Stream全自动核酸提取仪,Applied BiosystemsTMQuantStudioTM7 Flex实时定量PCR仪,Eppendorf ThermoMixerTMC振荡器。
1.3方法 实验人员按照《新型冠状病毒肺炎诊疗方案(试行第六版)》[3]进行实验操作和生物安全防护。(1)各标本取病毒采样液210 μL分装到3个EP管中,做好标记,由于恒温金属浴温度波动系数更小[4],标本间不易污染,分别用Eppendorf ThermoMixerTMC振荡器56 ℃、35 min,65 ℃、15 min灭活处理。(2)核酸提取和体系配制使用达安Stream全自动核酸提取仪以及配套提取试剂(DA0633)。(3)核酸扩增使用Applied BiosystemsTMQuantStudioTM7 Flex 实时定量 PCR 仪,每批结果设阴阳性对照,在阴阳性对照结果正常的情况下,结果有效。每个测试设置3次复孔,取平均Ct值进行计算。
1.4统计学处理 采用GraphPad Prism 8软件进行统计学分析,对SARS-CoV-2的开放读码框1ab(ORF1ab)和核衣壳蛋白(N)基因在未灭活组和灭活组中的Ct值通过Anderson-Darling、D′Agostino-Pearson、omnibus、Shapiro-Wilk、Kolmogorou-Smirnou进行正态性检验,P>0.05符合正态分布。对不同温度灭活的Ct值差异采用非参数检验的Mann-WhitneyU检验进行分析。以P<0.05为差异有统计学意义。
2 结 果
2.1未灭活处理及不同温度灭活处理后标本的荧光定量PCR检测结果 对标本进行荧光定量PCR检测,并对检测结果进行统计分析,见表1。对未灭活组和不同温度灭活组的结果进行非参数检验Mann-WhitneyU分析,结果显示,56 ℃、35 min灭活处理组的ORF1ab和N基因Ct值与未灭活组Ct值差异无统计学意义(U=95.50、95.00,P>0.05),65 ℃、15 min灭活处理组的ORF1ab和N基因Ct值与未灭活组Ct值的差异无统计学意义(U=94.00、94.50,P>0.05),56 ℃、35 min和65 ℃、15 min灭活处理组的ORF1ab和N基因Ct值的差异无统计学意义(U=96.00,P>0.05)。
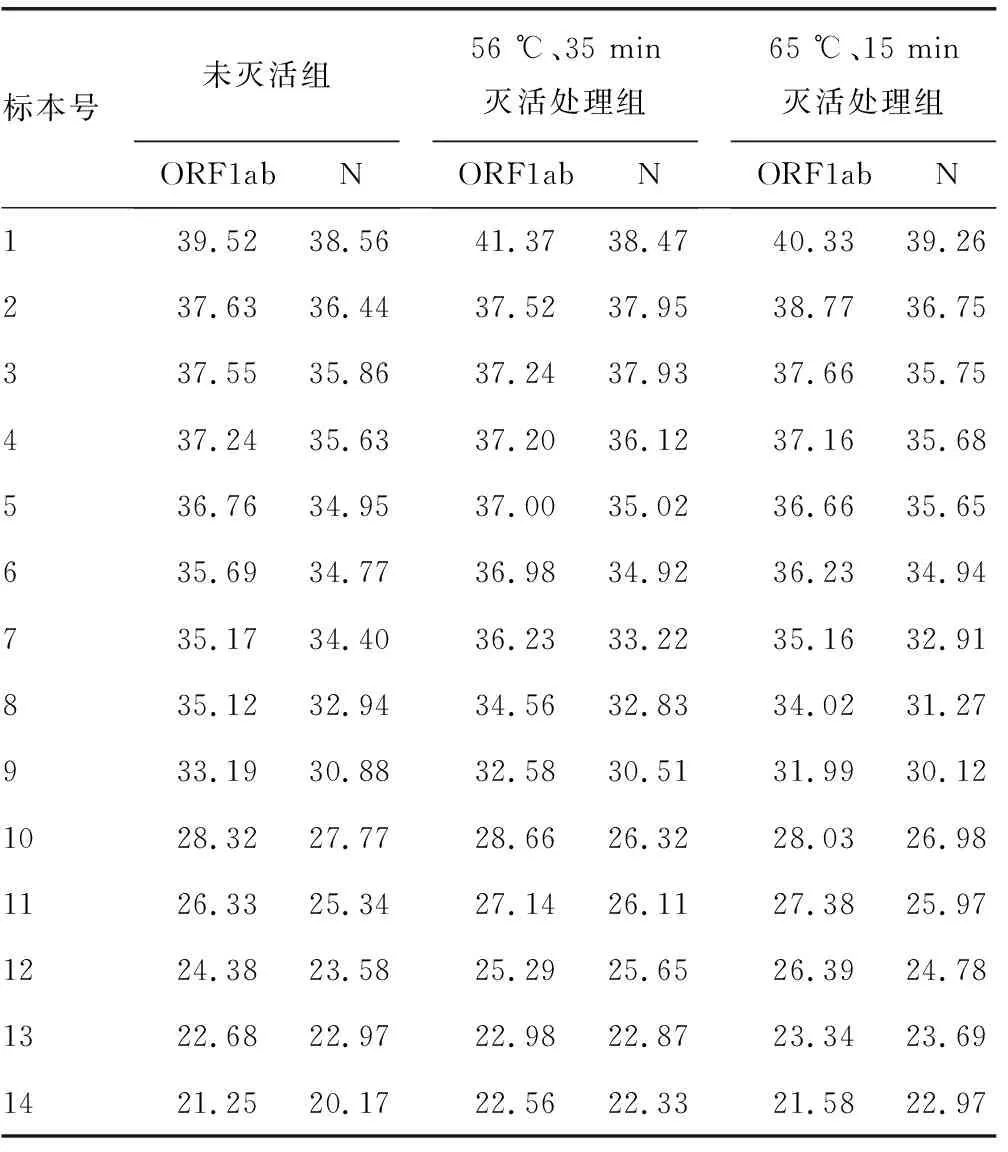
表1 不同灭活温度处理对ORF1ab和N基因Ct值的影响
2.2不同Ct值标本在不同灭活温度处理下对SARS-CoV-2核酸检测结果的影响 本研究选择了Ct值≥34和Ct值<34的标本在未灭活和不同灭活温度处理下的荧光定量PCR结果进行非参数检验Mann-WhitneyU分析。对于Ct值≥34的标本,结果显示,56 ℃、35 min灭活处理组的ORF1ab和N基因Ct值与未灭活组Ct值的差异无统计学意义(U=31.50、31.00,P>0.05),65 ℃、15 min灭活处理组的ORF1ab和N基因Ct值与未灭活组Ct值的差异无统计学意义(U=14.00、15.00,P>0.05),56 ℃、35 min和65 ℃、15 min灭活处理组的ORF1ab和N基因Ct值差异无统计学意义(U=16.00,P>0.05)。
对于Ct值<34的标本在未灭活和不同灭活温度方式下进行荧光定量PCR分析,结果显示,56 ℃、35 min灭活处理组的ORF1ab和N基因Ct值与未灭活组Ct值差异无统计学意义(U=16.00、16.00,P>0.05),65 ℃、15 min灭活处理组的ORF1ab和N基因Ct值与未灭活组Ct值差异无统计学意义(U=24.00、23.00,P>0.05),56℃、35 min和65℃、15 min灭活处理组的ORF1ab和N基因Ct值的差异无统计学意义(U=32.00,P>0.05)。
3 讨 论
生物安全是开展病原微生物操作处理工作必须考虑的首要因素,在标本的采集以及核酸提取过程中要采取相应的防护措施或应在一定生物安全防护等级的实验室进行。据研究发现,SARS-CoV-2可能的传播方式是经飞沫传播、接触传播以及呼吸道气溶胶近距离传播[5],由于在相对密闭的环境中长时间暴露于高浓度气溶胶情况下存在气溶胶传播的可能,加大了实验室操作人员感染的风险。为减少病毒的生物危害,研究者对高压[6]、超声波[7]、伽马射线照射[8]、乙醇等方式处理标本进行探讨,但这些方法需要额外的设备或试剂,且可能降低核酸检测的敏感性,同时,各实验室条件不尽相同,不易推广。SARS-CoV-2是一种包膜脂质病毒,对温度敏感,高温处理标本简单易行,对降低实验室人员感染风险有重要意义,但由于高温可能会使标本RNA降解,影响检测结果准确性,目前,市面上SARS-CoV-2核酸检测试剂盒检出限大都在500~1 000 copy/mL,阳性判读Ct值在30~40[9],对于灰区标本,由于接近试剂盒本身检出限,样品处理不当可能会造成检测结果假阴性。本研究结果表明,56 ℃、35 min和65 ℃、15 min恒温金属浴灭活处理灰区标本对后续核酸检测结果并无明显影响,为后续SARS-CoV-2核酸检测提供了不同的策略。分析原因,核酸降解的因素众多,首先SARS-CoV-2是单链RNA病毒,不如双链DNA稳定;其次,细胞的内源性RNA酶和外源性RNA酶较多,且活性强,高温使RNA酶活性增强,不利于RNA病毒的提取和保存。然而,商品化核酸提取试剂的裂解液对RNA酶有充分的灭活作用[10],降低了高温对核酸降解的不利影响。虽然高温对病毒灭活效果较好,但研究表明不同蛋白溶液和稳定剂对灭活效果存在影响[11]。因此,实验室检测人员在处理标本的过程中仍然应按照生物安全三级防护要求做好个人防护。