重组人血管内皮抑制素联合化疗治疗晚期肺腺癌患者的疗效及安全性
2021-01-27袁亮,胡勇
袁 亮,胡 勇
陕西省汉中市中心医院:1.肿瘤内科;2.放疗科,陕西汉中 723000
2019年1月,国家癌症中心(NCC)发布了最新一期的全国癌症统计数据,显示恶性肿瘤发病率随年龄增加而上升,40岁以后快速升高,发病人数主要集中在60岁以上,其中肺癌位居我国恶性肿瘤首位,约占全球1/3,肺癌病死率在所有恶性肿瘤中最高,高达26%[1]。目前根据肺癌组织病理类型可分为两大类,分别是小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC),其中NSCLC占比达85%,NSCLC又可分为腺癌、鳞癌、腺鳞癌、大细胞癌、类癌等,其中腺癌和鳞癌约占NSCLC的70%[2]。由于大多数肺癌患者初期症状不明显,检查不及时,导致绝大部分患者在明确诊断时已属于晚期,错失早期手术治疗机会,故我国肺癌5年生存率较低,仅为15.6%,其中晚期肺癌的5年生存率仅为 1%~2%[3]。鉴于肺癌具有高发病率和病死率,因此,寻找合适、有效的抗肿瘤方案具有重要的意义。目前指南推荐驱动基因阴性[表皮生长因子受体(EGFR)、间变性淋巴瘤激酶(ALK)及ROS1未突变]的晚期NSCLC患者一线使用化疗或者化疗+抗血管生成药物治疗[4]。重组人血管内皮抑制素是我国自主研发的治疗晚期NSCLC的一线用药[5-6]。本文通过对76例晚期肺腺癌患者采用重组人血管内皮抑制素联合化疗进行治疗,探讨其对肺腺癌的治疗效果,现报道如下。
1 资料与方法
1.1一般资料 选取本院肿瘤内科2017年1月至2019年1月收治的76例驱动基因阴性的晚期肺腺癌患者作为研究对象,随机分成两组。对照组36例,其中男23例,女13例;年龄45~80岁,平均(58.56±7.69)岁。试验组40例,其中男26例,女14例;年龄45~80岁,平均(59.90±8.04)岁;两组患者的一般资料差异无统计学意义(P>0.05),具有可比性。纳入标准:(1)符合肺腺癌的病理诊断标准;(2)驱动基因阴性,即EGFR、ALK及ROS1基因检测未突变患者;(3)临床分期为Ⅳ期的肺腺癌患者;(4)卡式功能状态评分(KPS评分)≥60分;(5)预计生存期≥3个月。排除标准:(1)合并其他部位肿瘤者;(2)不能耐受化疗或有化疗禁忌证。
1.2方法 对照组患者单纯采用化疗(培美曲塞+顺铂)进行治疗,用法为静脉滴注培美曲塞(江苏豪森药业集团有限公司,规格:每支0.2 g),500 mg/m2,第1天;静脉滴注顺铂,75 mg/m2,第1天。21 d为1个治疗周期。
试验组患者采用重组人血管内皮抑制素+化疗(培美曲塞+顺铂)进行治疗。静脉滴注重组人血管内皮抑制素(山东先声麦得津生物制药有限公司,规格:15 mg×3 mL):取7.5 mg加入500 mL生理盐水中,1次/天,使用2周暂停1周,即21 d为1个治疗周期。所有患者治疗2个周期后进行疗效评估,如病情进展者不再进行后续临床观察。试验组及对照组均给予4个周期的治疗。随后进行定期复查。
1.3评价标准 对比两组患者临床疗效和疾病无进展生存期(PFS)以及治疗前后血清肿瘤标志物水平。(1)临床疗效在治疗2个周期后进行评估,包括完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)。CR为靶病灶消失,未见新病灶产生,且持续时间大于或等于4周。PR为靶病灶减少大于或等于30%,且持续时间大于或等于4周。SD为靶病灶未见缩小,也未见增大。PD为靶病灶增加大于或等于20%或新病灶产生。观察客观缓解率(ORR)及疾病控制率(DCR),ORR=(CR例数+PR例数)/总例数×100%。DCR=(CR例数+PR例数+SD例数)/总例数×100%。(2)PFS:对所有有效患者随访12个月,记录患者PFS。(3)血清肿瘤标志物:检测两组患者治疗4个周期前后糖类抗原125(CA125)、细胞角蛋白19片段(CYFRA21-1)、癌胚抗原(CEA)水平的变化情况。
1.4不良反应 记录两组患者治疗过程中不良反应发生情况。按照通用不良事件术语4.0版(CTCAC v4.0)评价不良反应,分为0~Ⅳ级。
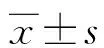
2 结 果
2.1两组疗效对比 试验组CR共2例(5.0%),PR共18例(45.0%),SD共15例(37.5%),PD共5例(12.5%),ORR为50.0%,DCR为87.5%。对照组无CR患者,PR共10例(27.8%),SD共14例(38.9%),PD共12例(33.3%),ORR为27.8%,DCR为66.7%。试验组ORR及DCR显著高于对照组,差异有统计学意义(χ2=3.916、4.736,P<0.05),见表1。

表1 试验组与对照组疗效对比[n(%)]
2.2两组PFS比较 两组患者随访12个月后,试验组PFS为(7.537±0.334)个月,对照组PFS为(5.535±0.373)个月,试验组PFS较对照组PFS明显延长,差异有统计学意义(t=14.187,P<0.05)。
2.3两组治疗前后肿瘤标物水平变化情况对比 治疗4个周期后,试验组血清中CEA、CYFRA21-1、CA125水平较对照组明显降低,差异均有统计学意义(P<0.05)。见表2。

表2 治疗前后患者血清CEA、CYFRA21-1、CA125水平比较[M(P25,P75)]
2.4两组不良反应发生情况对比 试验组与对照组不良反应发生率比较,差异无统计学意义(P>0.05),见表3。

表3 试验组与对照组不良反应发生情况对比
3 讨 论
近年来,靶向治疗的快速发展,使得驱动基因阳性的晚期肺腺癌的PFS显著延长、ORR明显提高,并且能改善患者的生活质量[7-9]。但对于驱动基因阴性的患者,目前主要以化疗为主。国外有研究对非鳞癌NSCLC患者采取培美曲塞+卡铂治疗,在总生存率方面要显著优于吉西他滨+卡铂,但对于鳞癌,后者的治疗效果要显著优于前者[10]。因此,对于驱动基因阴性肺腺癌患者,指南推荐首选培美曲塞+铂类进行化疗。近年来有研究者采用化疗和抗血管生成药物联合应用的治疗方案,如贝伐珠单抗联合培美曲塞+铂类,在肺腺癌中有很好的效果[11-12],因此,也被指南推荐将其用于肺腺癌的一线治疗。
重组人血管内皮抑制素是我国自主研发的抗肿瘤血管生成的分子靶向药物,作为一种血管生成的抑制剂,其主要是通过抑制血管内皮细胞的迁移,达到抑制肿瘤新生血管的生成,进而达到减少或者阻断肿瘤细胞的营养供给,以及抑制肿瘤增殖或转移的目的[13-14]。由于重组人血管内皮抑制素通过抑制新生血管生成而发挥抑制肿瘤生长的作用,故其很难使肿瘤迅速缩小,但与化疗具有协同作用[15]。
本研究结果显示,试验组ORR及DCR显著高于对照组,差异有统计学意义(P<0.05)。试验组PFS为(7.537±0.334)个月,对照组PFS为(5.535±0.373)个月,试验组显著延长了PFS,差异有统计学意义(P<0.05),原因主要为重组人血管内皮抑制素作为一种抗血管生成药物,可对肿瘤新生血管进行抑制,并使肿瘤血管正常化,促进肿瘤微环境改变,与化疗具有协同作用,与化疗联用,能够起到更好的抗肿瘤作用。
CEA、CYFRA21-1、CA125作为肺腺癌的肿瘤标志物,在临床抗肿瘤治疗过程中被作为病情评估的重要参考指标。在试验组及对照组中,血清学指标水平对比显示,治疗后试验组患者CEA、CYFRA21-1、CA125水平明显低于对照组,差异有统计学意义(P<0.05)。对不良反应统计结果显示,试验组发生了2例Ⅲ度血液系统损害,对照组中发生了1例Ⅲ度血液系统损害,考虑这与培美曲塞+顺铂化疗的骨髓毒性相关。同时,在试验组中,心律失常、高血压及出血发生率较对照组略升高,但差异无统计学意义(P>0.05),且无严重不良反应发生。总体而言,重组人血管内皮抑制素联合化疗方案的有效性和安全性均较好。
综上所述,驱动基因阴性的晚期肺腺癌患者在一线化疗基础上增加重组人血管内皮抑制素较单独化疗疗效更好,可提高ORR及DCR,明显延长PFS,降低肿瘤标志物水平,同时安全性良好,未见严重不良反应事件发生,值得临床推广。