兔VX2恶性骨肿瘤浸润范围的DWI与病理对照研究
2021-01-27吴增杰董诚边甜甜庞婧李晓丽郭佳孙伟凯郝大鹏陈海松徐文坚
吴增杰,董诚,边甜甜,庞婧,李晓丽,郭佳,孙伟凯,郝大鹏,陈海松,徐文坚
恶性骨肿瘤的首选治疗方式是肿瘤切除术,而术前精确判定肿瘤浸润范围对指导临床治疗具有重要意义。VX2细胞株来源于shope病毒诱发的兔乳头状瘤而衍生的鳞癌,接种到兔骨髓腔内可建立人体恶性骨肿瘤模型,其生物学行为与人类骨肿瘤相似,已被广泛认可[1,2]。目前,恶性骨肿瘤浸润范围主要通过MR常规序列信号进行判定,但常受肿瘤水肿影响[3]。扩散加权成像(diffusion weighted imaging,DWI)是一种无创性从分子水平上反映活体组织结构的功能成像技术。鉴于磁共振螺旋桨技术(periodically rotated overlapping parallel lines enhanced reconstruction,PROPELLER)-DWI序列具有克服磁敏感伪影的作用,本文从分子水平研究DWI在恶性骨肿瘤浸润范围判定中的价值,旨在为临床治疗提供更精确的依据。
材料与方法
1.实验动物及主要仪器
34只新西兰大白兔,月龄2个月左右,体重1.5~2.0 kg,雌雄不限,由青岛市实验动物和动物实验中心提供, 许可证号:SCXK(鲁) 20090007。 主要仪器为GE Signa 3.0T超导双梯度磁共振系统(GE Medical System, Milwakee,USA)和顺菱ES-250切片机(沈阳基石有限公司,中国)。
2.研究方法
VX2兔恶性骨肿瘤模型建立:经耳缘静脉注射地西泮和氯胺酮(用量分别为1 mL/kg和1.6 mL/kg)麻醉,距胫骨平台2 cm处将右侧小腿内侧皮肤纵行切开。采用牙科钻在骨皮质上钻孔,孔径约1 mm,24G留置针将肿瘤组织块(1 mm3/kg)送入胫骨骨髓腔,骨蜡封堵骨皮质缺口。逐层缝合切口,0.5%碘伏消毒后用无菌纱布包扎。模型兔建立成功的标准:模型兔制备约4周后,MRI示胫骨上段出现溶骨性骨质破坏并伴有周围软组织肿块。
2.MRI检查方法
将麻醉的模型兔横行放入头颈联合线圈内。扫描方位选择胫骨矢状位,矢状位定位线:在冠状位上与胫骨平台垂直,在横轴位上与股骨内侧髁内侧面平行。MRI扫描序列包括SE-T1WI(TR 500 ms,TE 10 ms,激励次数2)、脂肪抑制(fat saturation,FS)FSE-T2WI(TR 2000 ms,TE 100 ms,激励次数4)、短时反转恢复(short TI inversion recovery,STIR)序列(TR 1800 ms,TE 90 ms,激励次数2)和DWI(TR 4000 ms,TE 66~75 ms,激励次数1.5,b值取500 s/mm2)。所有扫描序列视野为18 cm×18 cm,层厚3 mm,层间距1 mm。
病理切片选取与标记:离断并取出肿瘤侧完整的小腿组织。用切片机按照MR矢状位定位线方向,切制层厚3 mm的大标本(图1),选取与MRI对应的显示肿瘤浸润范围最大层面的标本。参考文献方法[4],将肿瘤最大层面的大体标本切片分割成多个区,切割纵向线平行于胫骨前缘骨皮质,横向线与纵向线垂直,记录切割后的每个小标本区的纵向和横向长度,并用英文字母A、B、C、D等有序标记(图2)以便与MRI进行点对点对照研究。标本HE染色后,均行低倍镜(×40)和高倍镜(×100)观察。
3.观察项目与评价标准
不同组织区域的ADC值测量:测量ADC图中肿瘤实性区、肿瘤坏死区、肌肉水肿(包括近、远端)、正常肌肉、骨髓水肿的ADC值,并与病理点对点对照研究,镜下观察ADC值测量感兴趣区的病理表现。每个病变区域的ADC值均由3位放射科资深医生测量,取其平均值,感兴趣区大小为2 mm2。
肿瘤浸润范围大小的测量:选取MRI图像和病理标本中的肿瘤最大层面。参照相关文献[5]的方法分别测量FSE-T2WI、FS-T2WI、STIR、DWI-ADC图像中肿瘤的最大纵径(平行于胫骨前缘骨皮质)及最大横径(垂直于最大纵径),并将两径线数值相加,两者之和代表肿瘤浸润范围(图3、4)。ADC图测量大小标准:计算所有模型的肿瘤实性区平均ADC值的95%可信区间的上限值,并将该值定义为肿瘤ADC域值,小于该域值作为肿瘤实性区,以通过ADC域值来测量肿瘤大小。由3位资深放射科医生测量,取其平均值。在标本上确定肿瘤浸润最大纵径和横径,计算肿瘤浸润范围。

图1 大体标本及标本分割线。 图2 各个小标本的制作与标记。 图3 FSE FS-T2WI测量肿瘤大小的方法:纵径平行于胫骨前缘骨皮质,横径垂直于纵径,A-D点的位置根据肿瘤信号确定。 图4 b=500s/mm2与b=0的ADC融合图像测量肿瘤大小的方法:纵径平行于b=0图像的胫骨前缘骨皮质,横径垂直于纵径,A-D点的位置由肿瘤边缘区的ADC值确定。
DWI序列显示肿瘤浸润的敏感度与特异度:以肿瘤浸润最大横径线上的最远点为中心,于其内、外、上、下各选取一个2 mm×2 mm感兴趣区进行分析比较。以病理切片为金标准,比较不同感兴趣区中常规序列与DWI显示肿瘤的敏感度及特异度。
4.统计学分析
采用SPSS 17.0软件进行统计学分析。对肿瘤实性区、肿瘤坏死区、肌肉水肿(近端和远端)、正常肌肉、骨髓水肿的ADC值行单因素方差分析及多组两两比较。将FSE-T2WI、FS-T2WI、STIR、ADC图上测量的肿瘤大小与病理所测肿瘤大小行单因素方差分析及多组两两比较。通过与病理对照,判定不同MRI序列对肿瘤的显示能力,并计算各序列界定肿瘤的敏感度及特异度。相同感兴趣区内MRI序列诊断为肿瘤,病理结果也为肿瘤即为真阳性;MRI诊断为非肿瘤组织,病理结果为非肿瘤组织即为真阴性。以P<0.05为差异有统计学意义。
结 果
1.VX2兔恶性骨肿瘤模型
成功建立30只肿瘤模型,建模需约4周。所有模型兔均出现溶骨性骨质破坏、周围软组织肿块、骨膜异常(骨膜反应和骨膜水肿)、肌肉水肿(图5~7)。
2.不同病变区的ADC值比较
肿瘤实性区、肿瘤坏死、肌肉水肿近端、肌肉水肿远端、正常肌肉、骨髓水肿的平均ADC值差异有统计学意义(F值=1146.78,P值=0.000,表1)。肌肉水肿近端的ADC值低于远端肌肉水肿(图6、7)。采用LSD-t检验对不同区域的ADC值进行两两比较,结果显示除正常肌肉与骨髓水肿的ADC值差异无统计学意义(P=0.939)外,其他不同病变区域的ADC值两两比较差异均有统计学意义(P<0.05)。肿瘤ADC域值为1.18×10-3mm2/s。

表1 不同组织区域的平均ADC值比较 (×10-3mm2/s)
3.DWI和常规方法与病理对照
将MRI不同序列图像与病理标本所测肿瘤大小进行比较,差异无统计学意义(F值=0.612,P值=0.655);DWI-ADC图像所测肿瘤大小更接近于病理标本测量值(表2)。

表2 MRI不同序列图像及病理大标本测量的肿瘤大小 (cm)
4.DWI与常规序列对肿瘤显示的敏感度与特异度
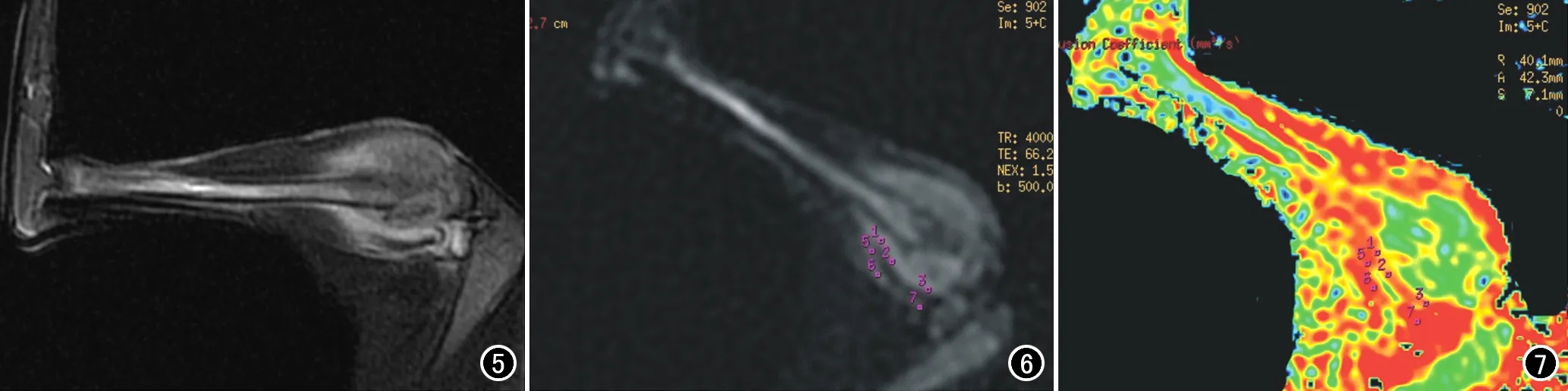
图5 兔VX2恶性肿瘤模型的FS-T2WI图像,胫骨近端骨质破坏,呈稍高信号,内部信号不均匀,边界略模糊,伴周围软组织肿块及肌肉水肿。 图6 兔VX2恶性肿瘤模型的DWI图像(b=500s/mm2), 肿瘤呈稍高信号,近远端肌肉水肿亦呈高信号。 图7 兔VX2恶性肿瘤模型的ADC图像,肿瘤周围肌肉水肿与肿瘤分界清晰,肿瘤实质区为低ADC值,近端肌肉的ADC值(2.12×10-3mm2/s)低于远端肌肉水肿(2.35×10-3mm2/s)。
DWI序列对肿瘤范围界定的敏感度及特异度最高,T2WI图像对肿瘤范围显示的敏感度及特异度最低,FS-T2WI及STIR序列居中(表3)。
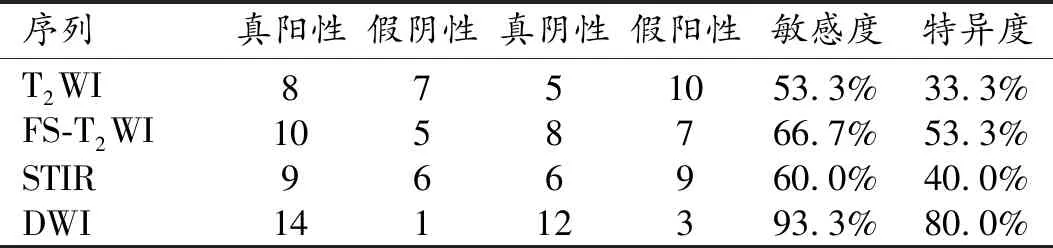
表3 MR常规序列及DWI显示肿瘤范围的敏感度与特异度 (例)
讨 论
原发恶性骨肿瘤是起源于骨组织的恶性肿瘤性疾病,严重危害人类健康,其发病率占全部恶性肿瘤的1%,具有年轻化、恶性程度高和致残率高等特点。当前原发恶性骨肿瘤主要的治疗方式是保肢术,是未来治疗发展的主要方向,术前精确判定肿瘤浸润范围对其治疗预后及保肢术后肢体重建至关重要。国外相关研究认为,测量术后肿瘤标本中的肿瘤范围是判定骨肿瘤浸润范围的金标准[3]。现阶段对恶性骨肿瘤术前浸润范围的研究主要通过MRI技术,包括常规序列、DWI及动态增强等。DWI是一种无创性从分子水平上反映活体组织结构及功能的一种新的影像技术,能够定量分析不同组织的性质,已广泛应用于骨肿瘤的诊断、疗效评估等方面[6-9]。
DWI图像可通过ADC值来定量区分不同组织成分。国外相关研究发现DWI能够通过ADC值鉴别良恶性肿瘤,人体正常肌肉组织与病变组织的ADC值差异存在统计学意义[9-10]。本研究结果显示,当b值为500s/mm2时,肿瘤实性区、肿瘤坏死、肌肉水肿(包括近、远端)、正常肌肉、骨髓水肿的ADC值差异存在统计学意义;进一步两两比较结果显示,除正常肌肉与骨髓水肿的ADC值差异无统计学意义外,其它两两比较ADC值差异均有统计学意义。经影像与病理点对点对照研究,肿瘤实性区低ADC值是因为肿瘤细胞密集及核浆比高,使得水分子扩散受限。但当肿瘤发生坏死时,细胞膜裂解使水分子的扩散受限减低,造成坏死组织的ADC值较肿瘤实性区组织的ADC值高。总之,DWI能够区分不同组织成分,对临床疗效评估及肿瘤范围判定有重要价值。
由于肿瘤与周围正常组织之间常有过渡区,它是由少量肿瘤细胞(微浸润)或水肿组成[11],而肿瘤过渡区的水肿会影响常规MRI图像上肿瘤范围的判定,并导致脂肪抑制T2WI或STIR图像确定肿瘤范围过高[12]。本研究结果显示,常规T2WI、FS-T2WI和STIR图像测量的肿瘤浸润范围要大于病理标本测量的肿瘤浸润范围,推测与肿瘤过渡区所致的信号有关。MRI常规序列不能区分肿瘤过渡区内的微浸润与水肿,本研究结果显示,肌肉水肿近端区DWI图像上的ADC值要低于远端肌肉水肿的ADC值,并经病理证实肌肉水肿近端区内部有肿瘤微浸润,因此DWI能够通过ADC值区分肿瘤过渡区内的微浸润与水肿,为更精准测量肿瘤浸润范围提供帮助。
DWI界定恶性骨肿瘤浸润范围较MRI常规技术更加客观准确,MRI常规序列成像基于质子弛豫时间,多种病理状态下信号强度发生重叠是难免的,而DWI主要基于组织中水分子自由扩散运动的快慢,不同病理状态下水分子的运动改变不同。孟悛非等[13]研究常规序列与SSEPI-DWI确定恶性骨肿瘤浸润范围时,发现ADC图可以确定肿瘤髓内浸润范围,尤其当常规序列T1WI和/或STIR界定肿瘤浸润范围存在较大差异或存在困难时,ADC图可为精确判定肿瘤浸润范围提供参考。本研究结果显示,ADC图上测量的肿瘤浸润范围低于常规序列测量的范围,并且最接近于病理标本的测量值。在各序列对肿瘤范围显示的敏感度、特异度方面,DWI-ADC图像显示肿瘤范围的敏感度及特异度远高于常规序列,敏感度、特异度均最高(分别为93.3%和80.0%),而最优常规序列中FS FSE-T2WI的敏感度及特异度(分别为66.7%和53.3%)明显低于DWI。总之,DWI-ADC图较MRI常规序列能能精确、客观地确定肿瘤浸润范围,对临床治疗有指导性帮助。
本研究存在以下局限性:①样本量较少,可能存在数据偏倚;②本研究采用兔VX2肿瘤模型,其生物学行为及影像学表现与人不完全一致,以后需通过人体研究进一步证实;③本研究为常规序列与DWI的对比研究,未与MRI增强扫描及其它功能成像进行对比研究。
综上所述, PROPELLER DWI-ADC图像显示的肿瘤浸润范围更接近于病理标本测量的浸润范围,可通过ADC值区分肿瘤过渡区微浸润与水肿,较常规MRI图像更能精确地界定肿瘤浸润范围并且检测肿瘤浸润范围的敏感度及特异度最高,可作为临床界定骨肿瘤浸润范围的优选序列。
