COVID-19相关急性脑损伤的临床及影像学表现
2021-01-27赵凌云朱文珍覃媛媛张妍张巨朱文杰
赵凌云,朱文珍,覃媛媛,张妍,张巨,朱文杰
2019新型冠状病毒病(coronavirus disease 2019,COVID-19)在全球大范围爆发,其致病病毒为严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus2,SARS-CoV-2)。虽然COVID-19主要表现为呼吸系统症状,但SARS-CoV-2的靶点血管紧张素转换酶2受体(angiotensin converting enzyme 2,ACE2)在全身多个系统表达,可导致肝、脾、肾、消化道、心脏及造血系统、脑等多器官的损伤[1]。相关研究表明约36.4%的COVID-19患者会出现神经系统症状如头痛、头晕、意识障碍、急性脑血管病、共济失调、癫痫以及神经肌肉损伤[2],其潜在的致病机制目前认为可分为直接损伤和间接损伤两种。直接损伤可能是由于SARS-CoV-2病毒直接侵犯神经系统所致,而间接损伤可能与炎症因子风暴、低氧血症、凝血功能异常有关.但关于COVID-19伴发急性脑损伤的神经影像表现,国内报道很少。本文回顾性分析9例COVID-19伴发急性脑损伤患者的临床及影像表现,旨在初步探讨其影像学特点和临床特征。
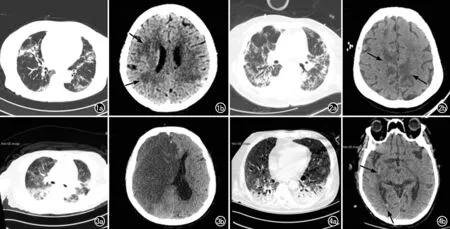
图1 患者,女,65岁,首发症状为胸闷气急。a) 胸部CT示双肺散在实变影、磨玻璃影及纤维化改变; b) 头部CT示双侧额顶叶白质区多发片状低密度脱髓鞘样病灶。 图2 患者,女,65岁,首发症状为间断发热伴喘息。a) 胸部CT示双肺散在实变影、磨玻璃影及纤维化改变; b) 头部CT示双侧扣带回脑梗死。 图3 患者,女,71岁,首发症状为呼吸困难、乏力。a) 胸部CT示双肺散在实变影、磨玻璃影; b) 头部CT示右侧大脑半球大面积脑梗死伴大脑镰下疝。 图4 患者,男,60岁,首发症状为发热气短。a) 胸部CT示双肺散在实变影、磨玻璃影; b) 头部CT示右侧基底节及右侧侧脑室后角出血。
材料与方法
搜集2020年1-3月146例本院确诊为新型冠状病毒感染且同时接受头部CT或MRI检查的住院患者,其中临床诊断为COVID-19合并急性脑损伤者9例,年龄42~71岁,平均(60±10)岁。所有患者均根据国家卫健委发布的新型冠状病毒肺炎诊疗方案[1]确诊为COVID-19,鼻咽拭子核酸和血清特异性抗体阳性。9例患者均行头部及肺部MSCT平扫,分别重建层厚为5 mm及1.25 mm的图像,其中1例患者同时接受MRI平扫、磁敏感加权成像(susceptibility weighted imaging,SWI)及磁共振血管成像(magnetic resonance angiography,MRA)检查。图像分析由两位神经影像诊断医师进行,两者意见不一致时由第3位经验丰富的神经影像诊断医师判读。搜集患者发生急性脑损伤最近时间点的超敏反应C蛋白、血小板计数、凝血功能、D-D二聚体定量、氨基末端脑钠肽前体(NT-proBNP)等实验室检查结果,同时记录患者高血压病及糖尿病等基础疾病史。

表1 COVID-19合并急性脑损伤患者的临床表现及症状
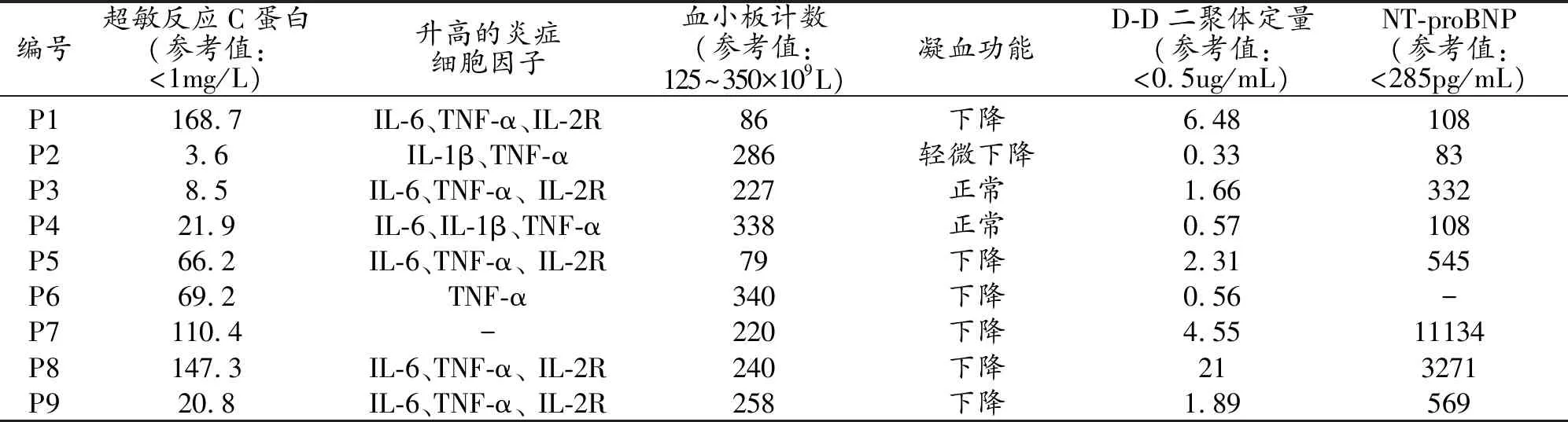
表2 COVID-19合并急性脑损伤患者的实验室检查结果
结 果
1.影像表现
所有9例患者双肺CT表现为实变影、磨玻璃影、纤维化、白肺等COVID-19相关典型肺部CT改变(图1~5)。脑部影像学表现根据病灶的分布和密度、信号特点可以分为5类。单纯脑出血1例,脑梗死6例,炎性脱髓鞘改变1例:双侧额顶叶白质区见多发片状稍低密度影。血管炎、脑膜炎伴多发脑出血1例:胼胝体及脑室急性期血肿、双侧大脑半球多发微出血灶,双侧额叶、左侧颞叶软脑膜及左侧颞部硬脑膜增厚强化,前纵裂见软脑膜强化,左侧侧脑室后角室管膜强化,双侧大脑中动脉及左侧大脑后动脉多发局部管腔狭窄,左侧大脑后动脉及左侧大脑前动脉局部血管壁增厚强化。
2.临床表现及实验室检查
8例(88.9%)患者有高血压或糖尿病病史,1例(11.1%)无高血压及糖尿病病史。9例(100%)患者均有超敏反应C蛋白不同程度升高,8例(88.9%)患者炎症细胞因子升高,6例(66.7%)患者氨基末端脑钠肽前体升高,2例(22.2%)患者血小板计数下降,7例(77.8%)患者凝血功能指标不同程度下降,8例(88.9%)患者D-D二聚体升高(表1、2)。1例(11.1%)患者合并心房颤动。3例(33.3%)患者最终死亡,6例(66.7%)患者临床症状好转。
讨 论
本组9例COVID-19相关急性脑损伤的影像学特点主要有5种表现:脑出血、脑梗死、炎性脱髓鞘、血管炎及脑膜炎。导致急性脑损伤的原因包括直接机制和间接机制。
SARS-CoV-2病毒可能通过神经逆行性传播和血源性传播两种机制直接进入脑组织内。Politi等[3]报道了1例嗅神经侵袭的COVID-19患者,并且近期的研究证实部分COVID-19患者存在嗅觉丧失[4],所以SARS-CoV-2病毒可以经由嗅球逆行进入脑组织。SARS-CoV-2病毒也可经血液循环突破血脑屏障直接进入脑组织,Paniz-Mondolfi等[5]研究显示SARS-CoV-2感染患者尸检中发现毛细血管内皮和神经元中有病毒颗粒存在,证实了这种可能性。Ellul等[6]发现病毒进入脑实质及血管内可引起脑炎、脑膜炎、血管炎、炎性脱髓鞘等直接损伤改变。Xu等[7]证实了SARS病毒可侵犯中枢神经系统,引起神经细胞的坏死和胶质细胞增生,相关研究报道了1例SARS-CoV-2病毒直接损伤引起的右侧颞叶脑炎的病例,该患者脑脊液检查显示SARS-CoV-2病毒的存在,说明SARS病毒可能引起病毒性脑炎,SARS-CoV-2感染患者尸检中发现毛细血管内皮中有病毒颗粒存在。Radmanesh等[8]报道了10例存在弥漫性脑白质病的COVID-19患者;Palao等[9]报道了1例COVID-19患者伴发多发性硬化改变。上述研究表明SARS-CoV-2病毒可能存在直接损伤脑组织的机制。本组1例患者也表现为CT低密度影,结合患者在住院期间新发肢体麻木症状,脑脊液及血清学检查排除了多发性硬化、视神经脊髓炎谱系疾病以及常见的其它病原体感染,临床综合诊断为炎性脱髓鞘.虽然该患者脑脊液中未检测到SARS-CoV-2病毒,但笔者分析可能是由于脑脊液检查的局限性,该患者炎性脱髓鞘改变虽然主要与引起的炎性或自身免疫反应有关,但病毒直接损伤的可能性不能排除。
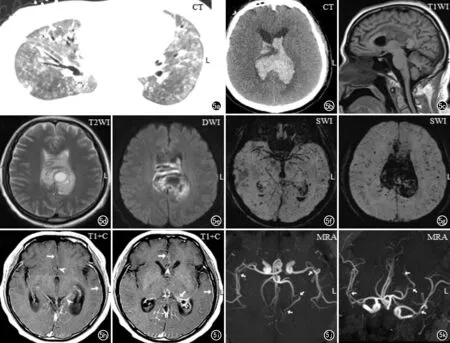
图5 患者,男,42岁,首发症状为发热伴呼吸困难,无基础疾病。a) 胸部CT示双肺弥漫磨玻璃影伴局部实变,呈“白肺”表现; b) 双侧侧脑室出血; c~e) 胼胝体出血,双侧侧脑室出血; f~g) 磁敏感加权成像示双侧枕颞叶多发低信号微出血灶; h~i) 多处硬脑膜及软脑膜增厚强化,并见多处血管壁增厚强化; j~k) MRA从不同角度显示双侧大脑中动脉及左侧大脑后动脉多发局部管腔狭窄,左侧大脑后动脉并见狭窄后扩张表现。
SARS-CoV-2可以通过引起炎性因子升高、凝血功能异常、介导心肌细胞和动脉斑块的炎性损伤等间接原因导致急性脑损伤。本组所有患者超敏反应C蛋白升高,并且88.9%(88/9)的患者炎症细胞因子不同程度升高,这些炎症因子可破坏血脑屏障,从而在大脑无病毒直接感染和感染性脱髓鞘的情况下引起急性坏死性脑病[10]。病毒感染导致凝血功能和血小板计数降低,并且部分患者存在高血压或糖尿病等基础疾病,可能诱发急性脑出血的发生,本组2例患者出现了急性脑出血。本组部分患者NT-proBNP和D-D二聚体水平升高,表明可能存在心肌损伤、凝血功能异常,这些改变容易诱发心房颤动和血栓形成,导致这些患者发生急性脑梗死。部分患者存在高血压、糖尿病等基础疾病,可能导致动脉粥样硬化,在严重的全身炎性应激情况下循环系统中大量的细胞因子会导致动脉粥样硬化斑块失稳以及破裂形成栓子[11],重症患者的呼吸困难及低氧血症常使患者需要呼吸机的支持,并且导致长期卧床、低氧血症,这些因素单独或同时存在是COVID-19伴发急性脑梗死的原因。炎症风暴和心血管等多器官损伤同时也是COVID-19死亡的危险因素[12]。
本组1例既往健康无基础疾病的中年男性患者,住院治疗过程中发现胼胝体及脑室急性出血、双侧大脑半球多发慢性微出血灶,多发血管炎、脑膜炎及室管膜炎,分析可能原因与病毒直接损伤血管内皮细胞导致的血管炎机制有关,此外,该患者为危重型,炎症风暴、凝血功能异常、多器官损害等多种原因共存也可导致急性脑出血及多发慢性微出血。
Chougar等[13]报道新冠病毒相关脑损伤同样具有多种影像学表现,包括急性缺血性梗死(24.7%)、多发性微出血(11.3%)、胼胝体细胞毒性改变(4.1%)、多灶性炎性脱髓鞘(5%)等,其中急性脑梗死患者比例最高,这与本组9例患者的影像表现具有一定相似性。
本研究存在以下局限性:COVID-19相关急性脑损伤的诊断主要依靠血清学及临床诊断,缺乏脑脊液诊断依据,后续将进一步随访观察。
综上所述,结合本组患者资料及相关文献报道,COVID-19相关急性脑损伤影像特征主要包括6类表现:脑梗死、脑出血、脑炎、炎性脱髓鞘、血管炎、急性坏死性脑病。如果COVID-19患者存在基础疾病、细胞炎症因子明显升高、凝血功能异常等高危因素时,需在诊疗过程中密切关注患者的神经系统改变,尤其是对于炎症因子持续处于高水平的患者需及时行颅脑影像学检查,以排查相关急性脑损伤,尽早干预以改善患者预后。
