磁性金属有机骨架材料Fe3O4@ZIF-7的制备及其吸附性能的研究
2021-01-26唐祝兴张岐龙余孟
唐祝兴,张岐龙,余孟
(沈阳理工大学环境与化学工程学院,辽宁沈阳110159)
废水中的有机物主要是卤代、硝基、氨基等;无机物质主要包括硫酸、盐酸、氯化钠等[1]。废水中化学需氧量(COD)浓度为三千至数万单位的浓度。且染料废水都有共同的特性,比如色度高、有机物质的浓度较高、组分复杂以及水质水量波动范围极大。孔雀石绿(MG)是一种深绿色阳离子三芳基甲烷染料,对真菌攻击和原生动物感染有很好的效果,被广泛用作水产养殖中的杀生剂[2]。当我们品尝水产品时,孔雀石绿会进入体内并残留下来[3]。在20 世纪初,孔雀石绿在实践中被证实具有驱虫杀菌的效果后,开始被人们广泛应用水产动物中的一些疾病的预防和治疗,主要用于水霉病、鳃霉病和小瓜虫病等[4]。但最近几年,由于环境持久性和急性毒性,现如今MG 已被禁止用于水产养殖,但该染料仍用于非水产养殖目的,并直接排放到水体中。因此,人们越来越认识到从水性流出物中除去MG 对于防止环境污染是必不可少的。此外,该染料还在食品、医药、制造业等领域都有一定的用途。然而,MG 可引起致癌、致突变、致染色体断裂、致畸性和呼吸毒性,并且毒性作用使得该染料受到很多关注。
目前已经开发了各种处理技术,包括主要的物理、化学和生物过程。在所提出的所有方法中,物理吸附由于其高效率、简单的设计和易于操作而被认为是最流行和有效的方法。因此已经进行了大量的研究,通过多种吸附剂的使用来除去MG,比如黏土、活性炭、农业文化废物和金属有机骨架等。最近几年,为有效达到增加金属有机骨架材料(MOFs)的性能和适用性的目的[5],研究人员已经深入探索MOFs材料的结构和特性[6]。金属有机骨架材料不仅有MOFs 材料的特点[7],还有其他功能材料特点,例如光学特性、电学特性、磁学特性和催化等特性[8]。这些功能材料主要包括金属纳米粒子、石墨烯等[9]。
本实验制备了Fe3O4粒子,然后用苯并咪唑、六水合硝酸锌、N,N‐二甲基甲酰胺(DMF)等药品制得具有沸石咪唑酯骨架结构材料(ZIFs)修饰改性的磁性微球ZIF‐7,再用其修饰Fe3O4,从而得到Fe3O4@ZIF‐7,利用多种表征手段对材料进行表征,探究出最佳吸附因素,得到处理孔雀石绿工业废水的新型方法。
1 实验部分
1.1 仪器与试剂
仪器:JA1203 型电子天平(上海精密科学仪器有限公司);X410M1 型EDS 能谱分析仪(德国Bruker光谱仪器公司);TAS‐990型双光束紫外可见分光光度计(北京普析通用有限责任公司);TENSOR27 型傅里叶变换红外光谱仪(国布鲁克光谱仪器公司);QUANTA250 型扫描电子显微镜(美国FEI公司)。
药品:乙二醇、DMF、三氯化铁、无水乙酸钠、六水合硝酸锌、苯并咪唑,皆为分析纯;孔雀石绿为生物染色剂。
1.2 材料制备
1.2.1 Fe3O4纳米粒子的制备
(1)用天平准确称量2⋅7 g 的FeCl3·6H2O 固体,在研磨和粉碎后,加入150 mL 乙二醇溶液,使之溶解。
(2)待溶液完全溶解后,用天平称取7⋅2 g 无水乙酸钠,把混合物研磨至其粉碎,之后置于烧杯中,并将其用保鲜膜用来密封,使用搅拌器进行磁力搅拌,时间为1 h,振荡使其全部溶解,转移至聚四氟乙烯反应容器。
(3)将其放入真空干燥箱中,设置温度为200 ℃,在此条件下持续加热反应8 h 以上,等到反应进行完全后将反应釜置于室内,使其自然冷却。
(4)从釜取出制备出的产物,倒入干燥的蒸发皿中,用磁铁分离,并且使用大量无水乙醇进行反复洗涤。放入烘箱内,设置温度为60 ℃直至完全干燥后转移贮存以备后期使用。
1.2.2 Fe3O4@ZIF-7复合材料的制备
(1)用天平分别称取0⋅595 g 的Zn(NO3)2和0⋅2365 g 苯并咪唑于烧杯中,并加入0⋅4 g 已制备好的Fe3O4粒子,同时取45 mL的DMF倒入烧杯内,并把它们放到高压反应釜内。
(2)把反应釜放到烘箱内,设置温度为130 ℃,并保持在130 ℃的温度下持续加热反应24 h 使之反应完全,并使其在室温下自然冷却。
(3)将反应后的溶液移至蒸发皿中,外加磁铁分离,并用大量DMF 溶液反复清洗后,放入烘箱内,设置温度为60 ℃直至完全干燥后转移贮存,以备后期使用。
1.3 吸附原理及吸附量、吸附率的计算
吸附是一种物质在物理作用力(范德华力)或者化学作用力(化学键力)的影响下在其他物质表面富集的过程。吸附量的计算公式为:

吸附率的计算公式为:

式中:C 为吸附前孔雀石绿的浓度,mg/L;C0为吸附完成后孔雀石绿的浓度,mg/L;V 为原溶液的体积,mL;W为吸附剂加入量,g。
2 结果与讨论
2.1 扫描电子显微镜(SEM)分析
图1 为室 温 下Fe3O4@ZIF‐7 的SEM 照 片。在20 kV 加速电压,工作距离10⋅9 mm,80000 倍放大倍率操作条件下,可以看出Fe3O4的形貌类似于球状粒子,由图可以看出ZIF‐7 的表面附有大量球状粒子,说明Fe3O4已经附着在ZIF‐7的表面。

图1 Fe3O4@ZIF-7的SEM照片Fig.1 SEM photograph of Fe3O4@ZIF-7
2.2 傅里叶变换红外光谱(FT-IR)分析
图2 为室温下所制备Fe3O4@ZIF‐7 的红外光谱图。599 cm‐1处有比较宽的吸收峰是由于Fe-O-Fe伸缩振动,因此可断定为Fe3O4的特征峰。在1000、1082 和1160 cm‐1处是苯并咪唑C = N 的伸缩振动所导 致。1461 cm‐1、1701 cm‐1处 的 吸 收 峰 分 别为C-N、C = C 的伸缩振动。由图可知,ZIF‐7 已附着在Fe3O4粒子的表面。
2.3 能谱分析
图3 为室温下Fe3O4@ZIF‐7 的能谱分析图。从能谱图能分析出所制备样品中各元素的含量,具体含量见表1,其中含有C、N、O、Zn、Fe 等。C、N、Zn元素是苯并咪唑中的元素,由此我们可以知道已成功的将ZIF‐7包裹在Fe3O4的表面。

图2 Fe3O4@ZIF-7的红外谱图Fig.2 Infrared spectrum of Fe3O4@ZIF-7

图3 Fe3O4@ZIF-7材料的能谱图Fig.3 Energy spectrum of Fe3O4@ZIF-7 material
2.4 标准曲线的绘制
分别配制孔雀石绿溶液的浓度为5、10、15、20、25 mg/L。绘制标准曲线,不同浓度孔雀石绿溶液吸光度A 为纵坐标,横坐标为孔雀石绿浓度。如图4 所示,孔雀石绿标准回归方程为A=0⋅10678C+0⋅0995,相关系数R2=0⋅99565。
2.5 振荡时间的选择
分别量取4 份20 mL 10 mol/L MG 溶液,于其中加入2 mg Fe3O4@ZIF‐7,振荡时间分别为30、60、90、120 min。等到振荡结束后,用磁石吸住磁性材料,取得上清液,测得吸光度A 代入回归方程及式(1)计算吸附量。以吸附量为纵坐标,振荡时间为横坐标作图。由图可知,Fe3O4@ZIF‐7 材料对孔雀石绿的吸附量随振荡时间延长而出现波动,呈现出先增大后减小的趋势,当振荡时间为90 min 时,吸附量最大。
2.6 最佳pH的选择
量取5份20 mL配制好的10 mg/L的MG溶液,放 入5 个 锥 形 瓶,再 分 别 用0⋅1 mol/L 的HCl 和NaOH 溶液调节pH,使pH 分别为2、3、4、5、6、7,称量3 mg 的Fe3O4@ZIF‐7 于各个锥形瓶中,在室温下振荡30 min。用上述2⋅3 中同样的方法,根据测得的吸光度而计算出的吸附量为纵坐标,pH 为横坐标作图,如图6所示。随着pH的增大,Fe3O4@ZIF‐7对孔雀石绿的吸附量先增大然后降低,当溶液pH为3时,吸附量最大。

图4 孔雀石绿标准曲线Fig.4 Malachite green standard curve
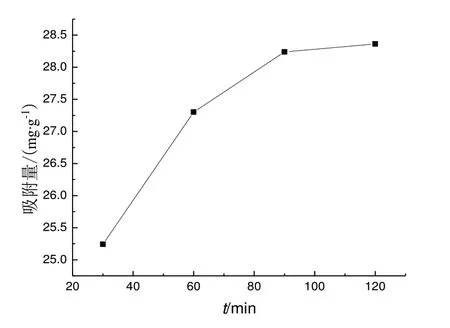
图5 振荡时间与吸附量的关系Fig.5 Relationship between oscillation time and adsorption capacity
2.7 材料用量的选择
量取5 份20 mL 10 mg/L MG 溶液置于5 个干燥 锥 形瓶 内,分 别 称 取2、3、4、5、6 mg 的Fe3O4@ZIF‐7复合材料,在室温下振荡30 min后,测定其吸附后的浓度。
可以看出,吸附量随材料用量变化而变化,吸附量随载体用量增加而增加,材料用量超过4 mg后吸附量增加渐缓,根据式(2)计算可知,当材料用量为4 mg 时,吸附率最大,吸附率为71⋅96 %。所以材料用量选择4 mg为佳。

图6 pH与吸附量的关系Fig.6 Relationship between pH and adsorption capacity

图7 材料用量与吸附量的关系Fig.7 The relationship between the amount of material and the amount of adsorption
3 结论
本文通过采用水热合成法制备了Fe3O4@ZIF‐7复合材料,并对其做了表征。并以Fe3O4@ZIF‐7 纳米复合材料为吸附剂吸附孔雀石绿,在最大吸收波长下用分光光度计进行测定吸附结果。研究振荡时长、溶液pH、材料用量等因素对该溶液的吸附效果。结果表明,Fe3O4@ZIF‐7 复合材料吸附孔雀石绿溶液的最佳条件为:振荡时间是90 min,pH 为3,吸附剂用量为4 mg。
