水淹胁迫下外源亚精胺对油茶光合及细胞膜系统的影响
2021-01-26黄金富郭璐瑶苗灵凤
黄金富,张 娟,郭璐瑶,苗灵凤,杨 帆
(海南大学 生态与环境学院,海南省生态环境修复工程中心,海南省农林环境过程与生态调控重点实验室, 海南 海口 570228)
油茶(CamelliaoleiferaAbel.)在海南又称山柚,属山茶科,山茶属常绿小乔木.作为世界四大木本油料作物之一,油茶在生态文明建设、提升森林质量、助力精准扶贫等方面有重要作用.在海南省油茶产业将成为具有海南特色的优势产业[1].油茶属于典型的亚热带经济树种,其在我国湖南、江西和广西等亚热带丘陵地区广泛种植.然而油茶主要适应于亚热带适当的降雨环境,它对高温多雨的环境缺乏一定的耐受性[2].海南省是我国纬度最低的省份,同时也是独一无二的热带岛屿,作为国内降雨量最多的省份之一,其近60年的年平均降雨量可达到1 800 mm.在海南,由极端降雨、台风等造成的水涝不仅限制了海南油茶的分布,而且还直接影响了油茶的生长和产量[3].水淹会直接影响植物的形态、生理和细胞超微结构,降低光合作用和光合色素含量等,从而影响植物的生长发育;同时水淹还会导致植物根系缺氧,致使植物体内活性氧簇物质大量积累,这些物质会对细胞膜系统的稳定性、叶绿体及抗氧化系统造成严重伤害,对植物的代谢平衡造成负面影响,甚至导致植株死亡[4-6].然而植物本身能够从形态、生理、生化等方面,比如形成不定根或通气膨大组织、维持较高的糖酵解代谢相关酶活性、调节细胞质pH及抗氧化酶活力等,进行自我调节以应对水淹胁迫[7-8].
亚精胺(C7H22N3,Spd)是一种能够提高植物对环境胁迫抗性的生物活性物质,是植物在调节自身生长发育过程中重要的生理代谢调节物质[9-10].亚精胺对于植物抗逆性作用的提高主要表现为抗干旱胁迫[11]、抗硝酸钙胁迫[12]、抗盐胁迫[13]、抗重金属胁迫[14]、抗渗透胁迫[3]及抗水淹胁迫[5]等.当前,在“外源亚精胺对植物水淹抗逆性”的研究中,大部分的研究对象为草本植物的玉米(ZeamaysL.)、黄瓜(CucumissativusL.)等,但是“有关亚精胺对乔木树种的水淹抗逆性”的研究却鲜有报道,如尤东玲等(2016)的研究表明,外源亚精胺对提高水淹胁迫下玉米的抗氧化能力具有显著的效果;冀保毅等(2018)的研究表明,水分胁迫下Spd可通过提高小麦叶片中抗氧化代谢酶的活性来降低MDA的含量,提高可溶性蛋白和Pro的积累量,从而缓解水分胁迫对小麦幼苗的伤害.鉴此,本研究以海南本地小型乔木—油茶为试验材料,研究了喷施外源亚精胺后其对水淹胁迫下海南本地油茶的光合及生理特性的影响,阐明了油茶对水淹胁迫的响应;评价了外源亚精胺对提高油茶耐水淹能力的影响.
1 材料与方法
1.1 试验材料试验材料为由种子萌发的一年生海南海口本地野生普通油茶实生苗.试验地点位于海南大学海甸校区的热带农林学院教学实验基地内,6~10月白天(8∶00~20∶00)平均温度为32.6 ℃,平均湿度为72.9 %,晚上(20∶00~8∶00),平均温度为27.1 ℃,平均湿度为88.2 %.2018年6月底,将无病害的健康幼苗移栽至基质为V红壤土∶V椰糠∶V沙=3∶2∶1的苗盆(口径21 cm,高19 cm)中培育,每盆基质为5.0 kg,每盆定植1株,并放置托盘.幼苗定植2个月后的9月1日,挑选长势基本一致的健康幼苗进行试验处理.实验前测定土壤基质的基本理化性质:最大田间持水量为48.66%,pH值为6.53,全氮、全磷、有机质、有机碳分别为1.55 g·kg-1、0.54 g·kg-1、54.21 g·kg-1、30.55 g·kg-1.
1.2 试验设计试验设置4个处理,即正常水分下的对照组(CK)、正常水分下喷施外源亚精胺组(CK+Spd)、水淹组(WT)、水淹下喷施外源亚精胺组(WT+Spd).每个处理设置4个重复,每个重复4株幼苗(盆),每个处理16株,共计64株(盆)植物.水淹试验(半淹处理)是在教学基地大棚内进行,水面高于土壤表面10 cm,待水淹处理下的幼苗出现明显叶片枯黄或有部分老叶掉落时结束处理,并进行采样与测定,试验处理时间为15 d.试验处理期间,每天下午6点充分喷施1 mmol/L的外源亚精胺于叶片的正反面(施加外源亚精胺处理);对照组试验处理期间,每天下午6点充分喷施清水于叶片的正反面.
1.3 生长指标的测定及方法采用数显游标卡尺(DL91150,得力集团有限公司,中国)于根茎贴近地面处测量地径,读数精确至0.1 mm.试验处理前重复测量每株幼苗的地径3次,取其平均值作为初始值,水淹处理结束后再次测量并将其值作为最终值.地径增长(Ground diameter, mm)=G15-G1.G15:油茶幼苗第15天时的地径;G1:油茶幼苗第1天时的地径.
1.4 生理指标的测定及方法在2018年9月15日,于水淹处理组,在油茶出现明显的叶片枯黄或部分老叶出现落叶现象时测定光合指标并采样.于4个处理中均随机选择6株幼苗,选取顶芽以下的第3~8片成熟功能叶,并进行测定.光合指标是采用LI-6400XT光合仪(LI-COR,USA)并参考Yang等[16]的方法测定;叶绿素a(Chla)、叶绿素b(Chlb)和总叶绿素含量(TChl)则是参考Yang等[16]的方法测定(丙酮法);叶片水势(LWP) 参考的是苗灵凤等[17]的方法并采用WP4C露点水势仪(Gene Company Limited, USA)测定;相对电导率参考的是Dong等[18]的方法,同时采用电导率仪(FE38, METTLER TOLEDO, 中国)测定;丙二醛(MDA)含量、可溶性糖含量和可溶性蛋白含量参考的是Han等[19]的方法,并采用紫外分光光度计(UV-1800 PC, 上海美谱达仪器有限公司, 中国)测定.
1.5 数据处理采用SPSS 23.0,Excel 2013和GraphpadPrism 8软件完成数据分析与作图,接着用SPSS软件进行单因素方差(ANOVA)的Duncan显著性分析(P<0.05).
2 结果与分析
2.1 外源亚精胺对水淹胁迫下海南油茶幼苗地径生长量的影响如图1所示,在正常水分条件下,油茶幼苗经过喷施外源Spd后(处理15 d),其对幼苗生长的影响并不明显,CK组与CK+Spd组之间在地径生长量上无显著差异(P>0.05).水淹胁迫显著降低了油茶幼苗的地径生长(P<0.05),WT组地径生长量比CK组地径生长量降低了43.9%;于水淹下施加外源Spd,因水淹胁迫而抑制地径生长的现象得到显著缓解,即外源Spd能促进水淹下油茶幼苗地径的生长,在WT+Spd组,其地径生长量较WT组的地径生长量提高了40.2%,达到显著差异;然而,WT+Spd组的地径生长量仍显著低于CK组的地径生长量.
2.2 外源亚精胺对水淹胁迫下海南油茶幼苗叶片数的影响如图2所示,正常水分条件下,油茶幼苗经过喷施外源Spd后(处理15 d),其对幼苗叶片数无明显的影响,CK组与CK+Spd组之间于叶片数上无显著差异(P>0.05).水淹胁迫下,WT组与WT+Spd组之间在叶片数上也无显著差异(P>0.05),WT组的叶片数仅比CK组的叶片数降低了13.43%;而在水淹下施加外源Spd后, WT+Spd组的叶片数较WT组的叶片数提高了8.62%.
2.3 外源亚精胺对海南油茶光合特性的影响如图3所示,在CK+Spd处理中,油茶幼苗的Pn、Gs、Ci和Tr与CK组之间无显著差异;在水淹处理下,WT组的Pn、Gs、Ci和Tr与CK组的Pn、Gs、Ci和Tr相比分别下降了35.2%、36.4%、32.5%和21.6%,这表明水淹胁迫下油茶幼苗的各项光合指标均显著降低.WT+Spd组的Pn、Gs、Ci和Tr与WT组的Pn、Gs、Ci和Tr相比分别上升了16.3%、34.9%、16.1%和13.1%,这表明水淹胁迫下喷施外源Spd可在一定程度上提高油茶幼苗的各项光合指标,但均未达到CK组的水平.
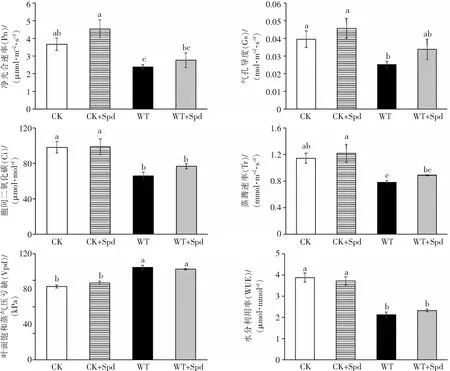
图3 外源亚精胺对油茶光合特性的影响
2.4 外源亚精胺对海南油茶光合色素的影响如图4所示,在CK+Spd处理中,油茶幼苗的TChl、Chla、Chlb含量较CK组的TChl、Chla、Chlb含量分别增长了32.5%、41.8%、17.8%,正常水分下喷施外源Spd可显著提高油茶幼苗的TChl和Chla;水淹处理后,WT组的TChl、Chla、Chlb含量较CK组的TChl、Chla、Chlb含量分别降低了22.1%、23.3%、20.1%,表明水淹胁迫下油茶幼苗的TChl和Chla含量显著降低,同时Chlb的含量也较明显地降低.WT+Spd组的TChl、Chla、Chlb含量较WT组的TChl、Chla、Chlb含量分别增长了14.3%、8.9%、22.6%,表明水淹胁迫下喷施外源Spd可在一定程度上提高油茶幼苗的光合色素含量,但均未达到显著水平.
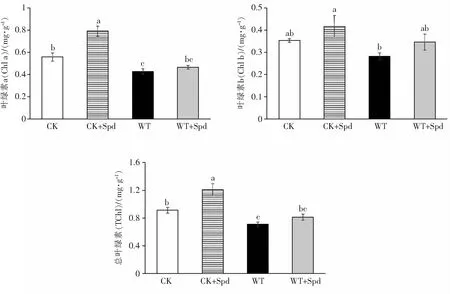
图4 外源亚精胺对油茶叶绿素含量的影响
2.5 外源亚精胺对海南油茶叶片水势的影响如图5所示,在CK+Spd处理,油茶幼苗的叶片水势与CK组油茶幼苗的叶片水势无显著差异.在水淹处理下,WT组的叶片水势较CK组的叶片水势降低了71.6%,这说明水淹胁迫下油茶幼苗的叶片水势显著降低了;WT+Spd组的叶片水势较WT组的叶片水势提高了66%,这说明水淹胁迫下喷施外源Spd可显著地提高油茶幼苗的叶片水势.
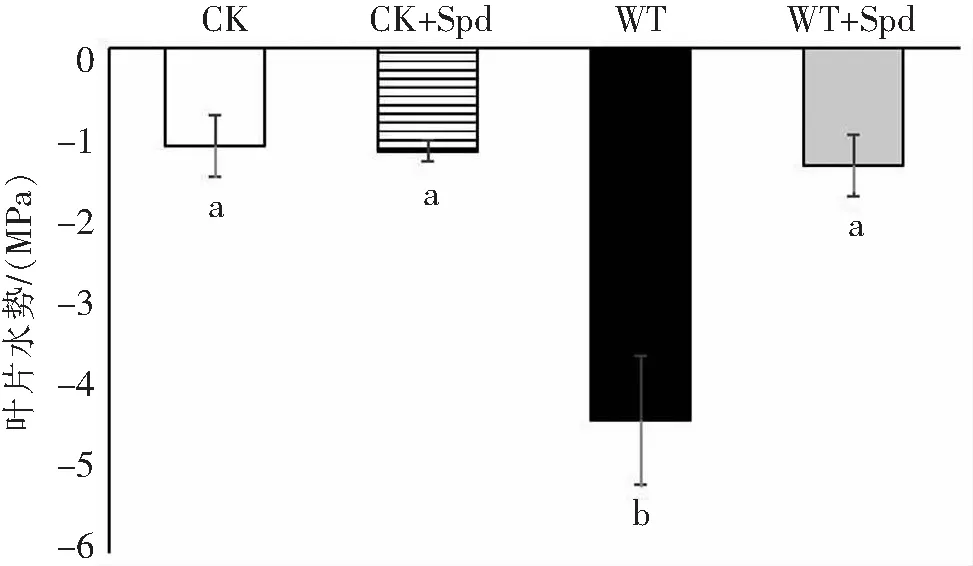
图5 外源亚精胺对油茶叶片水势的影响
2.6 外源亚精胺对海南油茶的相对电导率、丙二醛含量、可溶性蛋白含量和可溶性糖含量的影响如图6所示,在CK+Spd处理中,植株的相对电导率、MDA含量、可溶性蛋白含量和可溶性糖含量与CK组相比均无显著差异.在水淹处理下,WT组的相对电导率、MDA含量、可溶性蛋白含量以及可溶性糖含量较CK组的同类项分别升高了32.66%、29.48%、58.24%、119.31%,且变化均达到显著水平.WT+Spd组的相对电导率、MDA含量、可溶性糖含量较WT组的同类项降低了29.67%、16.75%、29.61%,但可溶性蛋白含量与水淹组的可溶性蛋白含量无显著差异.水淹下喷施外源Spd可显著降低油茶幼苗的电导率、丙二醛和可溶性糖含量.
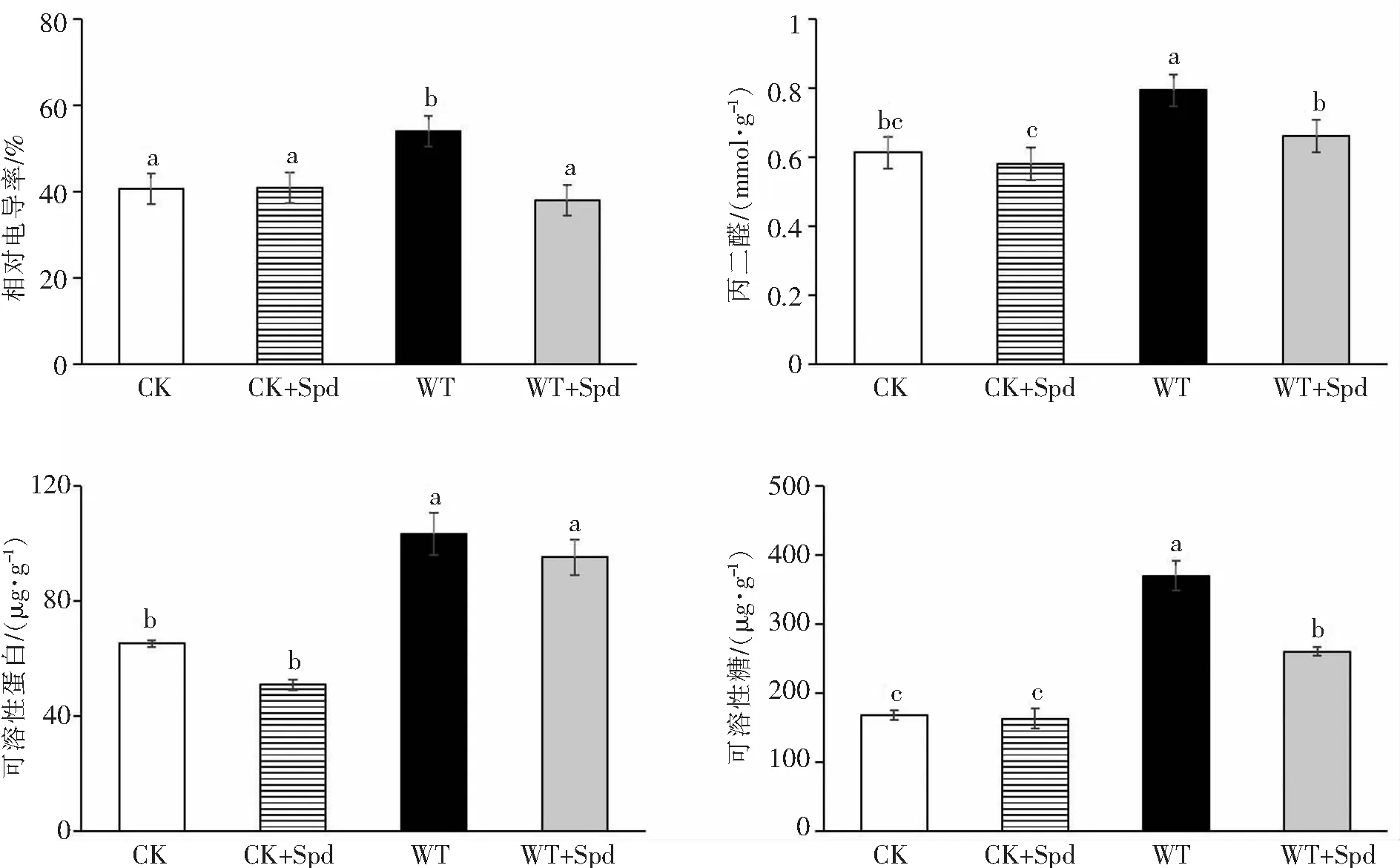
图6 外源亚精胺对油茶的相对电导率(RC)、丙二醛(MDA)含量、可溶性蛋白和可溶性糖含量的影响
3 讨论和结论
水淹胁迫下,植物的根系处于低氧环境,这会导致植物的水分与氧气吸收能力降低[20].水淹胁迫下,植物处于缺氧的环境,其根茎的水分代谢会失调,产生生理性缺水,从而会导致叶片水势下降和引起叶片气孔导度下降[21].同时,水淹还会导致植物根系腐烂,使其对养分的吸收大幅减少,也使其对生长发育所需的微量元素无法吸收,最终导致其正常的生长发育减慢.叶绿素是保证植物进行正常光合作用的重要光合色素[22],在水淹胁迫下,植物由于有氧呼吸受阻而转换为无氧呼吸,此过程会产生乙醇、过氧化氢、超氧阴离子等有害物质,有氧呼吸的氧化磷酸化受阻会引起叶绿素的合成途径受阻,同时,自由基的积累会破坏内囊体薄膜的正常结构与功能,导致叶绿素的含量显著降低[5,8,23-25].该研究的结果显示,短时间的水淹胁迫(15 d)会导致海南油茶的叶片发黄、植株生长缓慢以及其叶片水势、叶绿素含量和光合作用参数等显著降低,这些现象综合表明,水淹胁迫会导致叶绿体功能受损.然而,水淹胁迫下施加外源Spd后,受水淹胁迫抑制的植株生长、叶片水势、叶绿素含量、光合作用参数等均得到了一定程度的缓解,这表明施加外源Spd可在一定程度上缓解水淹对海南油茶的伤害,但其缓解能力有限.
相对电导率是判断植物在逆境条件下细胞膜结构被破坏程度的重要指标[26].水淹胁迫下细胞膜会受到累积的MDA、H2O2等过氧化产物的伤害,致使细胞膜结构与功能被破坏,从而导致细胞液外渗和引起植物叶片的相对电导率增大[27].因此,在水淹胁迫下,叶片的相对电导率能反映细胞膜结构和功能的完整性,故其常被作为植物是否耐涝的重要指标之一[28].MDA作为膜脂过氧化的最终产物之一,在水淹胁迫下其含量的变化可直接反映植物在逆境下受胁迫的程度[29].在本研究中,在水淹下施加外源亚精胺,油茶的相对电导率和MDA含量均显著降低,这表明外源亚精胺对于保护细胞膜系统和清除水淹胁迫下油茶叶片所产生的膜脂过氧化物有显著的作用.
可溶性蛋白与可溶性糖是植物体内维持渗透势平衡的重要调节物质[13].水淹胁迫下,由于缺氧而抑制了植物的有氧呼吸,耐水淹植物会通过无氧呼吸来消耗可溶性糖等碳水化合物,并产生少量的ATP以维持生理活动[30],此时植物先迅速积累叶片中的可溶性糖与可溶性蛋白,然后依靠细胞非酶抗氧化系统来清除活性氧自由基,同时维持细胞的膨压和提高细胞的吸水与保水能力,在适应水淹胁迫后,植物中的可溶性糖与可溶性蛋白的含量又会恢复至正常水平.在本研究中,在水淹胁迫下喷施外源Spd后,油茶可溶性蛋白与可溶性糖的含量显著降低,这表明外源Spd对缓解水淹胁迫下油茶渗透调节物质的剧烈变化有显著效果.
综上所述,海南本地油茶对水淹胁迫较为敏感,短时间的水淹(15 d)对植株生长、叶片水势、光合色素含量、光合作用参数、膜脂过氧化等会产生较明显的负面影响.水淹处理下,施加1 mmol·L-1的外源亚精胺能有效地缓解水淹胁迫对海南本地油茶的伤害作用,同时也表明,施加外源亚精胺可在一定程度上缓解水淹对油茶生长和根系发育的抑制,这与亚精胺能够缓解细胞衰老和促进油茶大分子蛋白质的合成有关.因此,喷施外源亚精胺能有效缓解水淹胁迫对油茶幼苗生长发育带来的不利影响,可在一定程度上提高油茶幼苗对水淹胁迫的抗逆性.该研究结果可用于指导极端气候条件下的油茶栽培管理.
