热带富油微藻胶网藻的响应面优化及其扩大培养
2021-01-26刘佑杰王启化赵震宇
刘佑杰,王启化,陈 晨,赵震宇,,王 博
(1. 海南大学 化学工程与技术学院,海南 海口 570228; 2. 山东科技大学 化学与生物工程学院,山东 青岛 266510;3. 单县园艺社区卫生服务中心,山东 菏泽 274300; 4. 海南健康职业技术管理学院,海南 澄迈 571900)
胶网藻(Dictyosphaeriumsp.)属于绿藻门胶网藻属,现已证实其具有生长速度快、高生物量、高油脂含量、高生物活性物质含量等特点[1-2];此外,微藻生物油脂也已被证实可用于替代不可再生的化石燃料[3].然而,高密度化和高油脂富集培养始终是制约微藻产业进一步商业化的重大因素,因此为了实现微藻产业进一步的发展和践行清洁高效能源政策,本研究对胶网藻的高密度高油脂培养条件进行了优化.
1 材料与方法
1.1 微藻的初培养、收获及生物量(油脂)测定胶网藻分离纯化自海南省海口市的淡水水域(N 20°02′45.97″, E 110°11′438.39″),并被储存在BG-11的培养基中[4].胶网藻培养的初始接种量为φ(胶网藻)=10%.首先将胶网藻培养在3.2 L的发酵罐中(INFORS,Labfors,瑞士),然后进行室内单因素和响应面的优化实验.隔菌:以0.25 μm的特氟龙透气膜通过空气;户外培养:将初级培养的藻液转移至40 L柱形光生物反应器中进行中级扩大培养;胶网藻的最终中试扩大培养实验:将逐级扩大的藻液转移至户外800 L的管道式光照反应器中.胶网藻的生长状况是通过测定680 nm下的光密度值(OD680)来进行监控.培养结束后,通过离心收获(8 000 r·min-1,2 min)微藻,并使用去离子水清洗3次以去除无机盐,接着使用冷冻干燥机干燥(Scientz 10N,宁波)所获得的藻泥,并将其储存在- 40 ℃的冰箱中.所得生物量计算如下:
其中,Pbiomass是生物量;M是冷冻干燥后的微藻质量(g);V是培养基的体积(L).
微藻油脂的提取:通过V三氧化烷∶V甲烷=2∶1法来提取微藻油脂[4],总油脂含量(TLC)和总油脂产量(TLY)的计算如下:
TLY=TLC×Pbiomass,
其中,ML为微藻油脂的总重(g).
1.2 光照强度影响的实验本实验采用BG-11培养基来进行培养.将胶网藻置于发酵罐中,分别使其在光照强度为0,54,90,180,360,540 μmol/(s·m2)条件下培养,控制通气量为60 L/h,初始pH值为7.0±0.1,培养温度为27 ℃和培养周期为7 d.最后经离心、冷冻、干燥后收获,并测定生物量、油脂含量和产量.
1.3 碳源影响的实验本实验是在原BG-11培养基的基础上进行的优化,除碳源以外,其他成分的浓度均保持不变,分别使用Na2CO3和NaHCO3作为唯一碳源,并保证其中碳元素的摩尔浓度相同(0.189 mmol/L);此外,保持以下条件:通气量为60 L/h,初始pH值为7.0±0.1,培养温度为27 ℃,光照强度为180 μmol/(s·m2),培养周期为7 d.最后,经离心、冷冻、干燥后收获,并测定生物量、油脂含量和产量.
1.4 氮源影响的实验本实验是在原BG-11培养基的基础上进行的优化,除氮源以外,其他成分的浓度均保持不变,分别使用NaNO3、甘氨酸和尿素作为唯一氮源,并保证其中氮元素的摩尔浓度相同(17.65 mmol/L),同时,保持以下条件:通气量为60 L/h,初始pH值为7.0±0.1,培养温度为27 ℃,光照强度为180 μmol/(s·m2).培养周期为7 d.最后,经离心、冷冻、干燥后收获,并测定生物量、油脂含量和产量.
1.5 响应面实验设计根据1.3和1.4的结果对BG-11培养基建立4因素3水平的Box-Behnken响应面实验.独立因素分别为:碳源浓度(X1,mmol/L)、氮源浓度(X2,mmol/L)、磷源浓度(K2HPO4,X3,g/L)和通气量(X4,L/h).表1显示了编码的水平和独立因素.响应值总生物量(TB,Y1)、总油脂含量(TLC,Y2)和总油脂产量(TLY,Y3)是使用多项式回归方程来表示:
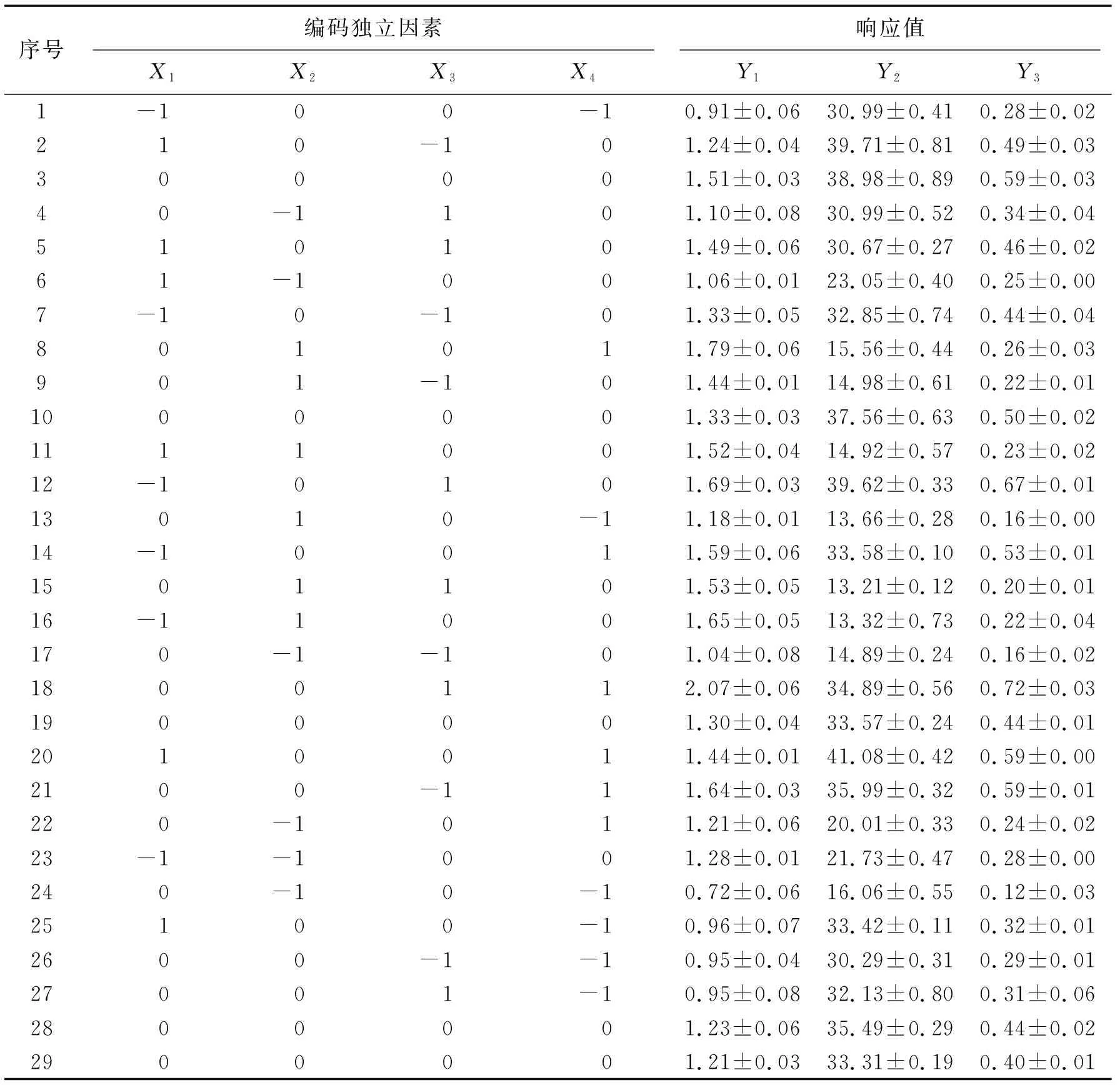
表1 4因素3水平的Box-Behnken响应面实验
其中,Y是响应值;α0是截距;αi,αii,αij分别表示线性、二次和交互回归系数;Xi和Xj表示编码的独立因素;k是独立因素个数.
1.6 户外中试培养利用800 L管道式生物反应器和优化后的培养基及培养条件对胶网藻进行扩大培养,并对比一次性加料和分批加料对微藻生长和油脂积累的影响.即一组按照BG-11培养基组分一次性加入营养物质(一次性加料),另一组则是将BG-11培养基组分均分成三等分,每2天补充一次营养物质(分批加料).此外,利用遮阳布和洒水方式,分别将光照强度和温度控制在360 μmol(s·m2)和25~28 ℃,初始pH值控制在7.0±0.1,培养周期控制在7 d.最后,经离心、冷冻、干燥后收获,测定生物量、油脂含量和产量.
1.7 数据处理与分析所有实验平行重复3遍,并采用SPSS 16.0软件进行显著性分析;响应面实验则采用Design-Expert 7.0进行设计.
2 结果与分析
2.1 光照强度影响的分析图1展示了光照强度对胶网藻生长状况的影响,胶网藻的生长在不同光照强度下展现出显著差异,当无光照时,胶网藻几乎停止生长,表明胶网藻不适应异养生长;随着光照强度的增加,胶网藻的生长逐渐改善,在360 μmol/(s·m2)时达到最佳,进一步增加光照强度则会造成胶网藻的生长受到抑制.同样如表2所示,胶网藻的生物量、油脂含量和油脂产量也在光照强度为360 μmol/(s·m2)时达到最高,且在180 μmol/(s·m2)和360 μmol/(s·m2)之间无显著差异(P<0.05).虽然光照强度在一定程度的增加会有助于生物量、油脂产率和油脂产量的提高,但是过高的光强则有可能破坏微藻油脂的产生和光合作用系统,因此,随着生物量的下降,油脂产率和油脂产量也下降.在光缺乏条件下,光照不能为光合作用提供足够的能量,如此会导致甘油三酯(主要包括中性脂肪)的积累下降;另外,由此弱光无法透过高密度微藻细胞所产生的黑色区域,因而会导致在光照生物反应器中微藻细胞对光的利用率不足[5].因此,360 μmol/(s·m2)的光照强度被用于后续室外扩大培养的研究中.
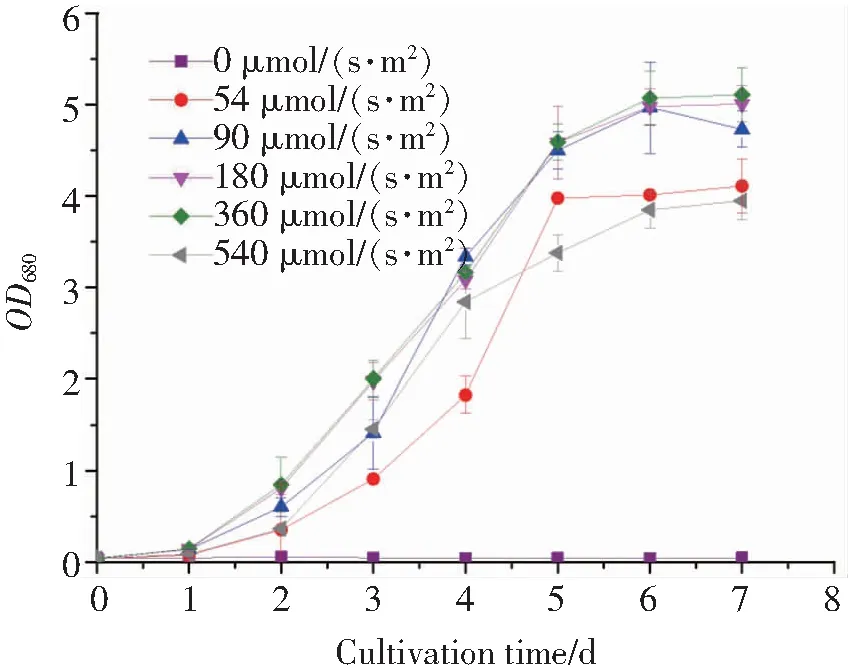
图1 不同光照强度下胶网藻的生长状况
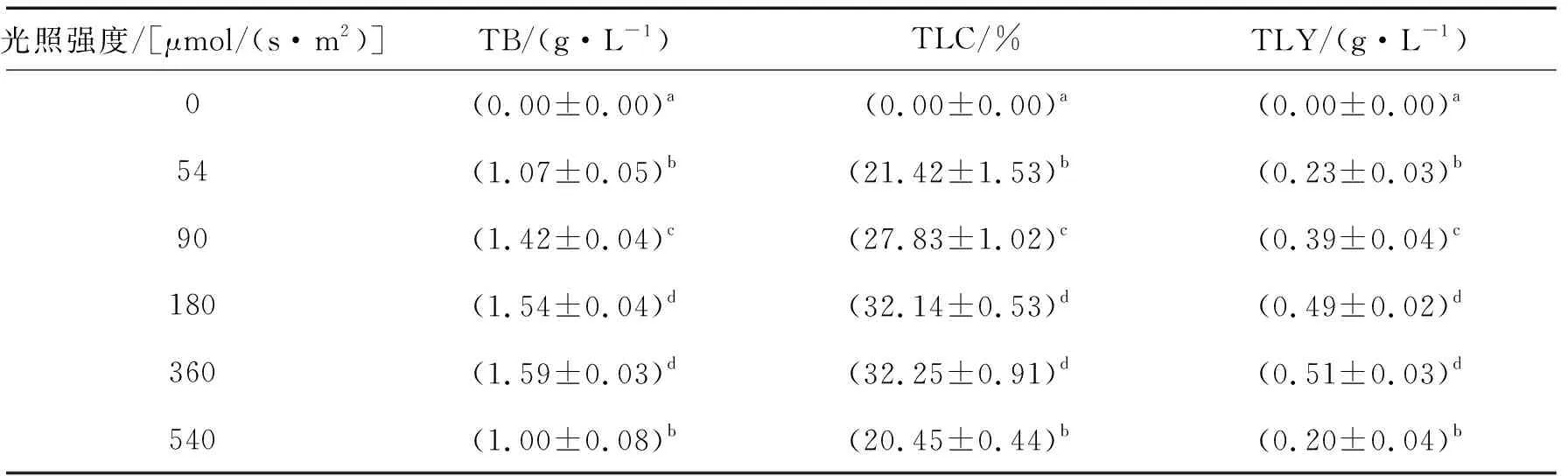
表2 光照强度对胶网藻生物量、油脂含量和油脂产量的影响

图2 不同碳源下胶网藻的生长状况
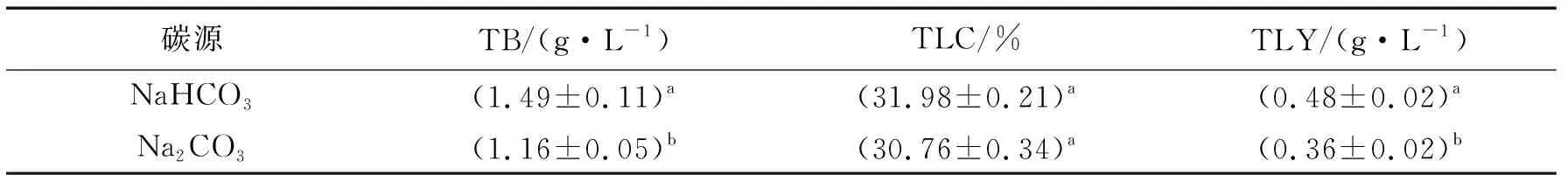
表3 不同碳源对胶网藻生物量、油脂含量和油脂产量的影响
2.3 氮源因素影响的分析由图3所示,使用NaNO3和尿素作为氮源时,胶网藻的生长状况相似,但是,当使用甘氨酸时,胶网藻的生长得到了显著的改善,并且,尿素和甘氨酸组持续生长,而NaNO3组在第6天就达到了平稳期.此外,在三组中甘氨酸组的生长最快,这些结果表明:甘氨酸和尿素可以明显地延长指数增长期,并提高胶网藻的生长速率.由表4可知,使用甘氨酸作为氮源时,生物量和油脂含量均得到提高,其中,以甘氨酸为氮源时其生物量最高[(1.64±0.08) g/L],NaNO3的生物量最低[(1.47±0.04) g/L],而油脂含量在三组中并没有明显的不同.结果表明:不同氮源对胶网藻的油脂含量没有明显的影响,但是却对生物量和油脂产量有较大的影响,究其原因可能是:不同种类的氮源对于不同微藻的生物量、油脂含量和油脂产量的影响也不相同.通常微藻对不同形式的氮利用率为:氨氮>硝态氮>亚硝态氮,而无机氨态氮可以通过转氨基作用直接合成氨基酸,经过脱氨作用后培养基的pH会急剧地下降,从而导致微藻生物量和油脂总量下降.相比之下,尿素和NaNO3可以明显地提高微藻的生物量和油脂总量,因此它们是大规模工业生产中被普遍应用的氮源,然而,NaNO3的低毒性和强氧化性有可能会导致一些微藻的氧化应激和细胞损伤,因此其不利于微藻的培养.由于尿素的水解产物主要为有机态氨氮,其与无机态氨氮相比含有更多的氨,其一部分被用于合成氨基酸,而另一部分则被转变为氨气,故导致了培养基的pH上升.与尿素和NaNO3相比,甘氨酸是一种无毒的非必需氨基酸,它不仅可以提供足够的氮,而且还可以参与三羧酸循环(TCA).三羧酸循环几乎是在每一种好氧生物中普遍存在的代谢途径,也是碳水化合物、脂肪、氨基酸等合成的枢纽和最终代谢途径.首先,甘氨酸可以与甲酰四氢叶酸合成丝氨酸,然后,丝氨酸在丝氨酸脱水酶的作用下脱水脱氢,转化为丙酮酸而直接进入三羧酸循环.此外,甘氨酸(具抗氧化能力)可以有效地清除活性氧,从而保证微藻的正常生理活动,并降低微藻代谢废物所带来的氧化应激反应[6-8].因此甘氨酸被用于后续BG-11培养基的优化.拟合方程R2值(0.911 9>0.9)表明拟合度良好,K2HPO4含量和通气量在模型中分别表现出显著和极显著影响,这说明二者相比于碳源和氮源更能够决定最终胶网藻的油脂产量.

图3 胶网藻在不同氮源下的生长曲线

表4 不同碳源对胶网藻生物量、油脂含量和油脂产量的影响
2.4 响应面优化实验考虑到微藻油脂的高附加值,因此本次优化主要针对胶网藻的最终油脂产量.由表5所示,该模型极显著(P<0.001),说明该模型中的变量与响应值之间的关系显著,因而该模型的置信度高.失拟项P值(0.608 8)>0.05,表明失拟项不显著,说明该模型对实验拟合的情况良好.根据回归方程及模型ANOVA分析结果,绘制了两因子效果图(图4).4个独立因素两两交互关系均呈现出抛物线趋势,并存在一个极大值点.通过响应面分析,最终得到如下预测结果:NaHCO30.19 mmol/L、甘氨酸14.86 mmol/L、K2HPO40.1 g/L和通气量9.8 L/h(达到最大油脂产量0.74 g/L).为了验证模型预测结果的准确性,在发酵罐中使用了优化后的条件来培养胶网藻,并进行6次平行实验,最终得到的油脂产量为(1.02±0.03)g·L-1.真实结果与预测结果接近,表明模型的置信度高.
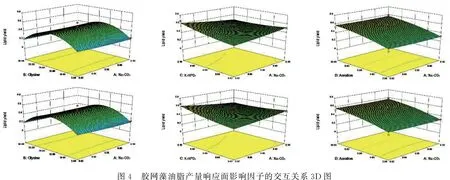
图4 胶网藻油脂产量响应面影响因子的交互关系3D图

表5 胶网藻油脂产量的多元二次多项式模型及ANOVA分析
2.5 户外中试培养及加量方式分析户外800 L管道培养中,使用了优化后的培养基,并以其用于探究不同加料方式对胶网藻生物量、油脂含量和油脂产量的影响,同时与原BG-11培养基进行了对比(光照控制在360/[μmol/(s·m2)].如图5所示,在最初两天,一次性加料和分批加料后其生长情况没有明显不同,只是一次性加料的生长速率略高于分批加料的生长速率,但两天后分批加料比一次性加料的生长速率高,这可能是由于最初两天一次性加料的营养元素浓度高于分批加料的营养元素浓度的缘故.但随着时间的推移,由于多余的营养元素会使水体富营养化,从而导致杂菌的滋生,富集的菌种在后期的培养中会与微藻产生竞争关系,进而导致微藻的生长受到抑制.此外,过营养化还可能引起微藻的沉淀,增大微藻收获的难度[8-10].在一次性加料的培养基和原始BG-11培养基的培养中,胶网藻在第四天达到平稳期,而在分批加料的培养基中其在指数生长期仍未达到平稳期.在整个生长阶段,原始BG-11培养基的生长曲线始终处于一次性加料和分批加料培养基的生长曲线之下,这说明优化后的培养条件在室外条件下仍然适用.如表6所示,使用优化后的培养基,胶网藻的生物量、油脂含量和油脂产量全部显著地提高.在不同加料方式的培养中,生物量、油脂产率和油脂产量也存在着较为明显的差异(P<0.05),采用分批加料方式后,生物量、油脂产率和油脂产量相较于原始BG-11培养基分别提高了65.17%,22.02%和108.00 %,综上所述,分批加料更适合胶网藻的生长.通过对比室内发酵罐的培养发现,于户外培养,其油脂产量降低,其原因为:于户外生长无法保证密闭生长,且培养基无法进行无菌处理;此外,户外环境多变,难以精确控制,这也造成了微藻最终油脂产量的降低[11-12].
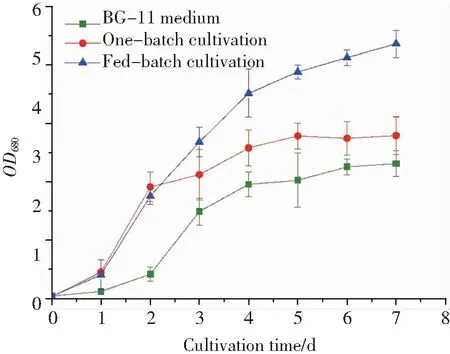
图5 不同加料方式对胶网藻生长状况的影响

表6 不同加料方式对胶网藻生物量、油脂含量和油脂产量的影响
3 结 论
本研究对胶网藻的生长条件和培养基进行了优化,并发现碳酸氢钠和甘氨酸是最佳的碳源和氮源.采用油脂产量作为评价标准,通过响应面优化实验最终确定胶网藻的最佳培养条件为:NaHCO30.19 mmol·L-1、甘氨酸14.86 mmol·L-1、磷酸氢二钾0.1 g·L-1、通气量9.8 L·h-1和光照强度360 μmol(s·m2).室内发酵罐培养得到的最高油脂产量为1.02 g·L-1.通过户外800 L管道式生物反应器的大规模培养实验发现,分批加料更有利于胶网藻的生长及油脂积累,且其最大油脂产量为0.85 g·L-1.本研究为胶网藻的开发与利用提供了实验和理论的基础.
