珍稀植物日本荚蒾遗传多样性的ISSR分析
2021-01-26蒋明应梦豪徐丽娜马佳莹邬张颖杨如棉朱欣李彦蓉
蒋明,应梦豪,徐丽娜,马佳莹,邬张颖,杨如棉,朱欣,李彦蓉
(台州学院生命科学学院,浙江椒江318000)
荚蒾属(Viburnum)隶属忍冬科(Caprifoliaceae),为灌木或小乔木,落叶或常绿。荚蒾属植物在全世界约有200种,分布于温带和亚热带地区,我国约有73种,其中45种为我国特有种[1]。日本荚蒾(V.japonicum)为常绿植物,叶片革质,呈卵型、近卵型或宽倒卵型,叶片表面呈深绿色,背面浅绿且叶脉突出;花序复聚伞形,花色洁白,果熟时鲜红色,具有较高的观赏价值(见图1)[2]。日本荚蒾大多生长在海岛山坡林下、杂木林或乱石堆中,数量十分稀少。日本荚蒾为中国-日本间断分布种,在韩国、日本等近海地区亦有发现,我国台湾北部海岸也有少量分布,大陆仅见于浙江舟山东福山岛、台州大陈岛、临海头门岛、田岙岛和雀儿岙岛等地[3-4]。近年来,随着浙江东部海岛的旅游开发,部分海岛植物的生境遭到一定程度的破坏,日本荚蒾现已被列入《浙江省重点保护野生植物名录》(第一批),是极小种群拯救保护物种之一[5]。

图1 日本荚蒾Fig.1 Viburnum japonicum
与形态学、细胞学及生理生化标记相比,分子标记十分稳定,不受材料环境和发育阶段的影响,近年来,在遗传多样性、亲缘关系分析、种质资源鉴定、基因定位和遗传图谱构建等研究中得到广泛应用[6]。简单序列重复区间扩增多态性(inter-simple sequence repeat,ISSR)是由 ZIETKIEWICZ 等[6]基于简单序列重复(simple sequence repeats,SSR)建立的一种新型分子标记技术,其在SSR的3’或5’端加上2~4个锚定核苷酸,以提高反应的专一性,PCR产物经电泳分析后可获得遗传多样性信息[7]。ISSR技术具有操作简便、重复性好和多态性高等优点,在遗传多样性研究中应用较广[8]。对日本荚蒾的已有研究仅见于生理生化、扦插繁殖和化学组成等方面,对分子层面的遗传多样性研究未见报道[9-11]。本研究在调查和搜集日本荚蒾种质资源的基础上,用ISSR技术对基因组DNA进行PCR扩增,旨在揭示不同地理来源日本荚蒾的遗传多样性水平,为该物种的保护和开发提供理论依据。
1 材料与方法
1.1 材 料
日本荚蒾叶片采自上大陈岛(SDC)、头门岛(TM)、雀儿岙岛(QEA)和东福山岛(DFS)4个样地,共8个居群、125份样品。日本荚蒾在TM分布极其稀少,仅发现一个居群,其余样地均有多个居群,各居群的地理位置信息见表1。采集时,选择茎干直径3 cm左右且间隔在20 m以上的植株样品,选取健康的日本荚蒾叶片置于冰盒,带回实验室后用无菌水清洗,自然风干后保存于-80℃的超低温冰箱中备用。
1.2 方 法
1.2.1 基因组DNA的提取
将日本荚蒾叶片置于研钵中,加入液氮研磨至粉末状,用SDS法提取基因组DNA。用1.0%(W/V)琼脂糖凝胶(含溴化乙锭)电泳检测提取结果,用美国伯乐Gel Doc XR+凝胶成像系统拍照记录,将DNA溶液置于-20℃的冰箱中保存备用。
1.2.2 ISSR-PCR扩增
依据不列颠哥伦比亚大学(The University of British Columbia,UBC)公布的100条ISSR通用引物,以日本荚蒾DNA为模板,用伯乐C1000型PCR仪进行ISSR通用引物的筛选和体系程序优化。选取多态性高、重复性好的引物,对DNA模板的浓度、引物用量和反应温度等进行优化。根据已优化的体系和程序,用筛选得到的引物对所有日本荚蒾样品进行ISSR-PCR扩增。将PCR产物点样置于1.0%(W/V)琼脂糖凝胶(含溴化乙锭)中,电压和电流分别设置为125 V与55 mA,电泳40 min,用凝胶成像系统观察,并拍照记录。
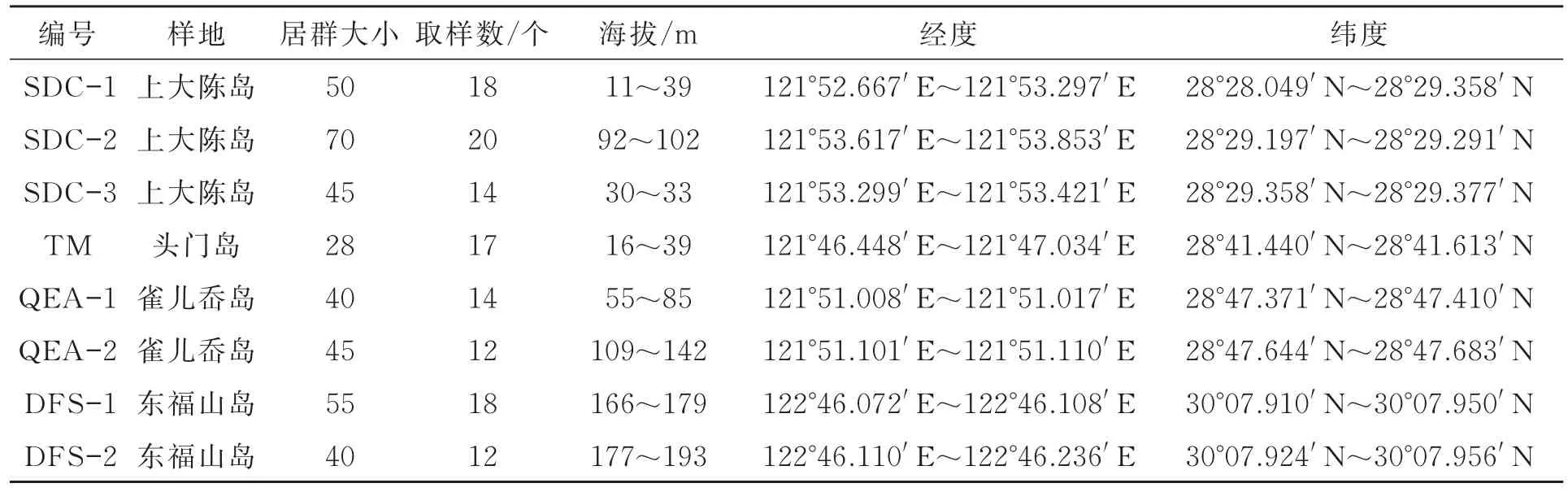
表1 日本荚蒾居群的采样位置信息Table 1 Sampling information of Viburnum japonicum populations
1.2.3 数据分析
以ISSR-PCR照片为依据,用Excel表统计谱带数量,有谱带处标“1”,无谱带处标“0”,建立0/1矩阵;用POPGEN 32软件计算Nei’s基因多样性指数(Nei"s gene diversity index,H)和 Shannon’s信息指数(Shannon"s information index,I)等遗传参数;用NTSYS 2.10软件对125个样品进行聚类分析,绘制亲缘关系树状聚类图。
2 结果与分析
2.1 样品采集
日本荚蒾的数量十分稀少,仅零星分布于头门岛、上大陈岛、雀儿岙岛和东福山岛等地,其中头门岛为日本荚蒾的新分布点,植株稀少,不足30株,而上大陈岛的植株相对较多。日本荚蒾伴生植物主要有柃木(Eurya japonica)、天仙果(Ficus erectavar.beecheyana)、龙须藤(Bauhinia championii)、菝葜(Smilax china)、滨 柃(Eurya emarginata)、海 桐(Pittosporum tobira)、鳝藤(Anodendron affine)、海州 常 山(Clerodendrumtrichotomum)和 野 桐(Mallotus japonicusvar.floccosus)等。
2.2 ISSR-PCR扩增
2.2.1 ISSR扩增结果
经优化,获得最佳反应体系:2.0 μL 10× Taq Plus PCR 缓冲液(含 20 mmol·L-1Mg2+),0.5 μL DNA 模 板(50 ng·μL-1),0.5 μL 引 物 ,0.5 μL dNTPs,0.4 μL Taq DNA 聚 合 酶 ,ddH2O 补 至20 μL。PCR程序设置:94℃预变性300 s;94℃变性45 s,55.4℃退火45 s,72℃延伸120 s,共39个循环;72℃延伸600 s。取部分DNA样品,将其作为模板进行引物筛选,选取UBC835、UBC836、UBC840、UBC841、UBC842、UBC895和 UBC899共7条多态性高、谱带清晰且重复性好的引物。
采用优化后的反应体系与程序,用7条引物对125份样品进行ISSR-PCR扩增实验,共得到240条谱带,平均每条引物扩增出34.29条谱带,其中多态性谱带232条。引物UBC895扩增得到的谱带最多,为39条,多态性位点百分比(PPB)为94.87%;引物UBC835扩增出的谱带最少,仅29条,PPB为89.66%;PPB最高的引物为UBC840、UBC842和UBC899,达100%,说明ISSR标记扩增效率较高且多态性较好,其中引物UBC899对部分日本荚蒾样品的ISSR扩增图谱见图2。
2.2.2 居群的遗传多样性
对ISSR-PCR谱带数据进行分析,得到遗传多样性指数(见表2)。在物种水平上,日本荚蒾的PPB为96.67%,H为0.227 3,I为0.358 1。在居群水平上,各居群间PPB差异较大,介于21.67%和40.00%之间,TM样地最高,DFS-1次之,SDC-2最低,平均值为32.61%;H的变化范围为0.073 1~0.136 3,平均值为0.108 8;I的变化范围为0.109 2~0.205 1,平均值为0.164 2,8个居群的PPB、H和I均低于物种水平。在8个居群中,TM样地的PPB、I和H均为最大,居群内多样性水平最高;SDC样地的3个居群,遗传多样性水平相对较低。
2.2.3 居群间的遗传距离与遗传分化
用POPGENE 32软件计算居群间遗传距离与遗传一致度,结果表明,各居群的遗传距离为0.098 2~0.254 0,遗传一致度为 0.775 7~0.906 4(见表3)。由表3可知,QEA-1和SDC-3之间的遗传距离最大,DFS-1和DFS-2之间的遗传距离最小。DFS-1和DFS-2的遗传一致度最高,达0.906 4;QEA-1和SDC-3的遗传一致度最低,仅为0.775 7。居群间基因分化系数(Gst)为 0.527 1,即居群间存在52.71%的遗传变异,遗传分化较大。8个居群间基因流(Nm)为0.448 7,基因交流相对较少。
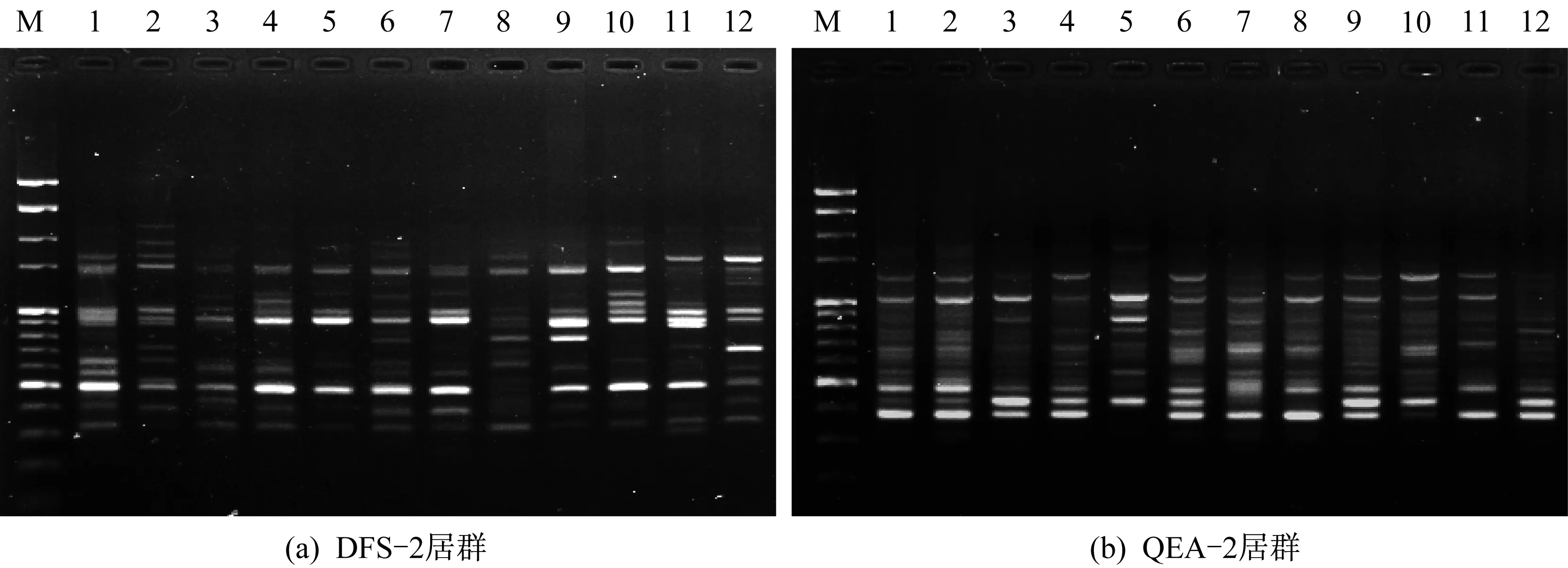
图2 引物UBC899对部分日本荚蒾样品的ISSR扩增图谱Fig.2 ISSR amplification profiles of Viburnum japonicum samples with primer UBC 899M:DNA标准分子量;1~12:12个样品的ISSR-PCR产物M:DNA marker;1-12:ISSR-PCR products of 12 samples
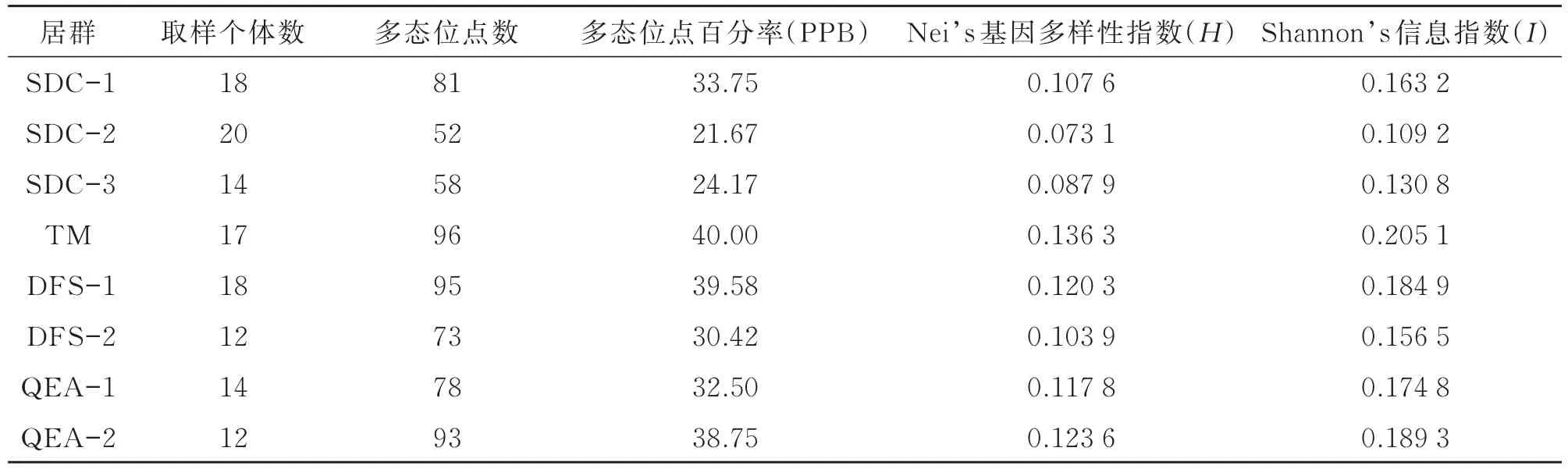
表2 日本荚蒾居群的遗传多样性Table 2 Genetic diversity of Viburnum japonicum populations
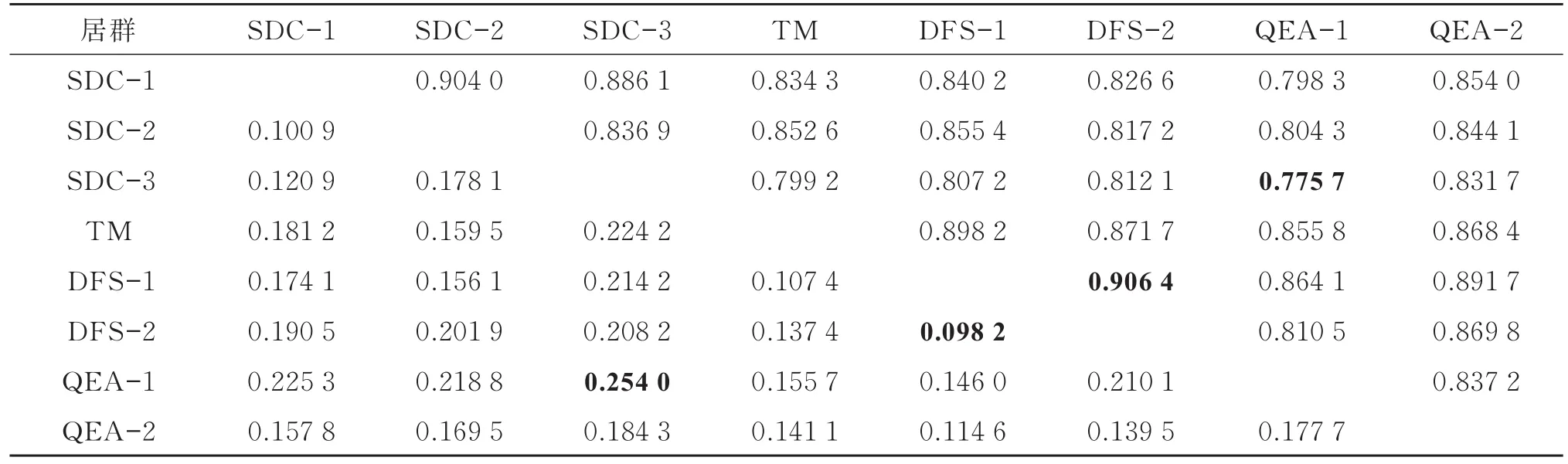
表3 日本荚蒾8个居群的遗传距离和遗传一致度Table 3 Genetic distance and Nei"s genetic identity of eight Viburnum japonicum populations
2.2.4 聚类分析
为进一步探讨日本荚蒾8个居群间的遗传关系,用NTSYS 2.1软件进行聚类分析(见图3)。由图3可知,当遗传一致度为0.709 0时,8个居群可分为4大类:SDC-1、SDC-2和SDC-3为一类,与地理位置密切相关;QEA-2、DFS-1和DFS-2为一类,TM和QEA-1各成一类。8个居群均表现出明显的地域性规律,来自同一样地的居群大多聚为一类,但也有来自不同样地的居群聚为一类的。因QEA-1与其他居群遗传差异大,亲缘关系较远,单独归为一类。
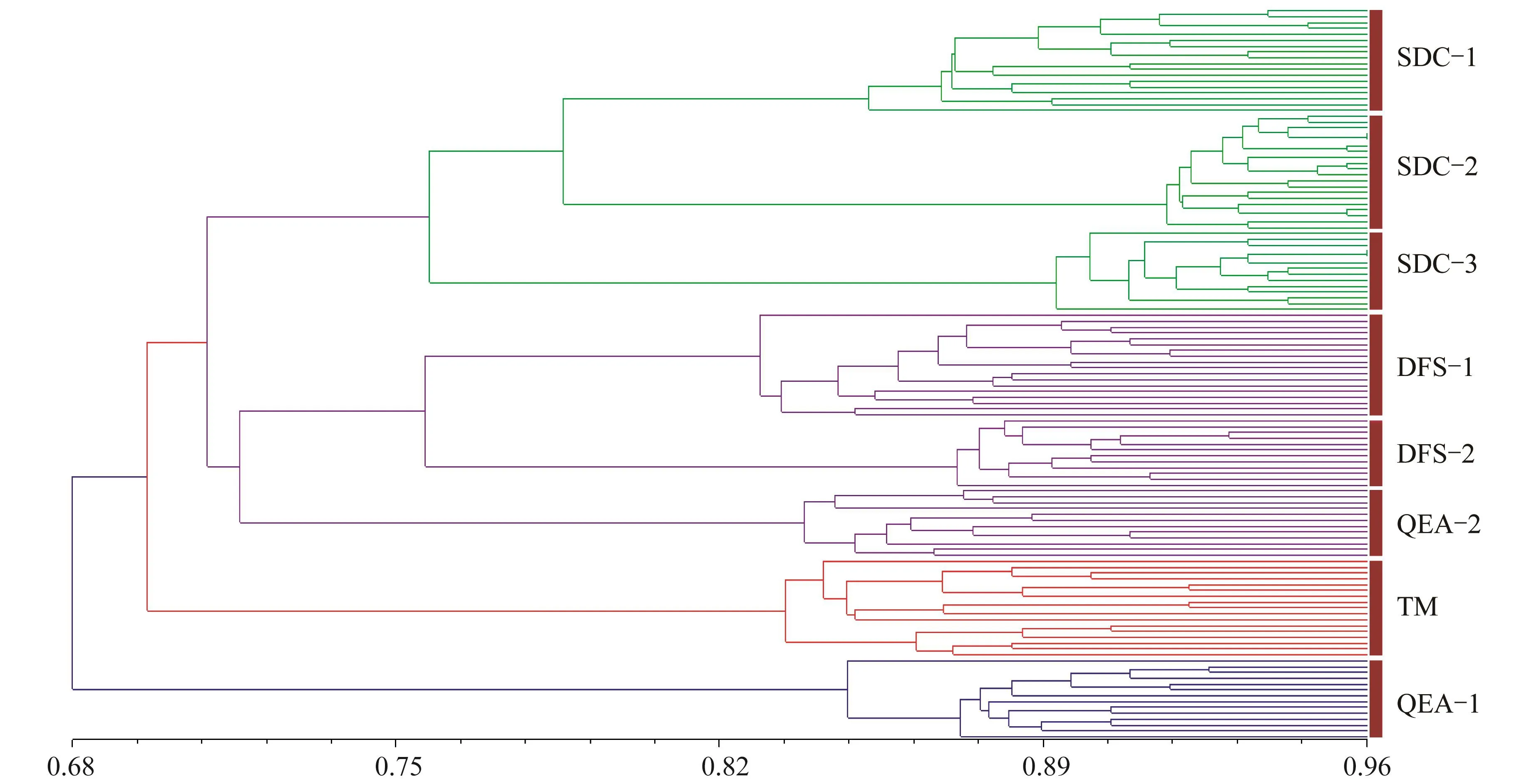
图3 日本荚蒾8个居群的聚类分析Fig.3 The dendrogram of eight populations Viburnum japonicum
3 讨 论
常见的分子标记有随机扩增多态性(random amplified polymorphic DNA,RAPD)、限制性片段长度多态性(restriction fragment length polymorphism,RFLP)、相关序列扩增多态性(sequence-related amplified polymorphism,SRAP)和ISSR等,每种标记各有优缺点[12]。近年来,科研人员利用ISSR分子标记开展了大量遗传多样性研究。开展物种遗传多样性和遗传结构等方面的研究,是探讨物种适应性和生存能力的基础,也是分析物种濒危原因的基础,有助于制定科学有效的保护策略和措施。为开展对珍稀植物杨叶肖槿(Thespesia populnea)的种质资源保护,张永夏等[13]建立了杨叶肖槿ISSR-PCR最适反应体系。段帆等[14]利用ISSR对174份水青树(Tetracentron sinense)种质资源进行PCR扩增,为构建78份核心种质提供了数据支持。李群等[15]利用ISSR和AFLP 2种分子标记技术对延龄草(Trillium tschonoskii)的7个自然居群的遗传多样性和居群结构进行了研究,结果显示,生境破坏、居群间遗传分化程度高和遗传多样性水平低是延龄草濒危的主要原因。
地理分布受限的珍稀濒危植物遗传多样性通常较低,冷欣等[16]利用 ISSR对全缘冬青(Ilex integra)的6个居群进行了研究,结果表明,全缘冬青的遗传多样性较低。史艳财等[17]对小花异裂菊(Heteroplex microcephala)进行ISSR-PCR扩增,结果表明,PPB为30.21%,H为0.105 4,I为0.154 6,其在物种水平上遗传多样性较低。近年来,大量研究证明,一些珍稀濒危植物亦具有较高的遗传多样性,数量稀少并不一定意味着其遗传多样性水平低[18]。 张颖娟等[19]对珍稀濒 危小灌木长 叶红砂(Reaumuria trigyna)的研究结果表明,该物种虽然数量不多但遗传多样性水平较高。金则新等[20]对濒危植物夏蜡梅(Calycanthus chinensis)的分析发现,其在物种水平上遗传多样性高,在居群水平上遗传多样性较低。本研究也得到类似结果,在物种水平上,日本荚蒾的PPB高达96.67%,I为0.358 1,H为0.227 3,遗传多样性高;而在居群水平上,日本荚蒾的PPB平均值为32.61%,I平均值为0.164 2,H平均值为0.108 8,遗传多样性相对偏低,居群内遗传衰退的原因可能与遗传漂变、有效规模下降及自交亲和等有关[21]。
日本荚蒾居群间Gst为0.527 1,即居群间存在52.71%的变异,居群内存在47.29%的变异,遗传变异大部分出现在居群间。日本荚蒾的居群数量和规模较小,基因流被海岛山和岛屿间距离阻遏,本地居群内近交和遗传漂变上升,导致居群内遗传多样性降低,居群间出现较大的遗传分化现象[22-24]。WRIGHT[25]认为,当Nm值大于 1时,居群间遗传分化才能发挥均质化作用,若Nm值小于1,则表明基因流动受限,导致居群间遗传分化增大。影响植物居群间遗传分化的因素很多,KWON等[26]认为,岛屿间的地理隔离会限制花粉及种子传播的范围,导致居群间出现较大的遗传分化。本研究中的日本荚蒾,居群间Nm仅为0.448 7,推测其与日本荚蒾的生长环境有关。野外调查发现,日本荚蒾生长于灌木丛中,在一定程度上限制了种子和花粉的传播。此外,8个日本荚蒾居群分布于相距较远的4个海岛,地理隔离导致的基因流受限可能是居群间遗传分化较高的主要原因。日本荚蒾遗传距离聚类分析结果显示,除QEA样地的2个居群归属不同类外,其余分布于同一岛屿的居群均归属同一聚类,表明日本荚蒾的遗传相似性与地理位置呈较明显的相关性。QEA样地的2个居群虽然处于同一海岛,但被高大的山坡阻挡,推测山坡的天然屏障作用是2个居群出现高度遗传分化的原因。
4 结 论
在野外调查的基础上,对8个居群共125份日本荚蒾样品进行ISSR遗传多样性分析。日本荚蒾植株十分稀少,据初步统计,数量不足1 000株,TM样地是新分布点,数量不足30株,该物种亟待保护;从100条ISSR通用引物中筛选出7条引物用于PCR扩增,获得了日本荚蒾8个居群的遗传多样性相关数据。TM样地的遗传多样性最高,SDC样地的遗传多样性最低,同一地理来源的日本荚蒾大多聚为一类,呈现一定的地域分布规律;日本荚蒾的遗传多样性较高,但主要存在于居群间,岛屿间的地理隔离可能是遗传分化的主要原因。基于研究结果,建议对日本荚蒾采取以下保护措施:(1)日本荚蒾居群数量少但遗传分化高,任一居群内少数个体的丢失均可能导致基因漂变,须就地保护,并建立种质资源库;(2)在开发海岛的同时,应兼顾保护日本荚蒾的自然生境;(3)通过人工授粉,增加日本荚蒾后代的基因杂合度;(4)通过居群间种苗的相互迁移返种。
