西格列汀对2型糖尿病患者血糖、CD4+T细胞亚群、炎性因子及氧自由基的影响
2021-01-26段建芳王首博胡凤蓉
王 婷,段建芳,王首博,马 锋,胡凤蓉
糖尿病是常见的代谢性疾病,近年患病率呈逐年增高趋势,严重危害人类健康。我国成人糖尿病患病率为9.7%,其中2型糖尿病(type 2 diabetes mellitus, T2DM)占90%以上[1]。T2DM的病理生理基础为胰岛素抵抗、胰岛β细胞障碍所致的胰岛素分泌不足[2]。有研究表明,T2DM呈现出慢性炎症及氧化应激状态,且和天然免疫系统的激活有着紧密联系[3]。尽管目前临床上T2DM治疗药物种类繁多,但尚无特效药物能够彻底阻止胰岛细胞功能减退而逆转糖尿病进程。西格列汀是一种二肽基肽酶-4(dipeptidyl peptidase-4, DPP-4)抑制剂,可通过增加肠促胰素水平而发挥降糖作用,并能够改善胰岛功能[4]。然而,国内临床使用西格列汀的时间不长,实践经验也比较有限。为此,本研究探讨西格列汀对T2DM患者血糖、CD4+T细胞亚群、炎性因子及氧自由基的影响,以期为其临床应用提供参考。
1 对象与方法
1.1研究对象 选取2017年1月—2018年12月西北大学附属医院 西安市第三医院收治的符合纳入及排除标准的初治T2DM 90例作为研究对象。采用随机数字表法随机将其分为观察组和对照组两组各45例,两组一般资料比较差异无统计学意义(P>0.05),见表1,具有可比性。本研究经医院医学伦理委员会批准同意执行,患者和(或)其家属对本研究知情同意并签署知情同意书。

表1 采用不同方法治疗的2型糖尿病两组一般资料比较
1.2纳入及排除标准 纳入标准:①所有患者均符合T2DM诊断标准[5];②近3个月未服用降糖药物;③空腹血糖(FBG)不超过11.1 mmol/L,糖化血红蛋白(HbA1c)在6.5%~10.0%;④年龄18~70岁;⑤体质量指数20~40 kg/m2。排除标准:①1型糖尿病者;②伴严重器质性病变者;③近期有外伤或感染史者;④伴其他内分泌系统疾病者;⑤妊娠期或哺乳期女性;⑥对本研究所用药物过敏者。
1.3治疗方法 所有患者均进行健康教育,接受饮食控制,加强运动锻炼。观察组予西格列汀(国药准字J20120058,默沙东制药有限公司生产,规格:每片100 mg)100 mg,每日1次口服。对照组予阿卡波糖(注册证号H20130033,拜耳医药保健有限公司生产,规格:每片50 mg)50 mg,每日3次餐时咀嚼口服。两组疗程均为12周。
1.4观察指标 观察比较两组治疗前后血糖指标、CD4+T细胞亚群、炎性因子及氧自由基水平,以及治疗期间不良反应发生情况。①血糖指标包括FBG、餐后2 h血糖(2 h PG)、HbA1c、空腹胰岛素(FINs)、稳态模型胰岛β细胞功能指数(HOMA-β)和稳态模型胰岛素抵抗指数(HOMA-IR),血糖测定采用葡萄糖氧化酶法,HbA1c测定采用高效液相层析法,FINs测定采用放射免疫法,HOMA-β和HOMA-IR采用稳态模型评估法计算,HOMA-β=20×FINs/(FBG-3.5),HOMA-IR=FBG×FINs/22.5。②CD4+T细胞亚群包括辅助性T细胞(Th)1、Th17和Th22,两组均于治疗前后抽取外周静脉血5 ml,采用流式细胞仪(Accuri C6)进行Th1、Th17和Th22检测。③炎性因子包括干扰素-γ(IFN-γ)、白细胞介素(IL)-17A和IL-22;氧自由基包括超氧化物歧化酶(SOD)、丙二醛(MDA)和3-硝基酪氨酸(3-NT)。两组均于治疗前后抽取外周静脉血5 ml应用酶联免疫吸附试验法检测血清IFN-γ、IL-17A、IL-22及SOD、MDA、3-NT水平,IFN-γ、IL-17A和IL-22检测试剂盒购于武汉博士德生物公司,SOD和MDA检测试剂盒购于上海恪敏生物科技有限公司,3-NT检测试剂盒购于上海岚派生物科技有限公司,上述检测均严格按照试剂盒说明书进行操作。
2 结果
2.1血糖指标比较 治疗前,两组FBG、2 h PG、HbA1c、HOMA-β和HOMA-IR比较差异均无统计学意义(P>0.05)。治疗后,两组FBG、2 h PG、HbA1c及HOMA-IR均较治疗前降低(观察组:t=9.721、P<0.001,t=11.664、P<0.001,t=8.103、P<0.001,t=6.470、P<0.001;对照组:t=7.318、P<0.001,t=9.930、P<0.001,t=6.086、P<0.001,t=3.146、P<0.001),HOMA-β较治疗前升高(观察组:t=6.701、P<0.001;对照组:t=4.894、P<0.001),差异有统计学意义。治疗后,观察组FBG、2 h PG、HbA1c及HOMA-IR低于对照组,HOMA-β高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 采用不同方法治疗的2型糖尿病两组治疗前后血糖指标比较
2.2CD4+T细胞亚群比较 治疗前,两组Th1、Th17和Th22比较差异均无统计学意义(P>0.05)。治疗后,两组Th1、Th17和Th22均较治疗前降低,差异有统计学意义(观察组:t=8.892、P<0.001,t=12.071、P<0.001,t=11.879、P<0.001;对照组:t=8.838、P<0.001,t=5.894、P<0.001,t=11.844、P<0.001)。治疗后,观察组Th1、Th17和Th22均低于对照组,差异有统计学意义(P<0.05或P<0.01)。见表3。
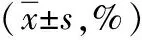
表3 采用不同方法治疗的2型糖尿病两组治疗前后CD4+T细胞亚群比较
2.3炎性因子比较 治疗前,两组IFN-γ、IL-17A和IL-22水平比较差异均无统计学意义(P>0.05)。治疗后,两组IFN-γ、IL-17A和IL-22水平均较治疗前降低,差异有统计学意义(观察组:t=11.039、P<0.001,t=10.871、P<0.001,t=9.574、P<0.001;对照组:t=8.707、P<0.001,t=8.696、P<0.001,t=6.152、P<0.001)。治疗后,观察组IFN-γ、IL-17A和IL-22水平均低于对照组,差异有统计学意义(P<0.05)。见表4。
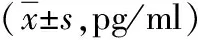
表4 采用不同方法治疗的2型糖尿病两组治疗前后炎性因子比较
2.4氧自由基比较 治疗前,两组SOD、MDA和3-NT水平比较差异均无统计学意义(P>0.05)。治疗后,两组SOD水平较治疗前增高(观察组:t=6.186、P<0.001;对照组:t=3.765、P<0.001),MDA和3-NT水平较治疗前降低(观察组:t=5.808、P<0.001,t=5.777、P<0.001;对照组:t=3.802、P=0.001,t=4.257、P=0.001),差异有统计学意义。治疗后,观察组SOD水平高于对照组,MDA和3-NT水平低于对照组,差异有统计学意义(P<0.05)。见表5。

表5 采用不同方法治疗的2型糖尿病两组治疗前后氧自由基比较
2.5不良反应发生情况比较 治疗期间,观察组无低血糖和其他不良反应发生,患者耐受良好;对照组出现7例胃肠道反应,包括腹胀3例、腹泻2例、恶心2例,经对症处理后均缓解,未对治疗造成影响。治疗期间,两组不良反应总发生率比较差异有统计学意义(χ2=5.577,P=0.018)。
3 讨论
有研究显示,我国T2DM患者血糖达标率不足30%[6]。传统降糖药物在发挥降糖作用时,除可引起低血糖等不良反应外,更关键的不足在于无法抑制胰岛细胞功能衰退。现临床急需寻找一种既能够有效降糖,又具有胰岛细胞功能改善作用的药物。
DPP-4抑制剂作为新型T2DM治疗药物,通过抑制胰高血糖素样肽-1(GLP-1)的降解,以葡萄糖依赖方式增加胰岛素分泌,减少胰高血糖素分泌,从而发挥降糖作用,同时还可保护胰岛β细胞功能[7]。西格列汀具有与DPP-4天然底物相似的结构,能够与DPP-4活性部分竞争性结合,进而提高内源性GLP-1水平,增加胰岛素分泌,达到降糖效果[8]。有研究表明,西格列汀能够降低T2DM患者血糖,且减少低血糖发生,安全性较高[9]。本研究结果显示,治疗后,两组FBG、2 h PG、HbA1c及HOMA-IR均较治疗前降低,HOMA-β较治疗前升高;观察组FBG、2 h PG、HbA1c及HOMA-IR低于对照组,HOMA-β高于对照组,差异有统计学意义。表明西格列汀较阿卡波糖可更有效控制血糖,且对胰岛β细胞有着更好改善作用,与既往报道[10]一致。保护胰岛β细胞功能是DPP-4抑制剂的最大优势,但其具体机制现仍不清楚。
近年研究发现,炎症反应及氧化应激反应参与T2DM的发生和发展,炎性因子和氧自由基表达异常可引起脂肪组织巨噬细胞浸润,阻断胰岛素信号传导通路,进而导致胰岛素抵抗[11]。有研究显示,T细胞介导的免疫反应在T2DM慢性炎症及氧化应激的启动、维持中起着重要作用[12]。CD4+T细胞亚群Th1、Th2、Th17、Th22和调节性T细胞(Treg)等可协调免疫细胞相互作用,是维持免疫稳态的核心因子,Th失衡是造成免疫失衡、导致慢性炎症及氧化应激状态之关键。CD4+T细胞可通过自身或促进其他免疫细胞释放INF-γ和IL-6等各种炎性因子,炎性因子表达增高与胰岛β细胞功能损伤、胰岛素分泌减少、胰岛素抵抗程度和T2DM血管并发症有着紧密关系[13]。有研究发现,T2DM患者外周血各种具有促炎作用的Th比例均增高,相应的炎性因子表达上调,提示Th失衡是造成免疫失衡、引起慢性炎症的关键因素,Th22以及相应细胞因子参与了胰岛素抵抗和胰岛β细胞功能障碍的过程[14]。
IL-22是一种重要的促炎因子,主要由Th17、Th22细胞分泌。IL-22过度表达,可通过和IL-22R相结合,影响信号传导,从而导致胰岛β细胞功能损伤。IL-17是由Th17细胞分泌的一种促炎因子,可诱导T细胞及单核细胞分泌IL-6等各种炎性因子,激活炎症反应[15]。有研究发现,拮抗T2DM大鼠IL-17表达可有效缓解胰岛素抵抗状态[16],提示IL-17在胰岛β细胞功能损伤中扮演了重要角色。Th1分泌的IFN-γ能够增加选择性黏附分子的表达,促进细胞凋亡,从而造成胰岛β细胞功能障碍[17]。SOD是机体清除氧自由基的重要防御酶,可减轻氧化应激损伤,其水平可反映机体的抗氧化能力。MDA是脂质过氧化反映的最终产物,其水平可反映机体脂质过氧化速率、程度及氧自由基清除能力[18]。有研究显示,T2DM患者血清MDA水平明显增高,SOD水平明显降低[19]。3-NT也是反映氧化应激的重要标志物,在高血糖状态下,机体一氧化氮和过氧化氢等产生增多,进而引起3-NT增多,而3-NT可促使细胞内酶变性,并加重炎症反应[20]。
本研究结果显示,治疗后,两组Th1、Th17、Th22,IFN-γ、IL-17A、IL-22和MDA、3-NT水平均较治疗前降低,SOD水平均较治疗前升高;观察组Th1、Th17、Th22,IFN-γ、IL-17A、IL-22和MDA、3-NT水平低于对照组,SOD水平高于对照组,差异有统计学意义。提示西格列汀能够有效平衡Th,降低炎性因子及氧自由基水平,缓解炎症及氧化应激反应,改善患者免疫状态。Barbieri等[21]研究发现,西格列汀能够减轻T2DM患者炎症反应及氧化应激,减少血糖波动,与本研究结果基本一致。因此,纠正CD4+T细胞亚群失衡、减轻炎症反应及氧化应激可能是西格列汀提高血糖控制效果、保护胰岛β细胞功能的重要机制。
综上所述,西格列汀治疗T2DM能够更好地控制血糖,改善胰岛素抵抗及胰岛β细胞功能,其作用可能与调节CD4+T细胞亚群平衡和下调IFN-γ、IL-17A、IL-22、MDA、3-NT有关。另外,西格列汀治疗T2DM安全性也较高。
